等离子体处理乙丙交酯共聚物表面固定胶原的研究
崔 媛,段 潜,李艳辉
(长春理工大学,长春 130022)
等离子体处理乙丙交酯共聚物表面固定胶原的研究
崔 媛,段 潜,李艳辉
(长春理工大学,长春 130022)
选择等离子体对乙丙交酯共聚物(PL GA)表面进行活化处理来接枝胶原。通过测定等离子体处理后PL GA材料表面水接触角确定最佳处理功率为60W,时间5min。XPS分析确定胶原表面的羧基与PL GA表面等离子体激活的羟基发生了反应生成酯基,而使胶原接枝到PL GA表面。选用小鼠胚胎内皮成纤维细胞(3T3)在PL GA材料表面培养。实验定性观察确定胶原接枝有利于细胞的黏附和增殖。采用四甲基偶氮唑蓝比色法(MTT)对不同时期两种细胞生长情况进行定量分析,结果表明,接枝胶原的存在改善了细胞黏附作用,加快了细胞的增殖速度。
PL GA;等离子体;胶原
乙丙交酯共聚物(PL GA)是羟基乙酸和乳酸聚合而成的无功能侧基的共聚物,它兼有聚乙交酯和聚丙交酯二种聚酯材料的优势。该共聚物结构规整,组成固定,降解性能稳定。PL GA可以通过调节组成、分子量来调节其生物相容性、生物降解速度、增强材料的强度和模量,因此,PL GA已被广泛地应用于生物医学工程领域,如药物缓释体系,生物体吸收性缝合材料,内置隔离材料,骨科固定及组织修复[1-3]。但是作为组织工程材料,PL GA同时也存在的许多的缺点,PL GA中有大量的酯键,亲水性差,降低了它与其他物质的生物相容性这会导致体内的排异反应,形成发炎、感染、本体组织坏死和血栓等,因此,实际应用中要对材料进行改性处理[4]。等离子体表面改性由于不影响材料本体特征,并能在材料表面引入大量可供反应的化学基团,因此,这种方法目前在生物材料表面改性方面得到了越来越广泛的应用[5-7]。而在材料表面固定胶原,也是目前提高生物材料表面相容性的一个有效手段[8-10]。本研究采用等离子体处理PL GA膜材料表面,在其上面形成了具有可供反应的官能团后,在上面固定胶原,并通过一系列的表征分析手段确定胶原的接枝和细胞相容性的提高。
1 实验
1.1 原材料
PL GA,分子量8万,乙醚沉降提纯,备用;胶原:实验室自制[8];MTT(C18H18BrN5S):美国 AMERSCO公司;培养基(DMEM):GIBCOtm(USA);标准胎牛血清,3T3(小鼠胚胎内皮成纤维细胞):中国医学科学院生物医学工程研究所;氯仿、醋酸(HAc)、DMSO(二甲基亚砜):分析纯,北京鼎国生物技术有限责任公司;其他试剂均为分析纯。
1.2 等离子体表面处理
将纯化过的 PL GA溶解在氯仿中,配成0.1%(W/V)的溶液,将玻片放入底面平整的平皿中,调成水平。将定量的PL GA溶液分别加入平皿中,缓慢蒸发溶剂,在硅化好的玻片表面干燥成膜。将表面铺有PL GA膜的玻片放在CTP-2000k高性能等离子体辉光放电发生器腔内,按不同的等离子处理功率对材料进行辉光放电表面处理。通过测定材料表面的水接触角,确定最佳的处理条件。
1.3 胶原在PLGA表面接枝固定及表征
表面激活的PL GA膜用磷酸盐缓冲溶液(PBS)透析过的胶溶液直接涂覆表面,4℃放置6h后在37℃放置1h,去掉表面凝胶薄层。然后用0.3%(V/V)的丙二酸浸泡30min除去未接枝的胶原,然后漂洗薄膜4~5次,PBS漂洗4~5次,三蒸水漂洗 5~6次,晾干,并在室温测定样品表面水接触角(接触角-DSA100,KRUSS公司)。
从前面的实验结果中,选择最好的处理条件,接枝胶原,进行 X射线光电子能谱(XPS)测试分析,未处理的PL GA膜做对照,来确定胶原是否成功地在PLGA表面接枝固定。其中 XPS(VG ESCALAB M KⅡ)采用固定通过能模式,激发源为Mg标准源 Ka线,Mg靶电压8.0kV,靶功率240W,X射线入射角为45°,分析室气压保持 2.6×10-7Pa。
1.4 接枝胶原后材料细胞相容性评价
选择3T3(小鼠胚胎内皮成纤维细胞)对接枝胶原前后的PL GA进行细胞相容性评价。将细胞种在材料表面,细胞接种密度为1×104个/mL。观察细胞在材料表面上培养24h时的状态,确定胶原固定是否可以促进细胞黏附和增强材料的细胞相容性。
通过MTT分析确定细胞在材料表面的生长情况,通过酶联免疫检测仪(Multiskan M K3,Thermo Electron Corporation)测定吸光值,反映出细胞的增殖或衰减。
2 结果与讨论
2.1 PLGA等离子体处理接枝胶原前后接触角变化
用等离子体在室温下激活PL GA表面,处理功率为40,50,60,80W和160W,处理时间2,5,10min和20min。将测得的水接触角平均值列于表1中。
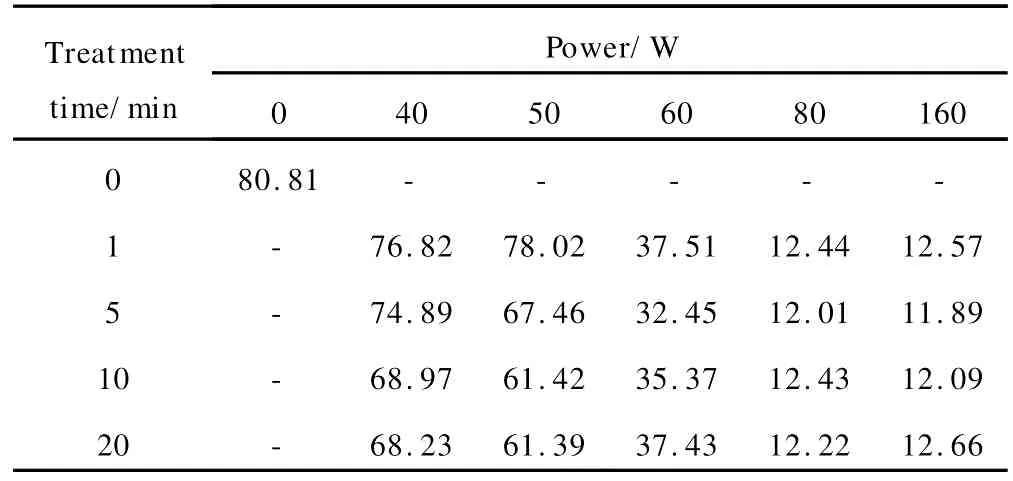
表1 等离子体处理的PLGA表面水接触角(°)平均值Table 1 Average value of water contact angle(°)of each different plasma treated PL GA
从表1可以看出,在一定的等离子体处理时间条件下,PL GA经过表面等离子体处理后(LP-PL GA),水接触角有了明显的下降,但是在低处理功率下(40,50W),PL GA表面水接触角下降不多;随着处理功率的增加(90W),PL GA表面水接触角出现突降;在处理功率达到80W后,PL GA表面水接触角达到最低,并且基本保持稳定。在大功率(>80W)处理条件下,PL GA表面水接触角随处理时间的变化不大;处理功率为60W时,处理时间的增加反倒不利于材料亲水性的提高。亲水性很强的表面不利于蛋白质的吸附,从而不利于细胞的黏附。
等离子体功率不同的时候,对材料表面造成的轰击效果会出现差异,材料表面的粗糙程度,引入的活性基团都会受到影响,因此会出现亲水性的差异。实验数据显示,60W的处理功率得到的几个水接触角数据范围都在材料亲疏水平衡范围内,因此,本实验选择60W的处理功率对PL GA进行表面等离子体处理接枝胶原,理想的处理时间为5min。如果处理时间过长,材料表面被过渡刻蚀,不但影响材料的本体性能,还有可能使得材料表面的亲水活性基团湮灭,亲水性下降。
通过上面的实验选择出处理参数(60W,5min)对PL GA表面进行等离子体处理,然后接枝胶原。测定表面接枝胶原的 PL GA(COL-PL GA)的水接触角,取10个测量点,取平均值为36.45°。可见胶原的接枝也可以提高PL GA的亲水性,而且能够保持材料表面最佳的黏附细胞的亲水范围(最佳的接触角为20°~40°)。
2.2 PLGA表面接枝胶原前后表面XPS分析
用XPS对几种PL GA在等离子体接枝前后样品的表面进行表征,通过表面元素分析和C1s谱的差别确定等离子体对PL GA改性的效果,同时确定胶原是否在PL GA表面接枝。
对PLGA,LP-PLGA和COL-PLGA膜表面进行XPS测试分析,得到的元素相对摩尔分数结果列于表2。

表2 样品表面元素相对摩尔分数Table 2 Relative mole fraction of elements of different samples
从表2可以看出,未经处理的PL GA表面氧元素含量比较高,不含氮元素;经过空气等离子体处理后,材料表面出现少部分氮元素,同时氧元素的含量大幅度增加;而对 COL-PL GA来说,表面氧元素含量下降,氮元素含量增加。说明等离子体处理可以改变PL GA表面的元素组成,同时从氮含量增加可以判断胶原在材料表面有效接枝。结合C1s谱分析PL GA表面改性过程中可能发生的反应。图1给出了几种样品XPS C1s分峰图。

图1 XPS C1s分峰图(a)PL GA膜C1s分峰;(b)LP-PL GA膜 C1s分峰;(c)COL-PL GA膜C1s分峰Fig.1 XPS C1sdivide peak chart(a)PL GA film’s C1s;(b)LP-PL GA film’s C1s;(c)COL-PL GA film’s C1s
PL GA膜的C1s谱图可以分成3个主峰,如图1(a)所示,分别是结合能在284.6eV的C—H和C—C峰,286.2eV的C—O(C—OH)峰和288.6 eV的O—C=O(COOH)。PL GA等离子体处理后,LP-PU表面C1s谱分成的三个主峰与PL GA类似,如图1(b)所示。胶原接枝后,COL-PL GA膜的C1s谱可以分成4个主峰,如图1(c)所示,分别是结合能在284.4eV的C—H和 C—C峰,285.3eV的 C—N和 O—CO—C峰,结合能在286.5eV的C—O峰和288.4eV的O—C=O。根据上面分峰的结果,计算出每个样品表面基团相对摩尔分数,结果列于表3中。

表3 XPS C1s分峰分析结果Table 3 Fraction of carbon functional groups from high-resolution C1sXPS peaks
对图1和表3对照分析,可以看出,PL GA材料表面的O—C=O含量较高,没有含N官能团,见图1(a);经过等离子体改性的PL GA材料表面含氧的官能团含量上升,其中C—OH含量上升近10%,COOH含量上升2%左右,但是没有出现带有端基N的官能团,见图1(b);而前面的元素分析结果在LP-PL GA表面出现的N元素,可能由于含量有限而在C1s分峰时空气等离子体处理 PL GA表面生产的N—C=O(结合能在287.2eV附近)被屏蔽在O—C=O峰中。
胶原接枝后,C1s谱出现了新的子峰,结合能在285.3eV的C—N和O—CO—C峰,相对摩尔分数高达30.04%,同时,C—O键的摩尔分数下降到17.37%。说明PL GA表面经过等离子体改性后材料表面性能发生了改变。C—O键的含量下降和C—N与O—CO—C*的出现说明胶原表面的羧基与 PL GA表面等离子体激活的羟基发生了反应生成酯基,胶原通过共价接枝到PL GA表面。
2.3 胶原接枝前后3T3细胞在PLGA表面不同阶段生长状态
将3T3细胞接种在 PL GA,LP-PL GA和COLPL GA表面,培养24h后开始观察细胞黏附和生长状态,细胞在玻片上的状态作为对照,如图2所示。
从图2(a)可以看出,PL GA表面贴壁生长的细胞刚刚进入了增殖期,细胞增殖速度比较慢,但是已经可以看到细胞的分化;LP-PL GA和玻片表面贴壁的细胞已经出现大量增殖的现象;而COL-PL GA表面贴壁的细胞增殖迅速,视野里细胞基本连接成片,部分细胞已经出现接触抑制,细胞向长满单层的趋势发展。3T3细胞在长满单层后可以向空间发展,营养足够的话可以长成三维结构。
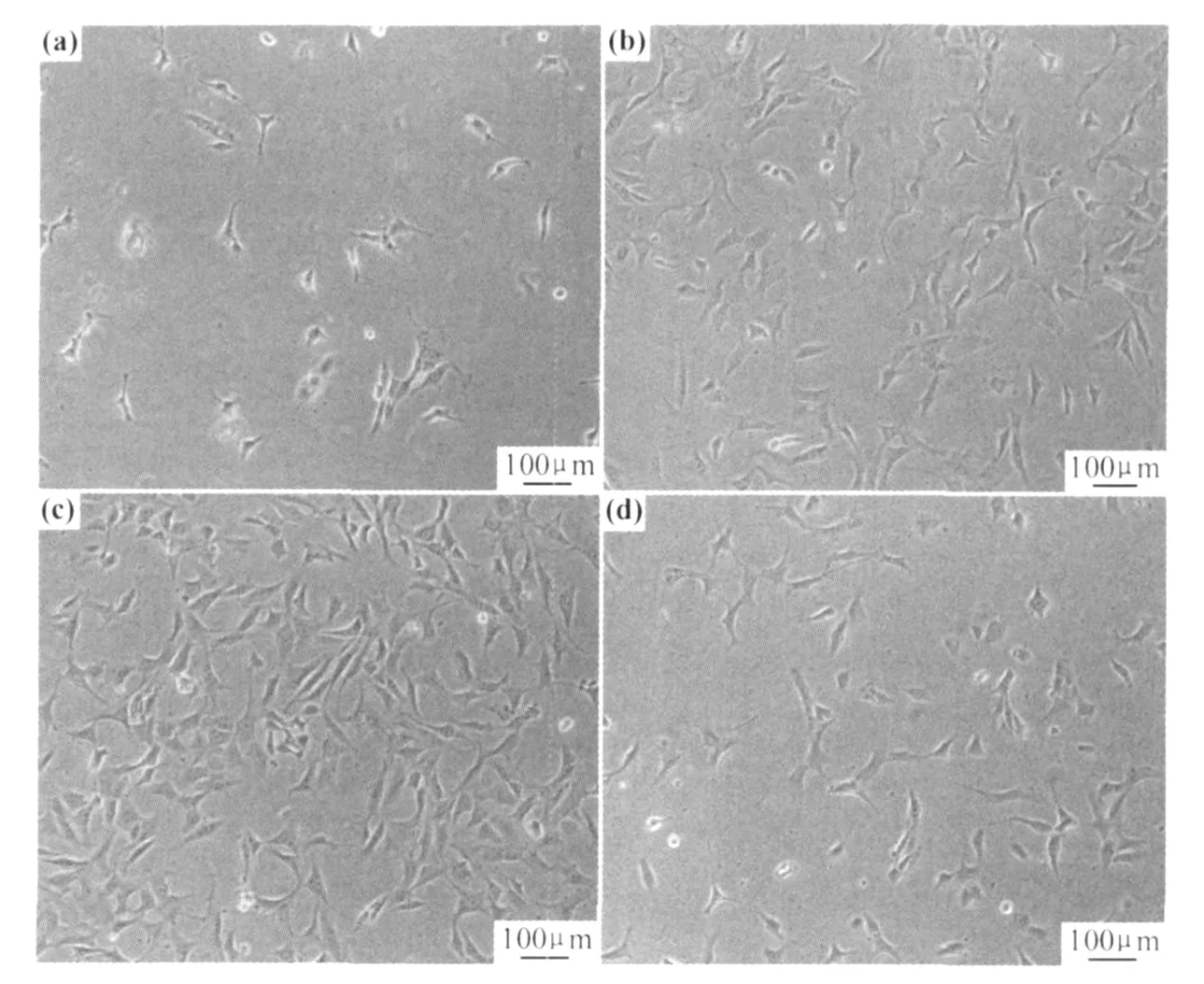
图2 3T3在培养24h后在材料表面黏附和生长状态(a)PL GA;(b)LP-PL GA;(c)COL-PL GA;(d)玻璃Fig.2 3T3 cell adhesion and living state after 24h incubation(a)PL GA;(b)LP-PL GA;(c)COL-PL GA;(d)glass
可看出,等离子体处理和胶原的接枝都有利于提高PL GA的细胞相容性,胶原接枝更为理想。通过实验观察,未经处理的 PL GA膜表面细胞的黏附性差,细胞在PL GA表面生长缓慢,而接枝胶原的PL GA膜表面细胞黏附能力强,细胞增殖快,因此,通过胶原接枝改性PL GA表面的细胞相容性是一个有效途径。
经过以上定性分析可以看出,材料表面经过胶原接枝后,细胞在材料表面黏附和生长增殖好于未接枝前,且都好于玻片,说明经过胶原接枝后材料表面的细胞相容性得到了大幅度的提高。因此,通过胶原接枝改性材料表面生物性能是一个简便而有效的途径。
2.4 MTT实验定量分析活细胞生长情况
为进一步确定材料表面活细胞的相对数量,引入MTT实验进行测试分析。3T3细胞培养时间都为24h。
图3给出了3T3细胞在PL GA类材料表面生长24h后,进行MTT分析测试,同样经过方差计算得到MTT统计图。空白组还是只加培养基没加材料进行细胞培养的对照组。
从图3可以看出,PL GA在等离子体处理后,3T3细胞在LP-PL GA表面培养24h,材料表面活细胞的数量明显高于PL GA,说明等离子体在提高PL GA表面细胞黏附和增殖有一定的促进作用;接枝胶原后的PL GA上的活细胞数量达到最高,而且高于对照组。证明在细胞培养进入增殖期时,PL GA表面接枝胶原的存在改善细胞黏附的同时,加快了细胞的增殖速度,和前面定性分析的结果一致。

图3 3T3活细胞在不同材料表面的数量比较Fig.3 Comparation of number of 3T3 cell living on different sample’s surface
通过以上实验分析说明,等离子体处理接枝胶原后,PL GA的表面亲水性得到了改善,其细胞相容性得到了大幅度的提高。因此,根据以上的实验分析结果,可以建立一个模型,确立等离子体处理和胶原接枝在提高材料表面生物学性能的可行性,进而指导进一步的生物实验乃至临床应用。
3 结论
(1)通过等离子体表面处理,在 PL GA表面引入可供反应的羟基和羧基等活性基团。可直接在其表面固定胶原。
(2)等离子体处理最佳条件(处理功率60W,处理时间5min)用接触角测试获得,并用XPS分析胶原固定前后PL GA表面的变化,分析表明,这种方法可以使胶原在其表面固定。
(3)通过在材料表面培养细胞确定材料的细胞相容性。结果表明,经等离子处理并固定了胶原的PLGA,细胞在其上的生长和增殖都得到了大幅度的提高,这种方法可以提高材料的细胞相容性。
[1] SHIH C,WALDRON N,ZENTENR G M.Quantitative analysis of ester linkages in poly(dl-lactide)and poly(dl-lactide-co-glycolide)[J].Journal of Controlled Release,1996,38(1):69-73.
[2] 张宗勇,闫玉华.聚乳酸在生物医学领域中的应用[J].生物骨科材料与临床研究,2005,2(5):44-47.
[3] ANDO S,PUTNAM D,PACK D W,et al.PL GA microspheres containing plasmid DNA:Preservation of supercoiled DNA via cryopreparation and carbohydrate stabilization[J].Journal of Pharmaceutical Sciences,1999,88(1):126-130.
[4] THULL R.Surface functionalization of materials to initiate autobiocompatibilization in vivo[J].Materialwiss Werkst,2001,32(12):949-952.
[5] CHU P K,CHENA J Y,WANGA L P,et al.Plasma-surface modification of biomaterials[J].Materials Science and Engineering:R:Reports,2002,36(5-6):143-206.
[6] CATARINA M,YANG Y,CARNES D L,et al.Modulating bone cells response onto starch-based biomaterials by surface plasma treatment and protein adsorption[J].Biomaterials,2007,28(2):307-315.
[7] SHEN H,HU Xi-xie,FEI Y,et al.Combining oxygen plasma treatment with anchorage of cationized gelatin for enhancing cell affinity of poly(lactide-co-glycolide)[J].Biomaterials,2007,28(29):4219-4230.
[8] LI Yan-hui,HUANG Yu-dong.The study of collagen immobilization on polyurethane by oxygen plasma treatment to enhance cell adhesion and growth[J].Surface and Coatings Technology,2007,201(9-11):5124-5127.
[9] WANG Ying-jun,KE Yu,LI Ren,et al.Surface engineering of PHBV by covalent collagen immobilization to improve cell compatibility[J].Journal of Biomedical Materials Research Part A,2009,88A(3):616-627.
[10] DUAN Yuan-yuan,WANG Zhong-yi,YAN Wei,et al.Preparation of collagen-coated electrospun nanofibers by remote plasma treatment and their biological properties[J].Journal of Biomaterials Science,Polymer Edition,2007,18(9):1153-1164.
Investigation of Plasma Treatment and Collagen Immobilization on the Surface of Poly(lactid-glycolide acid)
CUI Yuan,DUAN Qian,LI Yan-hui
(Changchun University of Science and Technology,Changchun 130022,China)
For collagen is a major component of the extracellular matrix,when the surface of poly(lactid-glycolide acid)(PL GA)is grafted with collagen,cytocompatibility of PL GA will be improved.Plasma treatment is selected to immobilize collagen on the surface of PL GA.Optimum power and treating time of plasma are determined by contact angle test.The results indicate they are 60W and 5min,respectively.XPS analysis reveals that carboxy groups on collagen are reacted with actived hydroxyl groups on the surface of plasma treated PL GA to form ester groups.Then collagen is immobilized on PL GA.Cytocompatibility evaluation of collagen immobilized PL GA(COL-PL GA)was carried out by seeding 3T3 cells on the surface of COL-PL GA.Quanlitative and quantitative analysis proved that cell adhesion and proliferation are improved after collagen grafting.Quantitative result is obtained by MTT assay in cell living period.
PL GA;plasma;collagen
TQ225.24
A
1001-4381(2011)06-0058-05
国家自然科学基金资助项目(50903009);吉林省科技发展计划项目(20100115)
2010-08-01;
2010-12-22
崔媛(1977—),女,博士研究生,助理研究员,主要研究方向为功能高分子材料合成及应用,联系地址:长春市卫星路7089号,长春理工大学化学与环境工程学院(130022),E-mail:cuiyuan@cust.edu.cn

