食物中酚类抗氧化成分的色谱法筛选研究进展
张清安,范学辉,张志琪
(1.陕西师范大学食品工程与营养科学学院,陕西西安 710062; 2.陕西师范大学体育学院,陕西西安 710062; 3.陕西师范大学化学与材料科学学院,陕西西安 710062)
食物中酚类抗氧化成分的色谱法筛选研究进展
张清安1,范学辉2,张志琪3
(1.陕西师范大学食品工程与营养科学学院,陕西西安 710062; 2.陕西师范大学体育学院,陕西西安 710062; 3.陕西师范大学化学与材料科学学院,陕西西安 710062)
概述了氧化、抗氧化、酚类抗氧化物质及其色谱法筛选的研究进展,展望了未来该领域研究的发展趋势。
酚类,抗氧化,色谱,筛选
为了从众多酚类物质中快速筛选出具有抗氧化活性的成分,研究者们开展了大量体内、外模型筛选研究[1-4]。但这些实验方法不具备分离功能,仅能评价那些单一物质的抗氧化性能,或鉴定那些常规的抗氧化物质,或评价混合体系总的抗氧化能力,至于要给出体系中某个单一成分的功能及其对总抗氧化能力的贡献却是一件很难完成的任务。传统的解决方法是先对复杂体系进行物质分离,得到单体后再进行鉴定和活性评价,但这些方法费时、费力,更重要的是由于物质间的相互作用或分离过程中其他作用因素(如降解等),待分开后它们已失去作用,而且对微量物质制备比较困难。因此,如何利用现代分离、分析和鉴定技术,快速、有效的从复杂体系中筛出具有抗氧化活性的成分,即高分辨筛选(Highresolution screening,HRS)或在线同时评价复杂体系中各组分抗氧化活性,已成为开发研究抗氧化成分及产品的关键技术。本文就色谱法筛选酚类抗氧化成分的研究进展做一综述。
1 酚类抗氧化物质
添加抗氧化剂被认为是有效解决氧化或氧化应激作用较为有效的手段。因此,抗氧化剂和抗氧化(生物)化学成了当今的热门话题,尤其寻找合适有效的外源抗氧化剂更成了科技工作者研究兴趣所在。外源抗氧化剂的获取途径有合成法和从生物体内提取法。与天然抗氧化剂相比,虽然合成抗氧化剂有易得、稳定等优点,但由于存在安全性问题,人们还是对天然抗氧化剂寄予了厚望。天然抗氧化剂也称为生物抗氧化剂,主要是指在生物体内合成的具有抗氧化作用或诱导抗氧化产生的一类物质,可以来自植物、动物或微生物。其中植物多酚就是一类广泛存在于自然界,且来源丰富的天然抗氧化剂。
多酚(Polyphenols),又名单宁、鞣质,是一类广泛存在于植物体内的次生代谢物质(Secondary metabolic compounds)的混合物,主要存在于植物的皮、根、叶、果中,含量仅次于纤维素、半纤维素和木质素。将其用于鞣制皮革是人类最初对植物中所含多酚类化合物的利用,并将这类化合物称为植物单宁(vegetable tannins)[9]。1981年,Haslam提出了植物多酚这一术语,指那些植物整体或某一部分的存活非必需的化合物,包括单宁及相关化合物[10]。多酚类化合物结构中常连接有酚羟基、甲氧基、甲基、异戊烯基等官能团,基本骨架是由丙二酰辅酶A和桂皮酰辅酶A生物合成,此外还与单糖、双糖、三糖和酰化糖等结合,以苷的形式存在。正是由于多酚的独特结构赋予了它独特的化学性质,以及在维持机体内稳态、对某些疾病的预防和治疗方面的独特作用,因而受到了世人的关注,成为目前国内外研究热点之一。
尽管对多酚类的研究开发方兴未艾,且大量研究也表明多酚类(尤其黄酮类)化合物在抗氧化、抗诱变、抗辐射、抗肿瘤、抑菌、酶抑制等方面具有良好的作用,但一般都是以混合物的形式进行研究,且多在体外评价,其具体起作用的成分、作用的分子药理机理、作用靶点等尚不太清楚,在体内能否真正起这些作用也还不确定。因此,有必要先筛选出具有抗氧化作用的成分,然后再对其进行深入系统研究。
2 酚类抗氧化物质的色谱法筛选研究现状
色谱技术是目前分离复杂体系最为有效的常用工具之一,它包含高速逆流色谱、超临界流体色谱、气相色谱、毛细管电泳色谱、凝胶色谱、高效液相色谱、快速液相色谱和超高压液相色谱。它们能提供保留时间、成分含量等方面的信息(尤其有相应的标准品时),因此得到了广泛应用。
Winston等[11]和Soliman等[12]分别就气相色谱法筛选抗氧化物质进行了研究。Shi et等[13]报道了高速逆流色谱耦合DPPH自由基反应体系从植物提取物中筛选抗氧化物的研究方法。Magalhães等[14]对近年来基于清除自由基或测定总还原能力原理而建立的流动注射筛选抗氧化成分方法的应用情况进行了详细综述。总之,目前已有不少筛选方法报道,而且就色谱尤其高效液相色谱及其耦合技术用于从混合体系中筛选活性成分报道最多[15-16]。据不完全统计,截至2010年10月国内外共有近60篇相关文献报道。目前色谱(尤其液相色谱)及其耦合技术筛选抗氧化成分主要有两种形式∶离线法筛选和在线法筛选。
2.1 离线筛选法
离线法也称柱前反应法,其基本原理是将酚类提取物先与某些特定自由基(如DPPH·和ABTS+·)反应,然后将提取物原液及其与自由基的反应液分别进样进行液相色谱分离测定,由于混合物中那些具有清除自由基的成分在反应后含量减少,因此在色谱图上主要表现在峰高或面积的变小,最后通过比较两个色谱图中峰高或峰面积的变化即可确定具有抗氧化活性的峰(成分),从而筛选出抗氧化成分。Shui等[17]最先报道了HPLC-DAD(UV)离线法从星果中筛选抗氧化活性物质,但由于这种方法对那些紫外吸收不敏感的抗氧化活性峰不太有效,所以他们又对该法进行了改进,并提出以反应前后离子信号强度的变化来筛选抗氧化活性物质[18-20]。Toshiya等[21]、Yao等[22]和符军放[23]也分别报道了用离线法从番石榴、台湾香檬、金丝桃、荞麦和蜂胶中筛选抗氧化活性物质的研究。但由于该方法易出现假阳性,因此应用较少。
2.2 在线筛选法
在线筛选法又可分为∶TLC(ThinLayer Chromatography)生物自显影筛选法和HPLC耦合在线筛选法。
TLC与生物活性测定相结合的自显影筛选法具有操作简单、耗费低、灵敏度和专属性高的特点,是一种快速测定生物活性的方法。TLC生物自显影技术在筛选抗氧化剂时往往采用清除自由基法,由于活性氧自由基都不稳定,因此稳定的DPPH·成为首选。
其原理如下∶首先使样品(混合物)在薄层板上进行分离,然后在薄层板上喷洒DPPH·溶液(紫色),经过一定时间后,如果样品中某组分具有抗氧化活性,则它会清除DPPH·而显黄色,其余不具有抗氧化活性的组分依旧显紫色,这样就可以判断哪些组分具有抗氧化活性,根据颜色的深浅不同,还能判断抗氧化活性的大小[24-25]。除了TLC-DPPH·方法外,还可用β-胡萝卜素进行检测。如Torres[26]和Silva[27]等将0.05%β-胡萝卜素氯仿溶液喷洒到待测薄层板上显色,用UV254nm光或自然光照射后,背景色褪去呈白色,而活性位点呈黄色。
与其它色谱分离技术相比,TLC生物自显影技术的不足之处是TLC的分辨率与分离能力不是很强,此外,它的检测方式也限制了其灵敏度。
HPLC耦合在线色谱筛选即柱后反应或柱后衍生筛选,其基本原理是先利用色谱柱对混合物进行分离并用自配检测器记录信号,或者也可先对柱后流出液进行适当分流,然后将流出液或分流液与适当自由基试剂在反应环中进行反应或衍生,最后进入另外一个检测器进行检测,通过两个检测器记录信号的比较(凡是有抗氧化活性的峰在第二个检测器上有一对应的负峰或倒峰)即可筛出有活性的成分。根据衍生装置、衍生试剂(化学发光试剂或自由基)和第二个检测器的差异,通常又可分为∶HPLCCL耦合在线筛选法和HPLC-DPPH·(ABTS+·)耦合在线筛选法。
HPLC-CL耦合筛选法中所用的衍生物质是鲁咪诺和双氧水,所用外加检测器为化学发光检测仪。HPLC-CL法最早被报道用来在线分离和测定微量金属元素,通过鲁咪诺氧化实验,该法现常被用来测定脂质初级氧化产物和具有抗氧化能力的物质。
Dapkevicius等[28]最先报道了HPLC-CL从植物粗提物中直接测定抗氧剂的方法(所用装置见图1),并对柱后鲁咪诺反应条件和试剂顺序进行了优化研究。利用该法还成功从百里香和鼠尾草提取物中筛选出了抗氧化物质。
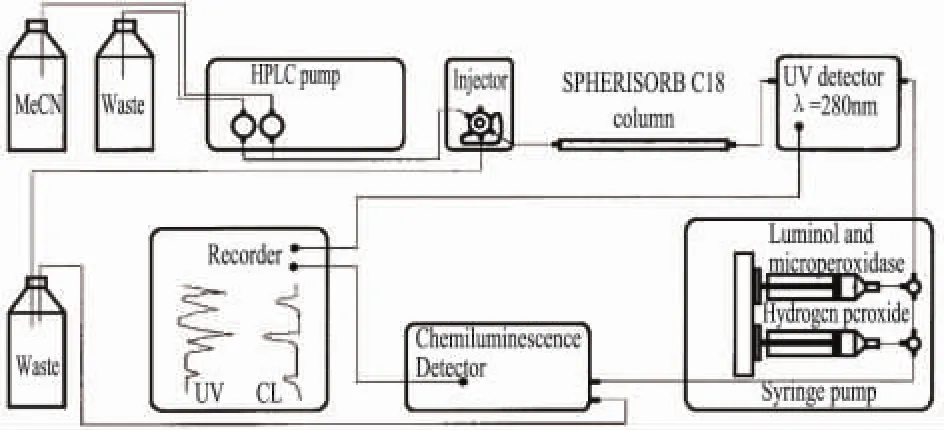
图1 HPLC-CL在线法筛选抗氧化物质示意图
HPLC-CL耦合在线筛选法的局限[29]∶对流动相有特殊要求,不能和甲醇-水洗脱溶剂有效相溶;需要复杂、昂贵的发光及检测设备和试剂;对待测物也有一定要求,这也许是该法未被普及和广泛应用的主要原因。
HPLC-DPPH·(ABTS+·)法是目前应用最广的用来筛选抗氧化物质的方法。其基本思路是使色谱柱分离出的物质与DPPH·(ABTS+·)自由基在反应环中衍生,根据反应后色谱图中倒峰的数量和大小,即可筛选出提取物中的活性抗氧化成分。由于DPPH·(ABTS+·)自由基相对稳定,而且它们的原溶液分别在517nm和734nm左右具有强吸收,当有抗氧化物质存在时这些自由基会与之发生反应,并最终使其吸光度降低,因此在柱后反应筛选抗氧化物质中得到了广泛应用。
Koleva等[30-31]最先报道了从混合物中在线选择性测定DPPH·和ABTS+·两种自由基清除物的方法(见图2),并对影响吸光度的参数(自由基溶液浓度、反应时间、流动相的组成和酸度、抗氧化物质的化学特性和浓度等)进行了系统研究。
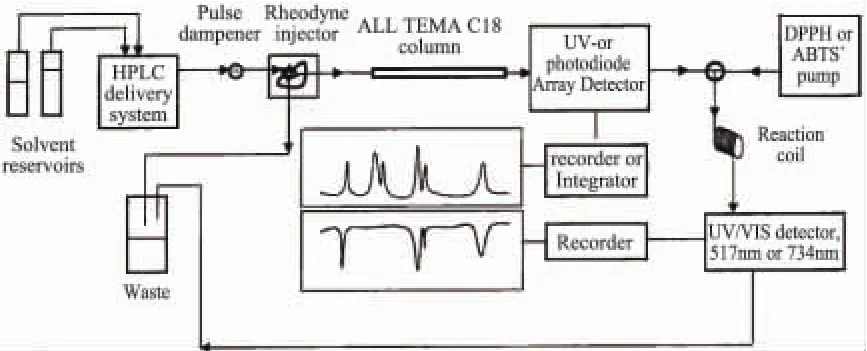
图2 HPLC-DPPH·(ABTS+·)在线法筛选抗氧化物质典型示意图
由于DPPH孤对电子的存在,在有机溶剂中较为稳定,517nm处有深紫色强吸收,有现成的商品且配制简单方便,所以在抗氧化研究中使用最多。
与HPLC-CL在线筛选法相比,HPLC-DPPH·法的优点在于所需设备简单(仅需一注射泵或蠕动泵,不需荧光检测器)、基线稳定、试剂稳定便宜、操作简单、流动相既可进行梯度洗脱也可进行等度洗脱、流动相酸度可调。因此,自Koleva首次将HPLC-DPPH·(ABTS+·)法用于从混合物中在线筛选自由基清除剂或抗氧化物质以来,关于该方法或由其所改进方法的应用已有较多报道。
3 展望
总之,与传统的不具备分离功能且以混合物的总抗氧化能力为基础的化学评价法相比,虽然HPLC-DPPH·(ABTS+·)耦合筛选法有很大的改进和优势。但由于这些抗氧化实验是在体外进行,因此其结果并不能真正反映细胞生理状况,也没有考虑生理活性和代谢问题。另外,在疾病预防和健康促进方面,清除自由基也远不是抗氧化剂的活性作用机制;同时,动物模型和人体实验法代价过高也不太适合用于食品和膳食补剂中抗氧化剂的初级筛选。因此,有必要在动物研究和人体临床实验之前用培养细胞模型来开展抗氧化研究,但该方法的局限是不能评价混合物中的单个成分。所以,如果能将该方法和HPLC-DPPH·(ABTS+·)耦合在线筛选法有效结合在一起从而对活性成分进行筛选和表征,将具有重要的科学理论意义和应用价值。
[1]Ferreres F,Valentāo P,Pereira J A,et al.HPLC-DAD-MS/ MS-ESI Screening of Phenolic Compounds in Pieris brassicae L. Reared on Brassica rapa var.rapa L[J].Journal of Agricultural and Food chemistry,2008,56:844-853.
[2]Weisz G M,Kammerer D R,Carle R.Identification and quantification of phenolic compounds from sunflower(Helianthus annuus L.)kernels and shells by HPLC-DAD/ESI-MSn[J].Food Chemistry,2009,115:758-765.
[3]Dugo P,Mondello L,Errante G,et al.Identification of Anthocyanins in Berries by Narrow-Bore High-Performance Liquid Chromatography with Electrospray Ionization Detection[J].Journal of Agricultural and Food chemistry,2001,49:3987-3992.
[4]Carini M,Aldini G,Furlanetto S,et al.LC coupled to ion-trap MS for the rapid screening and detection ofpolyphenol antioxidants from Helichrysum stoechas[J].Journal of Pharmaceutical and Biomedical Analysis,2001,24:517-526.
[5]郑荣梁.自由基生物学[M].北京:高等教育出版社,1992: 1-46.
[6]陈瑾散.自由基与衰老关系的研究进展[J].川北医学院学报,2004,19(1):207-209.
[7]李勇,孔令青.自由基与疾病研究进展[J].动物医学进展,2008,29(4):85-88.
[8]尤新.食品抗氧化剂与人体健康[J].食品与生物技术学报,2006,25(2):l-7.
[9]石碧,狄莹.植物多酚[M].北京:科学出版社,2000.
[10]Haslam E.Plant polyphenol-vegetable tannins revisited[M].Cambridge:Cambridge University Press,1989.
[11]Winston G W,Regoli F,Dugas A J,et al.A rapid gas chromatographic assay for determiningoxyradicalscavenging capacity of antioxidants and biological fluids[J].Free Radical Biology&Medicine,1998,24(3):480-493.
[12]Soliman M A,Pedersen J A,Suffet I H.Rapid gas chromatography-mass spectrometry screening method for human pharmaceuticals,hormones,antioxidants and plasticizers in water[J].Journal of Chromatography A,2004,1029:223-237.
[13]Shi S,Zhou H,Zhang Y,et al.Hyphenated HSCCC-DPPH for rapid preparative isolation and screening of antioxidants from selaginella moellendorffii[J].Chromatographia,2008,68:173-178.
[14]Magalhães L M,Santos M,Segundo M A,et al.Flow injection based methods for fast screening of antioxidant capacity[J]. Talanta,2009,77:1559-1566.
[15]Shi S,Zhou H,Zhang Y,et al.Coupling HPLC to on-line,post-column(bio)chemical assays for high-resolution screening of bioactive compounds from complex mixtures[J].Trends in Analytical Chemistry,2009,28(7):865-877.
[16]Niederländer H A G,van Beek T A,Bartasiute A,et al. Antioxidant activity assays on-line with liquid chromatography[J].Journal of Chromatography A,2008,1210:121-134.
[17]Shui G,Leong L.Analysis of polyphenolic antioxidants in star fruit using liquid chromatography and mass spectrometry[J]. Journal of Chromatography A,2004,1022:67-75.
[18]Shui G,Leong L.An improved method for the analysis of major antioxidants of Hibiscus esculentus Linn[J].Journal of Chromatography A,2004,1048:17-24.
[19]Shui G,Leong L.Separation and determination of organic acids and phenolic compounds in fruit juices and drinks by highperformance liquid chromatography[J].Journal of Chromatography A,2002,977:89-96.
[20]Shui G,Leong L.Screening and identification of antioxidants in biological samples using high - performance liquid chromatography-mass spectrometry and its application on salacca edulis reinw[J].Journal of Agricultural and Food Chemistry,2005,53:880-886.
[21]Toshiya M,Yuzuru I,Tomomi M,et al.Simple detection method of powder antiradical compounds in the raw extracts of plants and its application for the identification of antiradical constituents[J].Journal of Agricultural and Food Chemistry,2003,51:1831-1838.
[22]Yao Y,Tian C,Cao W.Anti-oxidative constituents of ethanol extract from buckwheat seeds by HPLC-electro-spray-MS[J].Agricultural Sciences in China,2008,7(3):356-362.
[23]符军放.中国蜂胶中酚类化合物的色谱分析方法研究[D].西北大学硕士学位论文,2006.
[24]Choi C W,Kim S C,Hwang S S,et al.Antioxidant activity and free radical scavenging capacity between Korean medicinal plants and flavonoids by assay-guided comparison[J].Plant Science,2002,163:1161-1168.
[25]McGaw L J,Steenkamp V,Eloff J N.Evaluation of athrixia bush tea for cytotoxicity,antioxidant activity,caffeine content and presence of pyrrolizidine alkaloids [J] .Journal of Ethnopharmacology,2007,110(1):16-22.
[26]Torres P,Avila J G,Romo de Vivar A,et al.Antioxidant and insect growth regulatory activities of stilbenes and extracts from Yucca periculosa[J].Phytochemistry,2003,64:463-473.
[27]Silva D H S,Pereira F C,Zanoni M V B,et al.Lipophylic antioxidants from Iryanthera juruensis fruits[J].Phytochemistry,2001,57:437-442.
[28]Dapkevicius A,Van Beek T A,Niederländer H A G,et al.On-line detection of antioxidative activity in high-performance liquid chromatography eluatesby chemiluminescence[J]. Analytical Chemistry,1999,71:736-740.
[29]Dapkevicius A,Van Beek T A,Niederländer H A G. Evaluation and comparison of two improved techniques for the on-line detection of antioxidants in liquid chromatography eluates[J].Journal of Chromatography A,2001,912:73-82.
[30]Koleva I I,Niederländer H A G,Van Beek T A.An on-line HPLC method for detection of radical scavenging compounds in complex mixtures[J].Analytical Chemistry,2000,72:2323-2328.
[31]Koleva I I,Niederlalnder H A G,Van Beek T A.Application of ABTS radical cation for selective on-line detection of radical scavengers in HPLC eluates[J].Analytical Chemistry,2001,73: 3373-3381.
Progress of chromatography screening for phenolic antioxidants from foods
ZHANG Qing-an1,FAN Xue-hui2,ZHANG Zhi-qi3
(1.College of Food Engineering and Nutritional Science,Xi’an 710062,China; 2.College of physical education,Xi’an 710062,China; 3.School of Chemistry and Materials Science,Shaanxi Normal University,Xi’an 710062,China)
The oxidation,anti-oxidation,phenolic antioxidants and its research developmentofLiquid Chromatography screening were reviewed.The view for the research in this field was also taken.
phenol;antioxidantion;chromatography;screening
TS201.1
A
1002-0306(2011)11-0480-04
2010-10-18
张清安(1976-),男,博士,讲师,研究方向:食品功能成分色谱筛选与开发。
国家自然科学基金项目(20875060)。

