海金沙组培苗水溶性多糖和总黄酮综合提取工艺优化
杨 婷,武 芸,2,*,郑小江,2
(1.生物资源保护与利用湖北省重点实验室,湖北民族学院,湖北恩施 445000; 2.湖北民族学院生物科学与技术学院,湖北恩施 445000)
海金沙组培苗水溶性多糖和总黄酮综合提取工艺优化
杨 婷1,武 芸1,2,*,郑小江1,2
(1.生物资源保护与利用湖北省重点实验室,湖北民族学院,湖北恩施 445000; 2.湖北民族学院生物科学与技术学院,湖北恩施 445000)
研究了热水浸提海金沙组培苗水溶性多糖和总黄酮综合提取工艺的优化。在单因素实验的基础上,选定提取温度、提取时间及料液比进行3因素3水平中心组合实验,建立水溶性多糖和总黄酮的总得率二次回归方程,通过响应面分析得到较优的综合提取工艺参数为提取时间2.1h、提取温度80.6℃和料液比1∶26.2(g/mL)。在此优化条件下得到海金沙组培苗中水溶性多糖提取得率为13.241%,总黄酮得率为3.211%,二者总得率为16.452%。
海金沙,水溶性多糖,总黄酮,综合提取,响应面分析
海金沙(Lygodium japonicum)是海金沙科(Lygodiaceae)海金沙属(Lygodium)多年生蕨类植物[1-3],全草和成熟孢子均可入药,有利水通淋、清热解毒之功效,可治疗尿路结石、尿路感染、肾炎水肿、湿热肿满、皮肤湿疹、肠炎痢疾、咽喉肿痛等症状。海金沙多糖是海金沙的有效成分之一,对细菌及真菌都有抑制作用,具有修复造血系统、调节机体免疫、抗肿瘤、抗病毒和抗氧化等作用。海金沙黄酮具有抗肿瘤及抑菌作用,在临床上,海金沙已作为一种中草药应用于防治肿瘤等疾病,将海金沙多糖、黄酮开发为天然药物免疫促进剂和调节剂应用于疾病防治方面具有重要意义[4-6]。目前对黄酮、多糖类化合物的提取、分离和含量测定方法较多[7-9],而有关海金沙水溶性多糖和总黄酮的综合提取研究还未见报道,本研究采用热水浸提法对海金沙组培苗可溶性多糖和总黄酮的综合提取工艺条件进行优化,应用响应面分析法来确定其最佳提取工艺[10-16],具有回归方程精度高、实验周期短、能同时研究几种因素间交互作用等优点。本研究旨在为海金沙综合开发利用提供技术支撑。
1 材料与方法
1.1 材料与设备
海金沙组培苗 生物资源保护与利用湖北省重点实验室(湖北民族学院)组培室提供,将海金沙组培苗先用自来水洗净,再用蒸馏水冲洗2~3次,于55~60℃烘箱中烘至恒重,用粉碎机磨成粉末,过60目筛,装于试剂瓶中,干燥器内贮存备用;无水乙醇、95%乙醇、苯酚、正丁醇、氯仿、标准葡萄糖、浓硫酸、芦丁标准品(含结晶水)、5%NaNO2、1mol/L NaOH、10%Al(NO3)3等 分析纯,均由恩施市红霞化工有限公司提供;水 双蒸水。
SZ-93双重蒸馏水器、植物样品粉碎机、756MC-紫外分光光度计、RE-52型旋转蒸发器 上海亚荣生化仪器厂;HWS12电热恒温水浴锅 上海一恒科技有限公司;DGX型电热鼓风干燥箱 上海福玛实验设备有限公司;S21-3磁力搅拌器 上海司乐仪器厂;pH计(PHS-3C)、冷冻干燥机、低速大容量多管离心机上海安亭科学仪器厂;B-191喷雾干燥仪 瑞士。
1.2 实验方法
1.2.1 海金沙组培苗多糖和黄酮综合提取工艺流程
精确称取海金沙组培苗粉末1.0g→热水浸提水溶性多糖和总黄酮→离心→收集上清液→浓缩为适当体积→加入3倍体积乙醇→低温静置24h→离心→
a.上清液→减压浓缩→冷冻干燥→黄酮→30%微热乙醇溶解→定容至50mL备用。
b.沉淀→再复溶醇沉一次→冷冻干燥→多糖→水溶并定容至50mL备用。
1.2.2 多糖含量测定 苯酚-硫酸法测定多糖含量[17-18]。
1.2.2.1 标准曲线制作 精密称取葡萄糖标准品17mg,置于50mL容量瓶中,加水溶解并稀释至刻度,摇匀,即得葡萄糖标准液。每管加入葡萄糖标准液和双蒸水后立即混匀,待各管都加入苯酚试剂后,迅速摇匀,然后迅速加入浓硫酸5mL置于各试管中摇匀,之后置于40℃水浴中,准确加热15min后,立即取出置于流水中冷却10min。再取出所有试管用1cm口径的比色皿,以第一管为空白,迅速测定其余各管的吸光度。以糖的质量分数为横坐标、吸光度(A490nm)为纵坐标,绘出相关标准曲线并得出线性回归方程∶A=0.7940x-0.0304,R2=0.9990。
1.2.2.2 多糖含量测定 吸取3份5.0mL样液置于3支具塞试管中,加苯酚1.0mL和浓硫酸5.0mL,同上做空白对照,于波长490nm处测定吸光度,按标准曲线回归方程计算出葡萄糖的质量分数(mg/mL)。
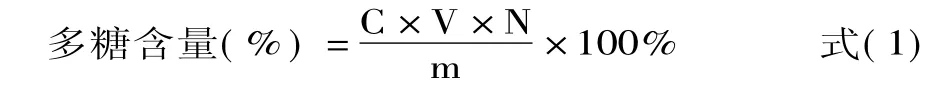
式中,C为测得样品溶液中葡萄糖的质量分数,mg/mL;V为样品溶液的最终稀释体积,mL;N为稀释倍数;m为样品质量,mg。
1.2.3 总黄酮含量测定
1.2.3.1 芦丁标准曲线制作 标准液制备∶准确称取芦丁标准品5.0g(含结晶水),用30%微热乙醇溶解,倒入50mL容量瓶中,用30%乙醇定容得浓度为0.1mg/mL的标准液。
标准曲线制作∶准确吸取标准液0、0.1、0.2、0.3、0.4、0.5mL置于6支具塞试管中,加30%乙醇到5mL,加5%NaNO2溶液0.3mL,摇匀放置6min。再加入10%Al(NO3)3溶液0.3mL,摇匀放置6min后,加1mol/L NaOH溶液4mL,加30%乙醇0.4mL,摇匀后放置10~15min,于510nm处测定吸光度,以芦丁的质量分数为横坐标、吸光度(A510nm)为纵坐标,绘出相关标准曲线并得出线性回归方程∶A=1.1624x+ 0.017,R2=0.9998。
1.2.3.2 总黄酮含量测定 采用亚硝酸钠-硝酸铝-氢氧化钠络合分光光度法测定总黄酮含量。精确吸取3份5mL样液置于3支具塞试管中,各加5% NaNO2溶液 0.3mL,摇匀后放置 6min,加入 10% Al(NO3)3溶液 0.3mL,摇匀后放置 6min,加入1moL/L NaOH溶液4mL,加对应浓度乙醇0.4mL,摇匀后放置10~15min。以试剂空白作对照,于510nm波长处测定吸光度,求出3组平均值,查标准曲线,计算出样液中总黄酮质量分数。
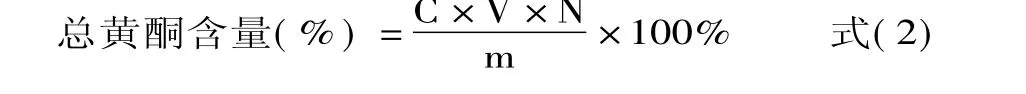
式中,C为测得样品溶液中总黄酮的质量分数,mg/mL;V为样品溶液的最终稀释体积,mL;N为稀释倍数;m为样品质量,mg。
1.2.4 单因素实验 分别以提取温度、提取时间、料液比以及提取次数为单因素进行实验,考察各单因素对浸提液中水溶性多糖和总黄酮得率的影响。
温度的影响∶精确称取1.0g海金沙组培苗粉于锥形瓶中,加入25mL蒸馏水,在不同温度的水浴中提取2h,连续提取2次,按1.2.1方法获得水溶性多糖和总黄酮。所有实验设计3组平行实验,所得实验结果为其平均值(以下同)。
料液比的影响∶精确称取1.0g海金沙组培苗粉15份于锥形瓶中,分成3组,每组分别加入蒸馏水10、20、30、40、50mL,在80℃水浴锅中提取2h,连续提取2次。
提取时间的影响∶称取1.0g的海金沙组培苗干粉于锥形瓶中,加入蒸馏水30mL,在80℃的水浴锅中提取一定时间,连续提取2次。
提取次数的影响∶称取1.0g样粉于锥形瓶中,各按1∶30料液比加入蒸馏水,80℃水浴锅中提取2h,连续提取一定的次数。
1.2.5 中心组合实验 在单因素实验基础上,确定中心组合实验(CCD)的因素与水平,以测量粗多糖和黄酮的总提取量为响应值,通过响应面分析(RSA)对提取条件进行优化。参考单因素实验结果,根据Box-Benhnken中心组合实验设计原理,以浸提温度、料液比和浸提时间为因素设计中心组合实验(见表1)。

表1 中心组合设计的因素与水平表
2 结果与分析
2.1 单因素实验结果分析
2.1.1 温度对海金沙组培苗水溶性多糖和总黄酮提取得率的影响 结果(见图1)显示,海金沙组培苗总黄酮得率随温度升高先上升后下降,70℃达到最大值2.9%,在70~100℃时,随温度升高而下降的原因可能是高温使黄酮的化学结构受到了破坏。其水溶性多糖得率随着温度的升高呈现上升趋势,但在90~100℃时其得率略有下降。
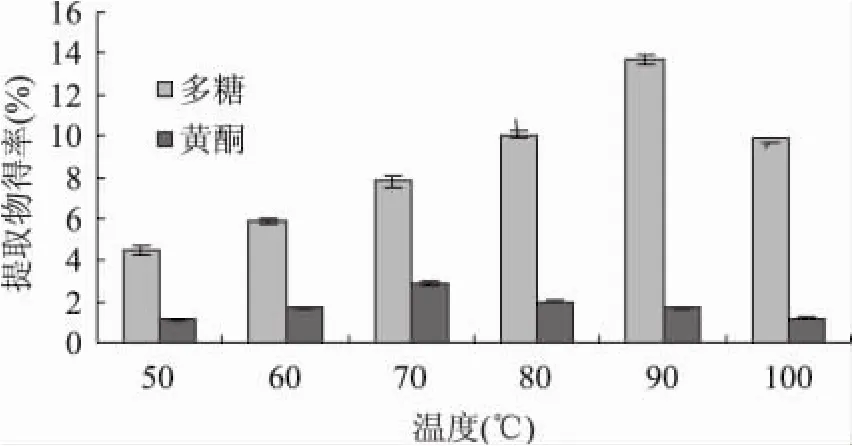
图1 温度对黄酮和多糖得率的影响
2.1.2 料液比对海金沙组培苗水溶性多糖和总黄酮提取得率的影响 结果(见图2)表明,在一定料液比范围内,海金沙黄酮和多糖含量随蒸馏水体积的增加不断升高,到料液比1∶40时达到最大值,而后略为下降。料液比1∶40(g/mL)比较理想。
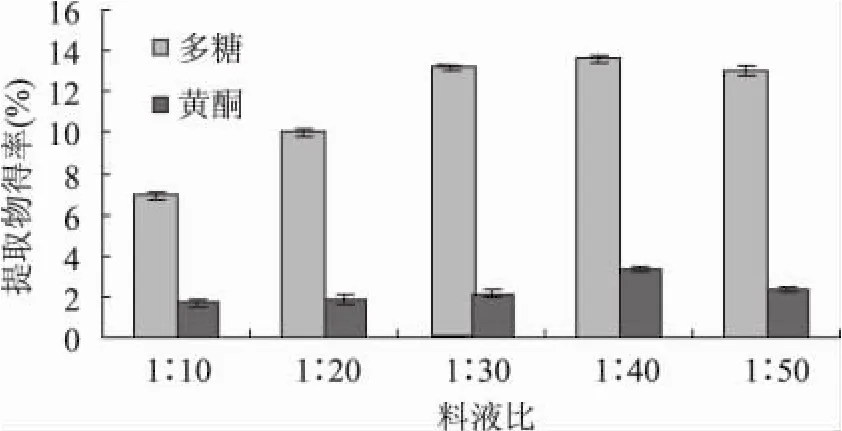
图2 料液比对黄酮和多糖得率的影响
2.1.3 提取时间对多糖和黄酮提取得率的影响 结果见图3。由图3可知,总黄酮的提取量随着时间的延长先上升后略为下降,在提取2h时达到最高。多糖的提取量在一直呈上升趋势,2h后变化不大。综合分析,提取2h比较理想。
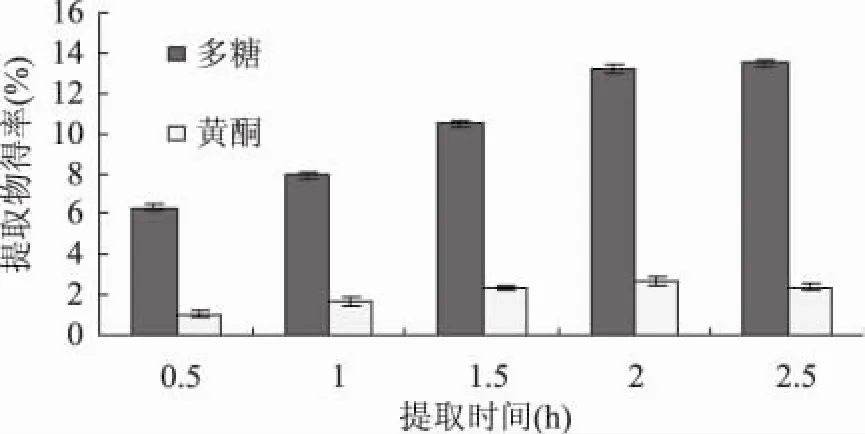
图3 提取时间对多糖和黄酮得率的影响
2.1.4 提取次数对海金沙浸提液中多糖和黄酮提取得率的影响 结果(见图4)表明,随提取次数的增加,总黄酮和多糖得率都呈下降趋势,第1次和第2次已经将绝大部分的总黄酮和多糖提取出来了,第3、4次的提取物得率比较少,几乎可以忽略不计。因此,本实验选择提取2次,提取物得率为两次提取之和。
2.2 中心组合实验结果分析
参考单因素实验结果,根据Box-Benhnken中心组合实验设计原理,以浸提温度、料液比和浸提时间为因素设计中心组合实验(见表1),实验结果见表2。
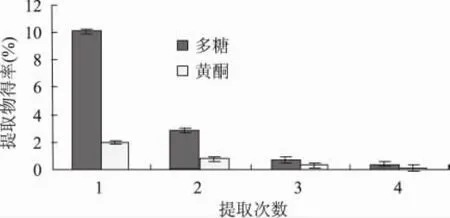
图4 提取次数对多糖和黄酮得率的影响
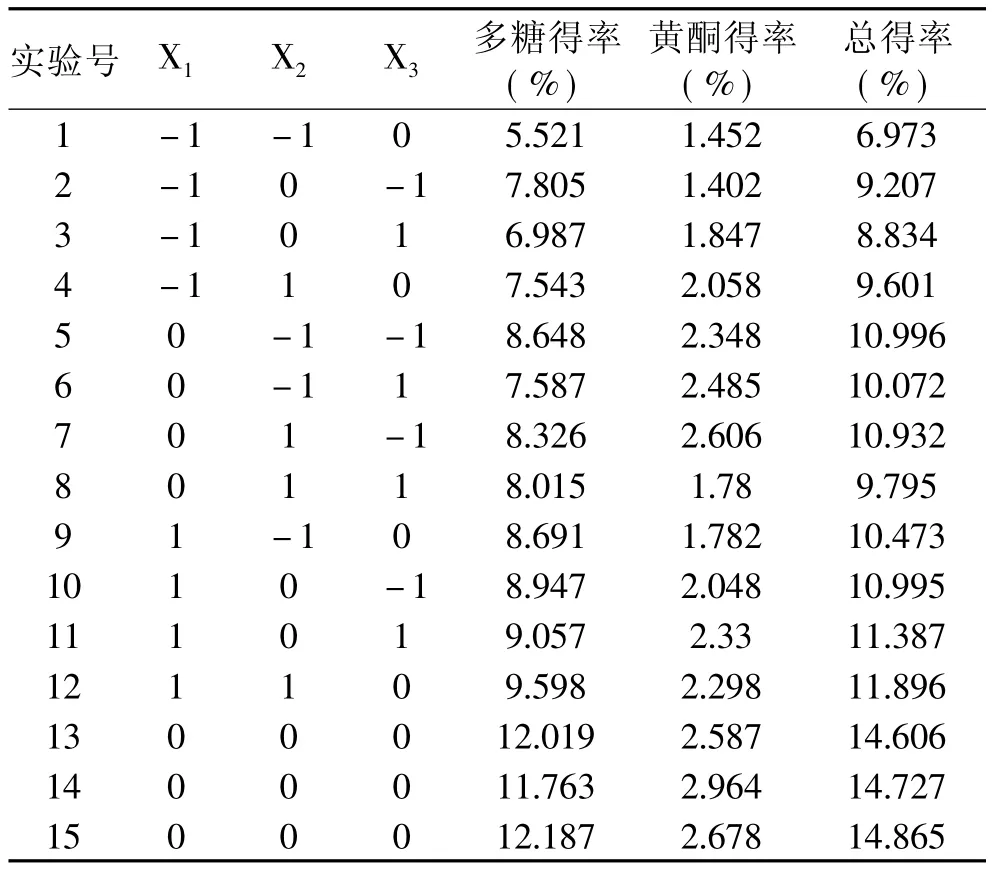
表2 中心组合实验方案与结果
在15个实验中,1~12是析因实验,13~15是中心实验,用来估计实验误差。以海金沙组培苗水溶性多糖和总黄酮的总得率为响应值(Y),所得结果用响应面分析软件(SAS)分析,经二次回归拟合求得响应函数,即回归方程为∶
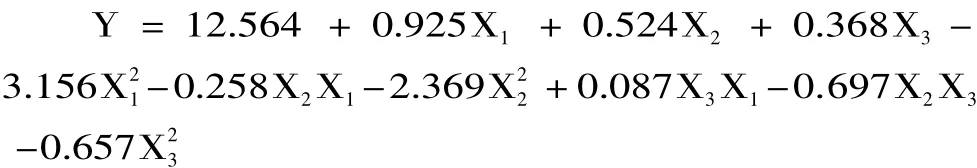
从表3的t检验方差分析表中可以看出,一次项中,浸提温度对海金沙组培苗浸提液中水溶性多糖和总黄酮总得率的影响达到了极显著水平;提取时间对其浸提液中多糖和黄酮总得率的影响达到了显著水平;而料液比的影响不显著。因此,影响浸提液中多糖和黄酮总得率的各因素按影响大小排序依次为提取温度、提取时间、料液比。在交互项中对提取率有显著影响,而其他因素之间的交互作用不显著。
经回归方程方差分析,用上述回归方程描述各因素与响应值之间的关系时,因线性关系显著(R2= 0.9918),模型的显著水平远远小于0.01,此时该回归方差模型是极显著的,因此,该实验方法可靠。而方程失拟误差不显著,这说明各因素值和响应值之间的关系可以用此模型来函数化,可用该回归方程代替实验真实点对实验结果进行分析。回归方程各项的方差分析结果还表明,方程一次项和二次项影响极显著,交互项不显著,因此各实验因子对响应值的影响不是简单的线性关系。
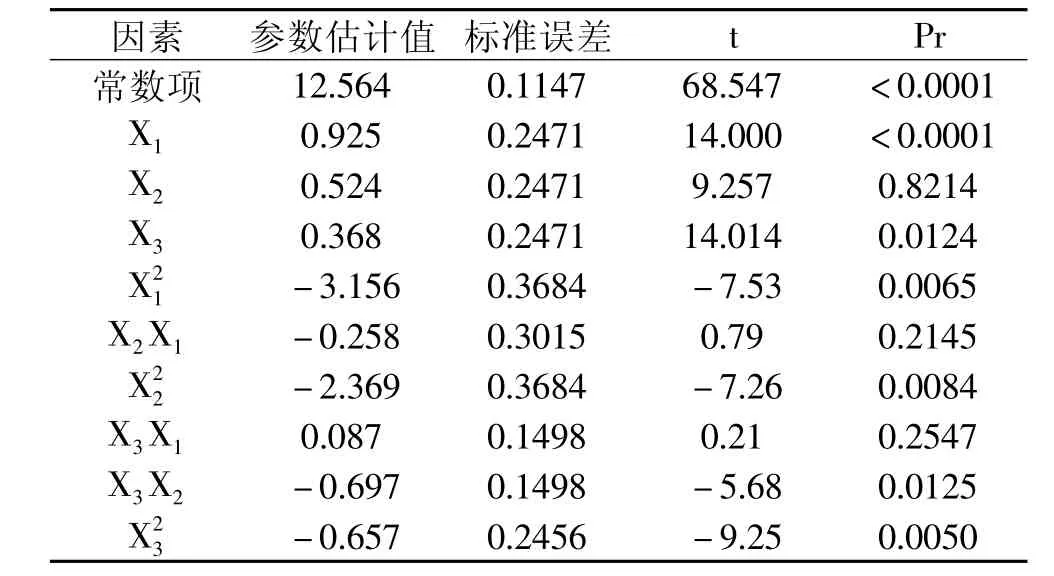
表3 t检验方差分析
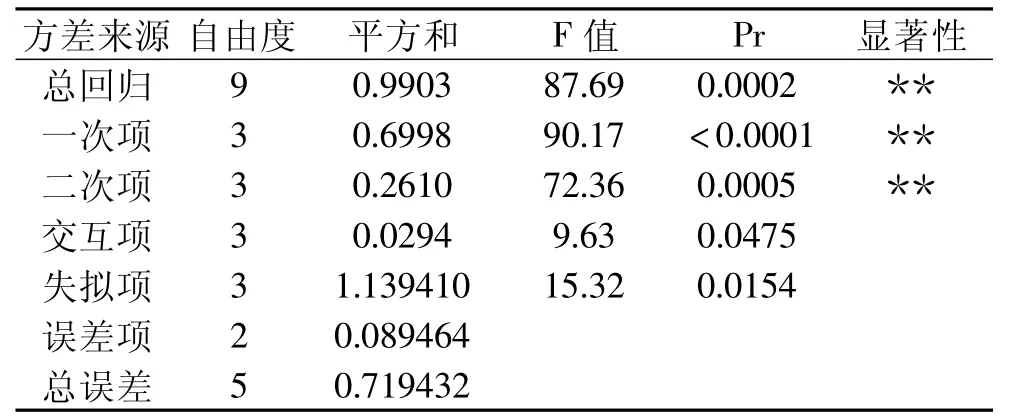
表4 回归方程的方差分析
从典型分析表(表5)中可以看出,3个因素的特征值都是负值,表明此二次响应面存在极值。由SAS分析所得编码值为∶X1=0.1653,X2=0.4824,X3= 0. 2154;由编码值可得最佳工艺参数为∶提取时间2.1h、提取温度80.6℃、料液比1∶26.2(g/mL)。在此优化条件下对实验结果进行验证实验,得到海金沙中多糖提取量为13.241%,黄酮提取量为3.211%,二者总得率为16.452%,与理论预测值15.591% 基本相符,说明响应面分析法对水溶性多糖和总黄酮提取量的优化具有实际应用价值。
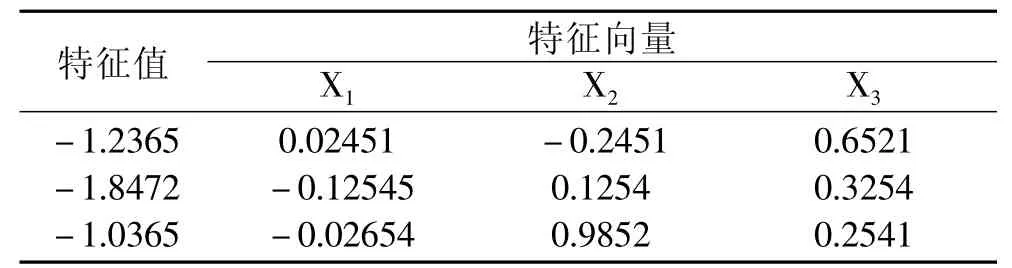
表5 典型分析表
3 结论
本研究以海金沙组培苗为原料,利用热水浸提乙醇沉淀的方法,以水溶性多糖和总黄酮的总得率作为评价指标,用响应面分析法对综合提取水溶性多糖和总黄酮的工艺条件进行优化,最佳综合提取的工艺参数为∶提取时间2.1h、提取温度80.6℃、料液比1∶26.2(g/mL)。在此优化条件下得到海金沙组培苗中水溶性多糖提取得率为13.241%、总黄酮得率为3.211%,二者总得率为16.452%。本研究可为海金沙综合开发利用提供技术支撑。
[1]江苏医学院.中药大词典[M].上海:上海人民出版社,1978:1259.
[2]国家中医药管理局中华本草编委会.中华本草[M].第一卷.上海:上海科技出版社,1999:443.
[3]中国科学院植物研究所.中国高等植物图鉴[M].第一册.北京科学出版社,1985:215.
[4]苏育才.海金沙多糖的分离纯化及抗菌活性[J].福建师范大学学报:自然科学版,2005,21(4):76-79.
[5]张雷红,范春林,叶文才,等,海金沙科植物的化学成分及生物活性研究进展[J].天然产物研究与开发,2007,19(2): 552-557.
[6]丁利,孙俊,周送霞.超声波辅助提取海金沙黄酮及其抑菌效果研究[J].现代食品科技,2009,25(10):1212-1215.
[7]江巍,郑小江.海金沙总黄酮提取工艺研究[J].湖北民族学院学报:自然科学版,2010,28(2):222-225.
[8]肖怀秋,李玉珍.海金沙草总黄酮提取工艺的响应面优化[J].氨基酸和生物资源,2010,34(3):68-72.
[9]武芸,郑小江,卜贵军,等.响应面分析法优化海金沙草多糖的提取工艺[J].食品科学,2010,31(18):108-111.
[10]罗祖友,杨晓,吴谋成.藤茶水溶性多糖及总黄酮的提取工艺研究[J].食品科学,2005,26(5):156-160.
[11]孔娟,刘晓宇,王蕊霞,等.葛根多糖和黄酮综合提取工艺优化[J].食品科学,2010,31(6):43-47.
[12]刘军海,黄宝旭,蒋德超.响应面分析法优化艾叶多糖提取工艺研究[J].食品科学,2009,30(2):114-118.
[13]胡成旭,侯欣彤,冯永宁,等.响应面法优化云芝多糖提取条件的研究[J].食品工业科技,2007,28(7):124-130.
[14]王明艳,张小杰,王涛,等.响应面法优化香椿叶多糖的提取条件[J].食品科学,2010,31(4):106-110.
[15]王振宇,夏祥慧,李宏菊.响应面分析法优化大果沙棘总黄酮提取工艺[J].东北林业大学学报,2009,37(6):30-32.
[16]Dong,JZ,Lu DY,Wang,Y.Simultaneous extraction and analysis of polyphenols from leaves of Lycium barbarum L[J]. Journal of Food Biochemistry,2011,35(3):914-931.
[17]王秀奇,秦淑媛,等.基础生物化学实验[M].第二版.北京:高等教育出版社,1999:103-105.
[18]吴有炜.实验设计与数据处理[M].苏州:苏州大学出版社,2002:
115-154.
Optimization of simultaneous extraction of water-soluble polysaccharides and total flavone from Lygodium japonicum by tissue culture
YANG Ting1,WU Yun1,2,*,ZHENG Xiao-jiang1,2
(1.Key Laboratory of Biologic Resources Protection and Utilization of Hubei Province,Hubei Institute for Nationalities,Enshi 445000,China; 2.Biological Scientific and Technical College of Hubei University for Nationalities,Enshi 445000,China)
The comprehensive extraction technique of water-soluble polysaccharides and total flavone from tissue cultured Lygodium japonicum was studied.Based on single factor experiments,a central composite design(CCD) involving three variables such as extraction temperature,time and solid/liquid ratio at three levels was employed for establishing a quadratic regression model describing total extraction yield of water-soluble polysaccharides and total flavonoids at different levels of the above variables.The optimal technical conditions of extraction by central composite design and response surface analysis(RSA)were as follows:extraction time 2.1h,extraction temperature 80.6℃,solid/liquid ratio of 1∶26.2.Under the optimized conditions,the water-soluble polysaccharide yield was 13.241%,the total flavone yield was 3.211%,and both of the total extraction yield was 16.452%.
Lygodium japonicum;water-soluble polysaccharides;total flavone;simultaneous extraction;response surface analysis(RSA)
TS201.1
B
1002-0306(2011)11-0227-04
2011-08-18 *通讯联系人
杨婷(1991-),女,本科,研究方向:植物生物技术。
生物资源保护与利用湖北省重点实验室开放课题(2011);湖北省科技厅创新团队项目(2009CDA155);2010年恩施州科技指导项目;湖北民族学院生科院大学生创新课题。
——林下少见日,蔓草自碧然

