动态高压微射流技术对β-乳球蛋白微观结构的影响
钟俊桢,刘成梅,刘 伟,蔡小飞,徐雨佳
(南昌大学食品科学与技术国家重点实验室,南昌大学中德食品工程中心,江西南昌 330047)
动态高压微射流技术对β-乳球蛋白微观结构的影响
钟俊桢,刘成梅*,刘 伟,蔡小飞,徐雨佳
(南昌大学食品科学与技术国家重点实验室,南昌大学中德食品工程中心,江西南昌 330047)
采用动态高压微射流技术(DHPM)处理β-乳球蛋白,研究DHPM对β-乳球蛋白微观结构的影响。实验结果表明,未处理的β-乳球蛋白的微观结构表现为球体且分布紧凑。随着DHPM处理压力的逐渐增大,β-乳球蛋白分子被逐渐打散,大部分颗粒逐渐变细。然而仅有小部分β-乳球蛋白分子在经过100MPa和150MPa处理后,发生了部分团聚现象,分别形成不同聚集体的形貌结构。
动态高压微射流技术,β-乳球蛋白,微观结构,原子力显微镜
β-乳球蛋白(β-Lg)是乳清中的主要成分,它被广泛应用于食品中作为一种功能性原料。天然的β-Lg是一种球形蛋白,总共包含162个氨基酸分子,分子量大约为18ku[1]。β-乳球蛋白在经过高压、热处理等物理手段处理后,其构象会发生一定程度的改变,导致一个或多个半胱氨酸残基失活,促使蛋白质与蛋白质间的交互作用发生改变,从而引起其微观结构变化[2]。近几年,高压技术被广泛应用于食品及蛋白质构象变化研究中,它主要包含静高压(HHP)和动态高压[3]。其中,动态高压微射流技术(DHPM)是一种新兴的动态高压技术。动态高压微射流技术是集输送、混合、湿法粉碎、均质等多单元操作于一体的全新技术,能对物料(液-液相或液-固相)进行强烈剪切、高速撞击、压力瞬时释放、高频振荡、膨爆和气穴作用等一系列的综合作用,从而起到超微细化、乳化和均一化效果,进而对其理化性质产生影响[4]。目前,这项技术已应用于一些蛋白质和酶的活性与结构的研究中,Hayes等报道脱脂牛乳经200MPa高压均质后其酪蛋白胶态离子的粒径有一定程度的降低[5];Floury等发现动态高压处理大豆11S球蛋白可导致蛋白质伸展和聚合[6];本课题组也报道了动态高压微射流对乳清蛋白的功能及结构影响[7]和β-乳球蛋白的过敏性影响[8]。本实验着重探讨经动态高压微射流技术处理后的β-乳球蛋白微观结构的变化,以期为改性β-乳球蛋白在乳制品中的应用提供一定的理论参考。
1 材料与方法
1.1 材料与仪器
β-乳球蛋白 购于上海Sigma公司,其纯度为90%以上。
M-7125Microfluidics微射流均质机 美国Microfluidics公司;S-750型扫描电镜 日本日立公司;AJ-V型原子力显微镜 上海卓伦微纳米设备有限公司。
1.2 实验方法
1.2.1 动态高压微射流处理方法 将β-乳球蛋白配成一定浓度的溶液,采用微射流均质机在0、50、100、150、200MPa下对β-乳球蛋白分别处理三次。每个压力水平下获取50mL β-乳球蛋白溶液[9]。
1.2.2 扫描电子显微镜(SEM)形貌分析 将0、50、100、150、200MPa微射流技术处理后的β-乳球蛋白溶液经冷冻干燥后,将样品粘于台上并喷镀电导层,然后在高分辨率扫描电子显微镜下观察β-乳球蛋白的形貌变化[10]。
1.2.3 原子力显微镜(AFM)成像观测 将10μL的样品溶液滴在新解离的云母表面,成像之前在空气中干燥1~2h。AFM成像观测是在超净工作间的室温中进行的,所有的测量都是在空气中进行的。因此,在实验中选用轻敲模式下的原子力显微镜(AJV-AFM),共振频率大约为 80kHz,弹性系数为1.8N/m,扫描速率为0.2~2line/s。采用原子力显微镜自带数据处理软件对图像进行处理[11]。
实验都在超净间实验室进行,实验温度为25℃,空气湿度为40%~50%。
2 结果与分析
2.1 扫描电子显微镜形貌分析
不同压力处理后的β-乳球蛋白的微观形貌图如图1所示。图1(a)显示的是未处理的β-乳球蛋白的电镜扫描图,从此图中可见,未处理的β-乳球蛋白表现为许多小球体紧凑地团聚在一起,并同时伴随着一些纤维状的聚集体。当样品经过DHPM 50MPa压力处理后,如图1(b)所示,β-乳球蛋白的团聚体被打散,结构变得松散。从此图中还可以看出,β-乳球蛋白的微观结构表现为单个球体的特征,球体的大小相较于未处理样品变小。随着处理压力的持续增大达到100MPa时,大部分的β-乳球蛋白分子被打散形成更细小的球体微观结构,但同时小部分的分子在压力作用下发生了团聚现象,表现为块状结构及纤维状聚集体。当DHPM压力增加到150MPa时,如图1(d)所示,大部分的β-乳球蛋白分子进一步被细化形成微小的颗粒状,然而仍有一些分子在动态高压作用下,聚集形成三个球体状的微观结构。当β-乳球蛋白经过200MPa高压处理后,β-乳球蛋白的球体状结构遭到破坏,大部分的分子均被打散,形成更细小的颗粒状。
本课题组在前期利用DHPM处理乳清蛋白研究其功能性质与聚集体的关系中发现,SEM结果图显示未处理的乳清蛋白呈现球状且紧凑的结构。随着DHPM处理压力的持续上升,乳清蛋白的球体结构消失且会形成块状结构,压力越大,块状结构越小[7]。此外,Tunich等研究发现将牛奶等乳制品经过高压处理后,乳制品中大的脂肪球颗粒也会被打散形成细小的颗粒[12]。
2.2 原子力显微镜成像分析
图2呈现了经DHPM不同压力处理后的β-乳球蛋白的AFM成像三维图,反映了不同的处理压力对样品表面成像的影响。从图2中可以看出,未处
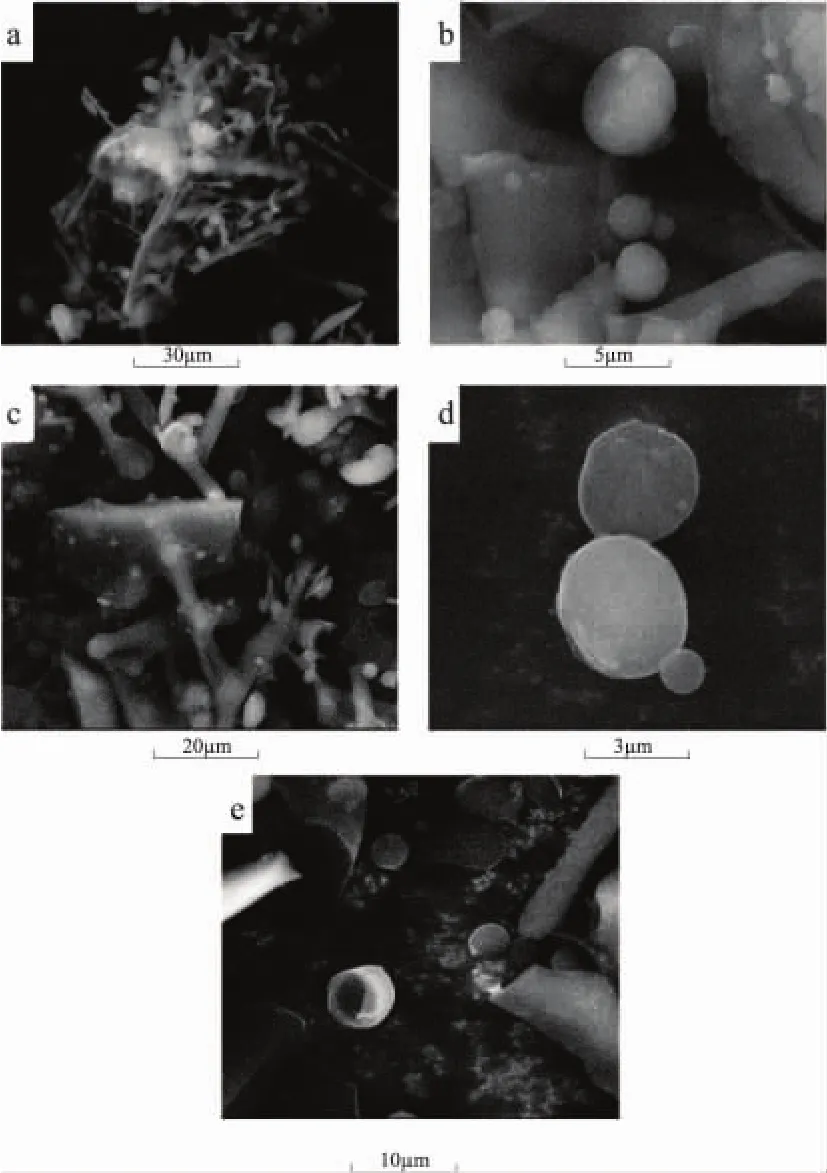
图1 不同压力处理后β-乳球蛋白SEM图

图2 未压力处理的β-乳球蛋白的AFM图

图3 DHPM50MPa处理后β-乳球蛋白的AFM图
然而当动态高压微射流压力上升至100MPa时,其AFM图显示,大部分颗粒大小得到进一步的减小并分布均匀,仅有小部分颗粒发生了聚集现象。此外,大部分颗粒的高度消失,少数颗粒聚集成块状结构且仍有一定的高度,其高度峰型趋于柱体。随着压力的持续增大达到150MPa时,由图5可见,大部分颗粒被细化且均匀的分布在表面,高度图消失。仅有少数分子交联在一起形成两个分子或三个分子、均一等高的柱形体。当DHPM压力达到200MPa后,如图6所示,β-乳球蛋白分子绝大部分被细化,形成细小的颗粒状,均匀的分布在表面上,此外,立体图反映其颗粒被细化的同时,其高度完全消失,β-乳球蛋白分子均匀地分布在云母表面,压力使颗粒变得很细小。

图4 DHPM 100MPa处理后β-乳球蛋白的AFM图
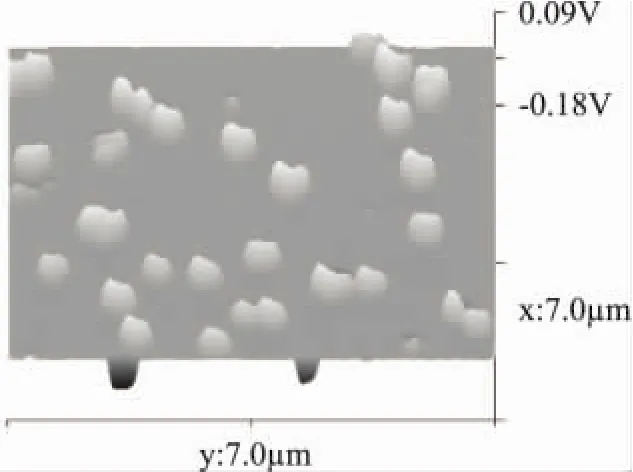
图5 DHPM150MPa处理后β-乳球蛋白的AFM图

图6 DHPM200MPa处理后β-乳球蛋白的AFM图
β-乳球蛋白分子通过非共价键连接两个单体形成稳定的β-折叠二聚体形式存在[13]。天然β-乳球蛋白在高温、低pH及低离子强度情况下容易形成纤维状聚集体[14]。Oboroceanu[15]等人采用 AFM研究β-乳球蛋白从2min至20h的聚集过程中发现,从0~85min,β-乳球蛋白单体解聚并扩大形成一些聚集体。当时间超过85min后,β-乳球蛋白形成纤维状结构,长度增加至10μm。此外,Oboroceanu[16]等研究了高压微射流对乳清蛋白纤维体的结构和长度分布影响,研究发现,50MPa及以上高压微射流压力能破坏β-乳球蛋白纤维体结构但不影响纤维体高度。
3 结论
本文采用动态高压微射流技术处理β-乳球蛋白,利用扫描电子显微镜和原子力显微镜研究了动态高压微射流技术对β-乳球蛋白微观形貌结构的影响。未处理的β-乳球蛋白分子表现为球体状且紧凑地团聚在一起。随着DHPM处理压力的逐渐增大,β-乳球蛋白分子被逐渐打散,大部分颗粒逐渐变细。仅有少量β-乳球蛋白分子在经过100MPa和150MPa处理后,发生了部分团聚现象,分别形成不同的形貌结构。
[1]DE LA HOZ L,NETTO F M.Structural modifications of betalactoglobulin subjected to gamma radiation[J].International Dairy Journal,2008,18(12):1126-1132.
[2]Roesch R,Cox S,Compton S,et al.κ-Carrageenan and βlactoglobulin interactions visualized by atomic force microscopy[J].Food Hydrocolloids,2004,18(3):429-439.
[3]Meersman F,Dobson C M.Probing the pressure-temperature stability of amyloid fibrils provides new insights into their molecular properties[J].Biochimica et Biophysica Acta,2006,1764:452-460.
[4]LIU W,LIU J H,XIE M Y,et al.Characterization and highpressure microfluidization - induced activation of polyphenoloxidase from Chinese pear(Pyrus pyrifolia Nakai)[J]. Journal of Agricultural and Food Chemistry,2009,57(12):5376-5380.
[5]Hayes M G,Kelly A L.High pressure homogenization of raw whole bovine milk:(a)Effects on fat globule size and other properties[J].Journal of Dairy Research,2003,70:297-305.
[6]Floury J,Desrumaux A,Legrand J.Effect of ultra-highpressure homogenization on structure and on rheological properties of soy protein-stabilized emulsions[J].Journal of Food Science,2002,67:3388-3395.
[7]LIU C M,ZHONG J Z,LIU W,et al.Relationship between functional properties and aggregation changes of whey protein induced by high pressure microfluidization[J].Journal of Food Science,2011,76(4):E341-E347.
[8]ZHONG J Z,LIU C M,LIU W,et al.Effect of dynamic high pressure microfluidization atdifferenttemperatures on the antigenic response of bovine β-lactoglobulin[J].European Food Research and Technology,2011.
[9]LIU W,ZHANG Z Q,LIU C M,et al.The effect of dynamic high-pressure microfluidization on the activity,stability and conformation of trypsin[J].Food Chemistry,2010,123(3):616-621.
[10]Dumay E,Laligant A,Zasypkin D,et al.Pressure and heat induced gelation ofmixed β-lactoglobulin/polysaccharide solutions:scanning electron microscopy of gels[J].Food Hydrocolloid,1999,13:339-351.
[11]Giurleo J T,He X L,Talaga D S.β-Lactoglobulin assembles into amyloid through sequential aggregated intermediates[J]. Journal of Molecular Biology,2008,381(5):1332-1348.
[12]Tunick M H,Hekken D L V,Cooke P H,et al.Effect of high pressure microfluidization on microstructure of mozzarella cheese. Lebensm-Wiss u-Technol,2000,33:538-544.
[13]Taheri-kafrani A,Asgari-mobarakeh E,Bordbar A K,et al. Structure-function relationship of beta-lactoglobulin in the presence of dodecyltrimethyl ammonium bromide[J].Colloids and Surfaces B-Biointerfaces,2010,75(1):268-274.
[14]Akkermans C,Venema P,Van der goot A J,et al.Peptides are building blocks of heat-induced fibrillar protein aggregates of beta-lactoglobulin formed at pH 2[J].Biomacromolecules,2008,9:1474-1479.
[15]Oboroceanu D,Wang L Z,Brodkorb A,et al.Characterization ofβ-lactoglobulin fibrillarassembly using atomic force microscopy,polyacrylamide gel electrophoresis,and in situ fourier transform infrared spectroscopy[J].Journal of Agricultural and Food Chemistry,2010,58:3667-3676.
[16]Oboroceanu D,Wang L,Kroes-nijboer A,et al.The effect of high pressure microfluidization on thestructureand length distribution of whey protein fibrils[J].International Dairy Journal,2011(3).
Effects of dynamic high-pressure microfluidization technology on microstructure of β-lactoglobulin
ZHONG Jun-zhen,LIU Cheng-mei*,LIU Wei,CAI Xiao-fei,XU Yu-jia
(State Key Laboratory of Food Science and Technology,Sino-German Food Engineering Center,Nanchang University,Nanchang 330047,China)
β-lactoglobulin(β-Lg)was treated by dynamic high-pressure microfluidization(DHPM).The effect of DHPM on the microstructure of β-lactoglobulin was investigated.The results showed that the microstructure of untreated β-Lg was consisting of globules,which were compact in the texture.With DHPM pressure increasing,the microstructure became looser and the size of β-Lg was much smaller.However,only a little β-Lg molecule,after treated at 100MPa and 150MPa,reaggregated and formed different morphology,respectively.
dynamic high-pressure microfluidization technology;β-lactoglobulin;microstructure;atomic force microscopy
TS201.2
A
1002-0306(2011)11-0072-04
2011-08-25 *通讯联系人
钟俊桢(1984-),女,博士研究生,研究方向:食物(含生物质)资源的开发与利用。
国家自然科学基金项目(31071573);博士点基金项目(20103601110002)。

