GSK-3β抑制剂对结肠癌SW480细胞增殖和凋亡的影响*
刘坤平, 钟雪云, 罗 枫, 赵 彤
(1 南方医科大学南方医院病理科, 广东 广州 510515; 2 暨南大学医学院附属清远医院病理科, 广东 清远 511500;3 暨南大学医学院病理学教研室, 广东 广州 510632)
GSK-3β抑制剂对结肠癌SW480细胞增殖和凋亡的影响*
刘坤平1,2, 钟雪云3, 罗 枫2, 赵 彤1△
(1南方医科大学南方医院病理科, 广东 广州 510515;2暨南大学医学院附属清远医院病理科, 广东 清远 511500;3暨南大学医学院病理学教研室, 广东 广州 510632)
目的探讨糖原合成酶激酶3β(GSK-3β)抑制剂(2’Z,3’E)-6-溴靛’-3’-肟(BIO)对结肠癌SW480细胞β-catenin 、Bcl-2蛋白表达及细胞周期、凋亡的影响。方法应用不同浓度BIO作用于结肠癌SW480细胞,采用流式细胞术检测细胞周期及凋亡,Western blotting检测β-catenin 和Bcl-2蛋白表达,免疫细胞化学检测β-catenin 及cyclin D1的表达,HE染色观察细胞形态。结果与BIO处理前SW480细胞相比,BIO处理组SW480细胞β-catenin蛋白表达明显上调并出现部分细胞核移位,cyclin D1蛋白表达及S期和G2/M期细胞不同程度增多,Bcl-2蛋白表达有所下调,细胞凋亡率明显下降,并出现细胞形态改变。结论GSK-3β抑制剂BIO作用于结肠癌SW480细胞呈现促增殖及抑凋亡作用,其机制主要与β-catenin信号转导通路激活以及与Bcl-2调控通路的平衡有关,其中β-catenin上调可能是影响结肠癌SW480细胞转归的主要因素。
结直肠肿瘤; 糖原合酶激酶3β; β-catenin; Bcl-2; 细胞增殖; 细胞凋亡
糖原合成酶激酶-3β ( glycogen synthase kinase 3β,GSK-3β )是一种多功能的丝氨酸/苏氨酸激酶, 参与细胞内糖代谢、细胞增殖、分化和凋亡等多种重要生理过程。研究表明,GSK-3β是细胞内Wnt/β-链接素(β-catenin)、核因子-κB (nuclear factor-κB,NF-κB)等众多信号转导通路的主要调控酶, 通过对下游核转录因子的影响参与细胞增殖与凋亡的调控,已成为肿瘤治疗所关注的药物靶点,但调节GSK-3β对肿瘤细胞增殖、凋亡影响的实验结果不一,GSK-3β对肿瘤细胞生长起促进还是抑制作用目前仍存有争议[1, 2]。为此,本实验应用GSK-3β抑制剂(2’Z,3’E)-6-溴靛’-3’-肟[(2’Z,3’E)-6-bromoindirubin-3’-oxime,BIO]作用于结肠癌SW480细胞,比较BIO作用前后结肠癌细胞β-catenin、B细胞淋巴瘤/白血病-2(B cell lymphoma/ leukemia-2,Bcl-2)及细胞周期素D1(cyclin D1)蛋白表达变化与细胞周期及凋亡变化的关系,观测GSK-3β抑制剂对SW480细胞增殖、凋亡的影响,探讨调控机制。
材 料 和 方 法
1材料
1.1细胞及主要试剂 人结肠癌细胞株SW480由南方医科大学病理系实验室提供。BIO及二甲基亚砜(dimethyl sulfoxide,DMSO)购自Sigma。细胞培养基RPMI-1640购自Gibco。标准胎牛血清购自天津TBD生物技术发展中心,Western blotting检测所用鼠抗人β-catenin、Bcl-2抗体购自Santa Cruz,兔抗人α-tubulin抗体购自Bioworld。辣根过氧化物酶标记的羊抗鼠及羊抗兔IgG购自Proteintech Group。细胞裂解液及蛋白定量试剂盒购自碧云天生物技术研究所。增强型化学发光(enhanced chemiluminescence,ECL)液购自Pierce。免疫组化试剂盒购自北京中山生物技术公司。碘化乙啶(propidium iodide,PI)周期检测试剂盒及FITC Annexin V凋亡检测试剂盒均购自BD Pharmingen。
1.2主要仪器 CO2培养箱购于Shellab,低温高速离心机购于Eppendorf,超净工作台购于苏州净化设备厂,全波长多功能酶标仪购于Tecan,普通光学显微镜购于Leica,FACS Aria流式细胞仪由BD Bioscience生产。
2方法
2.1流式细胞仪检测细胞周期 对数生长期细胞经0.25%的胰酶消化后,以2×108cells/L的密度接种于6孔板中,2 d后加入由DMSO溶解的不同浓度的BIO(0、1、2、4 μmol/L),继续培养24 h,收集各组细胞,PBS离心重悬2次,70%预冷乙醇4 ℃固定30 min,PBS洗1次,加入含PI的染色液(按说明书操作),避光孵育15 min经尼龙膜滤过后,上流式细胞仪检测。实验重复3次。
2.2流式细胞仪检测细胞凋亡 细胞加入不同浓度BIO(0、1、2、4 μmol/L)培养24 h,经0.25%不含EDTA的胰酶消化,收集各组细胞,PBS离心重悬1次,用Annexin V-FITC/PI双染法上流式细胞仪检测细胞凋亡,具体操作严格按试剂盒说明书进行,凋亡细胞为Annexin V高染(Annexin V+)。实验重复3次。
2.3Western blotting检测β-catenin和Bcl-2蛋白表达 细胞加入不同浓度BIO(0、1、2、4 μmol/L)培养24 h ,按蛋白提取试剂盒操作步骤提取细胞总蛋白并测定蛋白浓度,每泳道加20 μg总蛋白进行SDS-PAGE电泳,湿转将蛋白转移至NC膜,5%脱脂奶粉室温封闭1 h,加鼠抗β-catenin(1∶100)、鼠抗Bcl-2 (1∶200)、内参照兔抗α-tubulin(1∶1 000)抗体,4 ℃摇床孵育过夜,TBS-T洗膜10 min×3次,加入相应辣根过氧化物酶标记羊抗鼠及羊抗兔IgG(1∶4 000)室温摇床孵育1 h,TBS-T洗膜10 min×3次后,ECL化学发光系统显色。扫描胶片,Quantity One软件分析灰度值,计算相对蛋白含量。实验重复3次。
2.4细胞块制备及HE染色、免疫细胞化学染色 细胞加入BIO(4 μmol/L),对照组(0 μmol/L)加入等量DMSO,培养24 h 后收集细胞,离心弃上清,加入0.1%蛋清液混合,离心弃上清加入10%甲醛固定24 h后用滤纸包裹放入脱水盒按常规石蜡包埋制备蜡块,4 μm连续切片,一张做HE染色,其余备做免疫细胞化学。应用免疫细胞化学SP法染色,Ⅰ抗β-catenin及cyclin D1均为鼠单克隆抗体,购于北京中杉金桥生物技术有限公司。用已知大肠癌阳性组织切片作阳性对照,PBS 代替各Ⅰ抗作阴性对照,DAB 显色,苏木素复染。Cyclin D1以细胞核出现棕黄色细颗粒为阳性,200倍镜下随机选择5个视野,至少计数1 000个细胞,计算阳性表达率,细胞阳性表达率(%)=阳性细胞数/总细胞数×100%。
3统计学处理
结 果
1不同浓度BIO对SW480细胞周期的影响
不同浓度BIO(0、1、2、4 μmol/L)作用24 h后,应用流式细胞仪检测细胞周期结果显示,与对照组(BIO 0 μmol/L)细胞比较,BIO处理组G0/G1期细胞不同程度减少,S期和G2/M期细胞不同程度增多,见表1。
表1不同浓度BIO对SW480细胞周期分布的影响

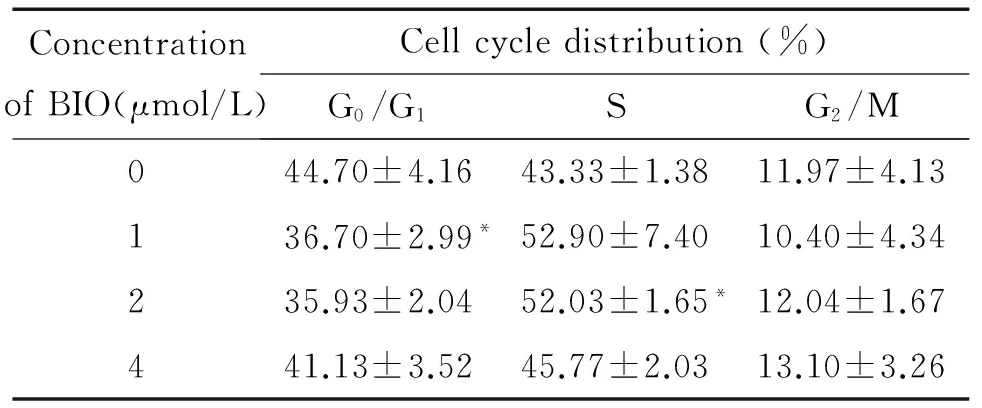
ConcentrationofBIO(μmol/L)Cellcycledistribution(%)G0/G1SG2/M044.70±4.1643.33±1.3811.97±4.13136.70±2.99*52.90±7.4010.40±4.34235.93±2.0452.03±1.65*12.04±1.67441.13±3.5245.77±2.0313.10±3.26
*P<0.05vs0 μmol/L.
2不同浓度BIO对SW480细胞凋亡的影响
Annexin V-FITC/PI双染法流式细胞仪检测SW480细胞凋亡结果显示,随着BIO浓度增加(0、1、2、4 μmol/L),SW480细胞凋亡率(Annexin V+)逐渐降低,见图1,各组细胞凋亡率分别为(4.40±0.36)%、(2.67±0.47)%、(2.07±1.00)%、(1.47±0.49)%。
3不同浓度BIO对SW480细胞β-catenin、Bcl-2蛋白表达的影响
Western blotting结果显示不同浓度BIO处理SW480细胞后,细胞中β-catenin蛋白表达量逐渐增加,Bcl-2蛋白表达有所下调,见图2。
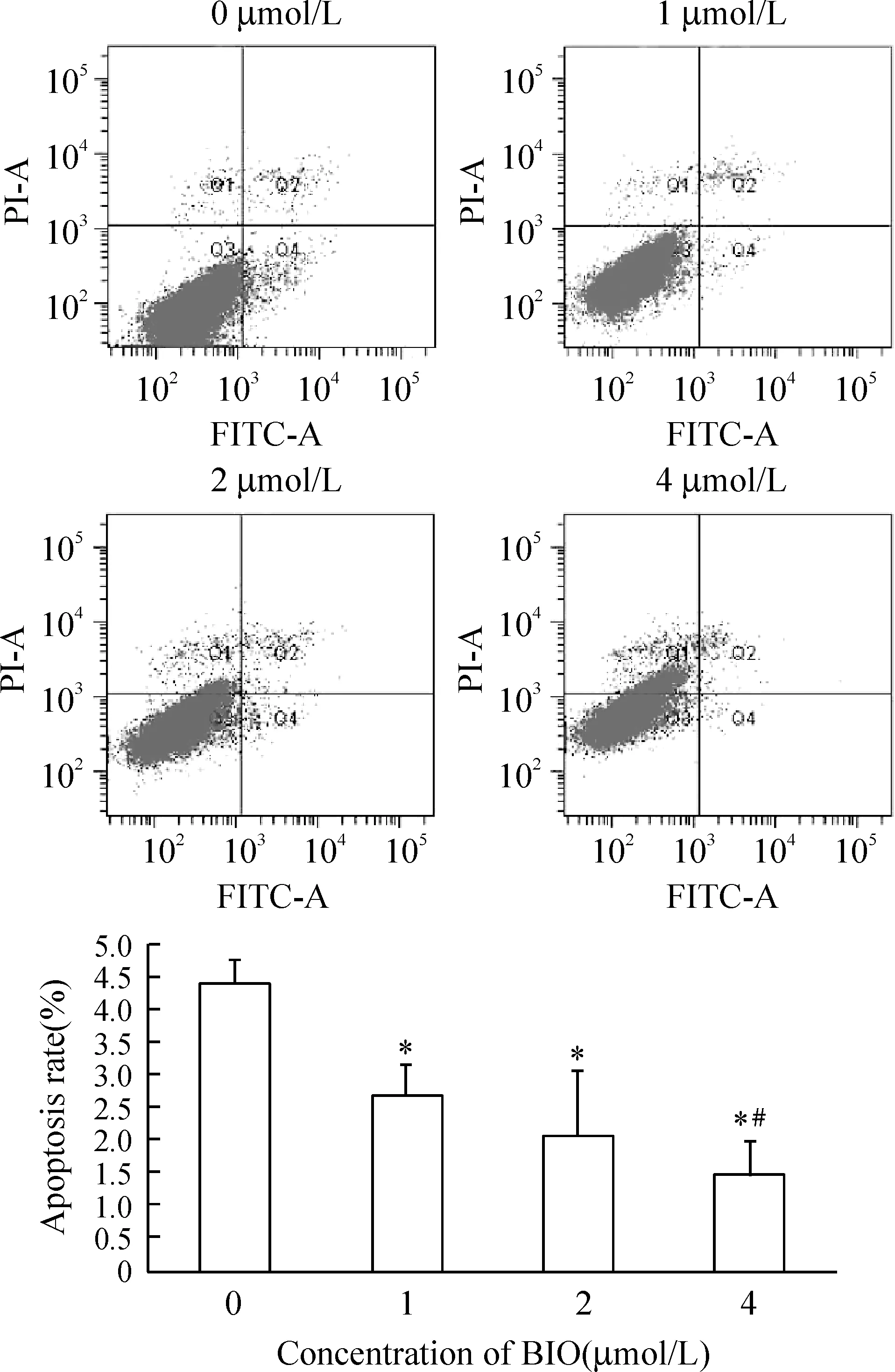

图1流式细胞术分析不同浓度BIO对SW480细胞凋亡的影响

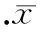
图2Westernblotting检测不同浓度BIO作用SW480细胞β-catenin、Bcl-2蛋白表达
4BIO对SW480细胞形态、β-catenin核移位及cyclinD1表达的影响
HE染色结果显示,相比BIO处理前(图3A1),BIO处理组(图3B1)细胞大小形态不一、瘤巨细胞数量增多、细胞核染色质增粗、核仁明显、核分裂数增多。免疫细胞化学结果显示,BIO处理前(图3A2)β-catenin蛋白表达主要定位于细胞膜、细胞质,BIO处理组(图3B2)β-catenin蛋白在细胞膜、细胞质表达明显增强并可见部分细胞核强表达;cyclin D1蛋白表达定位于细胞核,BIO处理组(图3B3)阳性表达率(7.15%)较对照组(图3A3) (6.86%)高,但未见显著差异(P>0.05)。
Figure 3. The morphological features (HE staining,×400) and β-catenin and cyclin D1 expression (immunohistochemical staining,×400)in SW480 cells before and after exposure to BIO.A1-A3: the morphological features and β-catenin and cyclin D1 expression in SW480 cells 24 h after DMSO exposure; B1-B3: the morphological features and β-catenin and cyclin D1 expression in SW480 cells 24 h after BIO(4 μmol/L, diluent DMSO)exposure.
图3BIO作用前后SW480细胞形态及β-catenin、cyclinD1蛋白表达
讨 论
结直肠癌是我国常见恶性肿瘤并呈上升趋势[3],但治疗效果并未因多年的努力而得到明显改善,寻找新的肿瘤治疗靶点已是近年关注的热点。GSK-3β作为细胞内众多信号转导通路的主要调控酶,已在不同的肿瘤细胞株如结肠癌、肺癌、乳腺癌中发现调节GSK-3β活性可影响肿瘤细胞的生长及凋亡[4-7],但抑制GSK-3β活性对肿瘤细胞生长影响的实验结果不一,Gould等[4]在实验性鼠肠肿瘤及Farago等[5]在乳腺上皮抑制GSK-3β的活性不同程度呈现促肿瘤生长作用,Li等[6]在人肺腺癌细胞通过抑制GSK-3β活性细胞凋亡受抑制,S期细胞数量增多,而Shakoori等[7]则观察到通过化学抑制剂及RNA干扰抑制结肠癌细胞GSK-3β活性,减弱了癌细胞的生长、诱导了细胞凋亡,出现了不同的实验结果,提示抑制GSK-3β活性对肿瘤细胞增殖、凋亡的影响及其机制尚不明确。 本实验显示不同浓度的GSK-3β抑制剂BIO作用于结肠癌SW480细胞后,细胞凋亡率随着BIO浓度增加由4.40%减少到1.47%,S、M期细胞数量和cyclin D1表达不同程度增多并出现细胞核染色质增粗、核仁明显、核分裂数增多等高增殖状态的细胞形态学变化,提示本细胞模型下抑制GSK-3β活性对肿瘤生长起促进作用。
GSK-3β抑制剂BIO是一种小分子ATP竞争性抑制剂,通过与ATP竞争以及影响GSK-3β调节因子磷酸化进一步抑制GSK-3β的活性[1, 8]。目前的研究显示GSK-3β抑制剂对肿瘤细胞产生不同的影响,其原因可能与GSK-3β下游信号转导通路在不同细胞株作用机制不同有关, 已有文献报道不同癌细胞NF-κB与β-catenin/TCF信号转导通路作用机制不同[9],推测GSK-3β作为信号转导通路主要调控酶在不同的细胞可能产生不同的影响。
β-catenin信号转导通路在肿瘤的发生发展过程中起着至关重要的作用[10-12],高表达β-catenin可通过TCF4等下游核转录因子促进细胞增殖与凋亡抑制。GSK-3β作为细胞内Wnt/β-catenin信号转导通路重要调控酶,滕颖等[13]在体外实验用不同浓度的GSK-3β抑制剂LiCl作用肺癌细胞导致β-catenin表达增加并出现核移位,同时增殖能力与克隆形成能力增强 ,本实验应用不同浓度的GSK-3β抑制剂BIO明显上调了SW480细胞β-catenin蛋白含量并出现部分细胞β-catenin核移位,与滕颖等应用LiCl对β-catenin的影响结果一致,提示不同种类的GSK-3β抑制剂均可上调β-catenin并影响细胞的增殖及凋亡。Cyclin D1 是Wnt/β-catenin通路重要靶基因之一[10],其启动区被β-catenin/TCF激活并转录,本实验GSK-3β抑制剂BIO作用后cyclin D1阳性表达仅轻度增高,与β-catenin上调幅度不同步,此现象提示cyclin D1表达不仅受Wnt/β-catenin通路的调控,而且还受GSK-3β调控的其它下游通路的影响,Ougolkov等[14]在实验中观察到GSK-3β抑制剂降低胰腺癌细胞cyclin D1蛋白表达与NF-κB活性改变有关。
Bcl-2是NF-κB下游因子,作为凋亡抑制因子在细胞凋亡调控机制中起重要作用,实验表明GSK-3β作为细胞内信号转导通路重要调控酶影响Bcl-2的表达,Ougolkov等[14,15]及Bilim等[16]分别在胰腺癌、慢性淋巴细胞白血病及肾癌细胞发现小分子GSK-3β抑制剂或RNA干扰抑制GSK-3β活性对肿瘤细胞有抑增殖或促凋亡作用,其机制可能与Bcl-2 表达下调有关。Thotala等[17]在GSK-3β抑制剂对正常肠黏膜防辐射作用的实验中检测到GSK-3β抑制剂导致肠黏膜组织Bcl-2表达上调及凋亡受抑,本实验发现随GSK-3β抑制剂剂量增大,结肠癌SW480细胞Bcl-2的含量呈下降趋势,提示GSK-3β抑制剂对肠癌细胞、正常肠黏膜细胞Bcl-2表达的影响不同。本实验GSK-3β抑制剂BIO作用于结肠癌SW480细胞虽然出现凋亡抑制因子Bcl-2表达下调,但仍然呈现凋亡抑制的现象,提示此细胞模型下Bcl-2对凋亡的调控未占主导作用,其凋亡受抑有更有效的途径调控。
本实验结果显示β-catenin与Bcl-2参与了GSK-3β抑制剂BIO对结肠癌SW480细胞的促肿瘤生长作用,其机制与β-catenin信号转导通路激活以及与Bcl-2调控通路的平衡有关,其中β-catenin上调起到关键作用,提示GSK-3β抑制剂对肿瘤细胞生长的影响取决于促进和抑制通路的激活、平衡与自我稳定,在不同的细胞可能出现不同的转归。此外,GSK-3β抑制剂BIO明显上调结肠癌SW480细胞β-catenin表达、降低凋亡水平的现象,提示在众多结直肠癌实体肿瘤组织出现的β-catenin高表达状态[10,18]可能与肿瘤细胞凋亡抑制密切相关,并且可能是结直肠癌肿瘤组织多药耐药的原因之一。
[1] Forde JE, Dale TC. Glycogen synthase kinase 3: a key regulator of cellular fate [J]. Cell Mol Life Sci, 2007, 64(15):1930-1944.
[2] Luo J. Glycogen synthase kinase 3β(GSK3β) in tumorigenesis and cancer chemotherapy [J]. Cancer Lett, 2009, 273(2):194-200.
[3] 万德森. 结直肠癌流行趋势及其对策 [J]. 癌症,2009,28(9):897-902.
[4] Gould TD, Gray NA, Manji HK. Effects of a glycogen synthase kinase-3 inhibitor, lithium, in adenomatous polyposis coli mutant mice [J]. Pharmacol Res,2003,48(1):49-53.
[5] Farago M, Dominguez I, Landesman-Bollag E, et al. Kinase-inactive glycogen synthase kinase 3β promotes Wnt signaling and mammary tumorigenesis [J]. Cancer Res, 2005, 65(13):5792-5801.
[6] Li J, Xing M, Zhu M, et al. Glycogen synthase kinase 3β induces apoptosis in cancer cells through increase of survivin nuclear localization [J]. Cancer Lett, 2008, 272(1):91-101.
[7] Shakoori A, Ougolkov A, Yu ZW, et al. Deregulated GSK3β activity in colorectal cancer: its association with tumor cell survival and proliferation [J]. Biochem Biophys Res Commun, 2005, 334(4):1365-1373.
[8] 张 娜,蒋勇军,俞庆森,等. GSK-3抑制剂研究进展 [J]. 化学进展,2007,19(4):614-623.
[9] Cho HH, Song JS, Yu JM, et al. Differential effect of NF-кB activity on β-catenin/Tcf pathway in various cancer cells [J]. FEBS Lett, 2008, 582(5):616-622.
[10]Wong NA, Pignatelli M. β-catenin-a linchpin in colorectal carcinogenesis? [J]. Am J Pathol, 2002, 160(2):389-401.
[11]高 明,龚 瑾,吕永添,等.β-连环素在结肠腺癌中的异常表达及其与预后的关系[J]. 中国病理生理杂志,2010,26(5):928-930.
[12]邹外一,许多荣,苏 畅,等.慢性髓性白血病患者β-catenin的表达及其临床意义[J]. 中国病理生理杂志,2010,26(4): 709-712.
[13]滕 颖,王秀问,王亚伟,等. Wnt/β-catenin信号传导途径在肺癌细胞A549中的作用 [J]. 山东大学学报(医学版),2010,48(1):74-77.
[14]Ougolkov AV, Fernandez-Zapico ME, Savoy DN, et al. Glycogen synthase kinase-3β participates in nuclear factor кB-mediated gene transcription and cell survival in pancreatic cancer cells [J]. Cancer Res, 2005, 65(6):2076-2081.
[15]Ougolkov AV, Bone ND, Fernandez-Zapico ME, et al. Inhibition of glycogen synthase kinase-3 activity leads to epigenetic silencing of nuclear factor кB target genes and induction of apoptosis in chronic lymphocytic leukemia B-cells [J]. Blood, 2007, 110(2):735-742.
[16]Bilim V, Ougolkov A, Yuuki K, et al. Glycogen synthase kinase-3: a new therapeutic target in renal cell carcinoma [J]. Br J Cancer, 2009, 101(12): 2005-2014.
[17]Thotala DK, Geng L, Dickey AK, et al. A new class of molecular targeted radioprotectors: GSK-3β inhibitors [J]. Int J Radiat Oncol Biol Phys, 2010, 76(2):557-565.
[18]Herbst A, Kolligs FT. Wnt signaling as a therapeutic target for cancer [J]. Methods Mol Biol, 2007, 361:63-91.
EffectsofGSK-3βinhibitoronproliferationandapoptosisofSW480cells
LIU Kun-ping1,2, ZHONG Xue-yun3, LUO Feng2, ZHAO Tong1
(1DepartmentofPathology,NanfangHospital,SouthernMedicalUniversity,Guangzhou510515,China;2DepartmentofPathology,QingyuanHospital,SchoolofMedicine,JinanUniversity,Qingyuan511500,China;3DepartmentofPathology,SchoolofMedicine,JinanUniversity,Guangzhou510632,China.E-mail:tongzhao@fimmu.com)
AIM: To investigate the mechanism and the effect of glycogen synthase kinase 3β (GSK-3β) inhibitor (2’Z,3’E)-6-bromoindirubin-3’-oxime (BIO) on the protein expression of β-catenin and Bcl-2, and proliferation and apoptosis in colon carcinoma SW480 cells.METHODSThe immunohistochemical staining and Western blotting were performed to detect the protein expression of β-catenin, cyclin D1 and Bcl-2. The cell cycle distribution and apoptotic rate were detected by flow cytometry. The morphologic features of SW480 cells before and 24 h after BIO exposure at different concentrations were observed under microscope with HE staining.RESULTSCompared with the untreated SW480 cells, the protein expression of β-catenin significantly increased and some β-catenin positive nuclear staining positive cells appeared in BIO treated cells. and The cells exposed to BIO showed that the cyclin D1 protein and the cells in S stage and G2/M stage moderately increased, the protein level of Bcl-2 moderately decreased, and the cell apoptosis rate was significantly lower than those in control cells. Furthermore, the morphological changes of the SW480 cells were observed 24 h after BIO treatment.CONCLUSIONOur results indicate that GSK-3β inhibitor BIO participates in the cellular processes of promoting proliferation and inhibiting apoptosis in colon carcinoma cells. The mechanisms are mainly associated with activating the β-catenin pathway and regulating the balance of Bcl-2 pathway, and the up-regulation of β-catenin is most likely the possible factor for SW480 cell regression.
Colorectal neoplasms; Glycogen synthase kimase 3β; β-catenin; Bcl-2; Cell proliferation; Apoptosis
R735.3
A
10.3969/j.issn.1000-4718.2011.01.019
1000-4718(2011)01-0097-05
2010-06-10
2010-11-10
广东省科技计划资助项目(No.2009B080800023)
△通讯作者 Tel: 020-61648228; E-mail: tongzhao@fimmu.com

