脂肪酶和青霉素酰化酶催化合成手性化合物的研究进展
薛 屏,曹雪荣
(宁夏大学能源化重点实验室,宁夏 银川 750021)
进展与述评
脂肪酶和青霉素酰化酶催化合成手性化合物的研究进展
薛 屏,曹雪荣
(宁夏大学能源化重点实验室,宁夏 银川 750021)
生物酶催化合成手性药物和中间体具有高效、节能和环境友好等突出的优势,本文从提高催化反应效率的角度,评述了非水相酶催化反应的溶剂效应——溶剂体系对酶的活性和对映选择性的调控作用;介绍了动力学控制合成β-内酰胺类抗生素的不同溶剂体系,包括有机物-水共溶剂体系、有机物-水不共溶剂体系、反胶束体系和双水相体系。提出利用溶剂效应调控动力学合成体系,会有效提高酶催化合成 β-内酰胺类抗生素的产率和合成与水解比S/H值,从而实现底物的有效利用。
溶剂效应;脂肪酶;青霉素G酰化酶;手性化合物;对映选择性
随着对不同光学异构体药物药理作用研究的进展及对消旋药物申报和使用的种种限制,手性药物的研究和开发已经成为国际新药研究的方向。目前世界上正在开发的1200种药中,有820种属于手性药物,即2/3是手性的,预计2010年单一对映体的市场将达到2500亿美元,由此而来的手性化合物合成方法就成了手性药物能不能商品化生产的关键[1-2]。发展新型、高对映选择性、高效的手性化合物合成方法成了许多科学家和企业家关注的焦点,其中生物酶催化由于温和的反应条件及高度的选择性而备受重视。
长期以来,普遍认为生物酶只能在水溶液中使用,而有机溶剂则是酶的变性剂,使得酶在有机介质中催化作用的研究进展十分缓慢。直到Klibanov等[3]发现酶在有机相中具有极高的热稳定性和催化活性之后,酶用于有机介质中手性化合物的拆分与合成的研究渐成热点。已报道的适于有机介质中的酶类有脂肪酶、酯酶、青霉素酰化酶、蛋白酶、过氧化物酶、醛缩酶多酚氧化酶、醇脱氢酶等,涉及手性化合物的拆分与合成反应有水解、酯化、环氧化、脱氢、开环等反应。目前大量的研究结果表明,酶催化合成手性药物及中间体的产率和光学纯度与反应溶剂的选择密切相关[4-5]。溶剂对酶催化的活性和对映选择性均有相当的影响,显现出突出的溶剂效应。本文重点介绍了脂肪酶和青霉素酰化酶合成手性药物和中间体催化反应的溶剂体系,对利用溶剂效应调控酶催化反应的选择性的发展进行了评述。
1 有机溶剂对脂肪酶催化性能的影响
1.1 有机溶剂对脂肪酶活性的影响
酶在生命体内能够催化许多化学反应,酶催化反应在水溶液中进行,被认为部分水分子与酶紧紧结合形成了水化层,水分子直接或间接地通过氢键、疏水键、静电作用、范德华力等维持着酶分子的催化活性构象,这一部分水称为“必需水”[6]。Klibanov等[7]考察了3种氧化还原酶,发现水含量在1000个水分子/酶分子,即在酶表面上有一个水单层时,酶的活性达到了最高。催化反应在非水溶剂中进行,大致可归结为几方面的优势:一是增大了疏水性底物的溶解性;二是促进水中不利的反应和抑制水诱发的副产物;三是有利于产物和不溶性生物催化剂的回收再使用。然而,在多数情况下酶在有机介质中的活性比水中的低。大量的研究结果表明,酶在有机溶剂中的活性主要取决于水活度、底物与产物的溶剂化作用和溶剂的性质。
酶在有机溶剂中的催化活性与有机溶剂的亲水性呈负相关性,酶通常在疏水性溶剂中比在亲水溶剂中具有更高的活性。Laane等[8]用溶剂的极性参数lgP(P为某溶剂在正辛醇和水双相体系中的分配系数)描述了溶剂的极性与酶活性的关系,并通过实验得出规律:酶在 lgP<2的极性溶剂中活性较低;在 2<lgP<4的溶剂中具有中等活性;在lgP>4的非极性溶剂中具有较高的活性。Hernandez等[9]的实验结果展现了在非极性溶剂正庚烷、正己烷和甲苯中,脂肪酶的活性是水相中活性的70%,但在极性溶剂异丙醇和乙醇中,相对于水相中的活性均低于40%。Frings等[10]利用脂肪酶在极性有机溶剂中拆分(R,S)-1-苯乙醇,酶几乎无活性,溶剂极性降低,酶的活性增加。朱洁等[11]利用脂肪酶催化不对称酰化反应拆分外消旋(R,S)-2-辛醇,考察了15种溶剂对脂肪酶活性的影响。研究结果表明,在强亲水性溶剂二甲基甲酰胺和甲醇(lgP<1)中,酶几乎不表现出催化活性;在中等极性甲苯和苯(2< lgP<3)中,酶具有中等活性,而在强疏水性溶剂正己烷和正庚烷(lgP>3)中,酶表现出较高的活性。但刘军民等[12]用固定化脂肪酶催化酮基布洛芬与丙醇酯化反应,发现在异辛烷(lgP= 4.7)中反应,固定化脂肪酶的活性却比在环己烷(lgP=3.2)中的小,与Laane提出的规律不相一致,这可能是由于底物在异辛烷中的溶解度较小所致。
亲水性溶剂趋向于夺取酶维持活性构象的“必需水”,导致酶的活性下降。在有机溶剂中失去“必需水”的酶,其构象或形态是否发生了变化? Yennawar等[13]由X射线晶体衍射测定了胰凝乳蛋白酶在正己烷中的交联酶晶体结构,酶的三维结构与水相中比较没有明显的差异。尽管证实了酶在纯有机溶剂中结构不变,但是,由于酶分子表面含有大量带电基团和极性基团,在完全无水的情况下,这些带电基团相互作用,使酶分子出于无活性的“锁定”状态,也很难发挥出高的催化作用。
关于酶的活性与存在于反应介质中水相关联,目前更精确的方法是用热力学水活度(αw)来表示介质中的水。水活度通过式子αw=Χw·γw与水的摩尔分数(Χw)和水活度系数(γw)相关联。在一级近似范围,水活度系数作为溶剂疏水性的函数而增高,其结果是,较低水浓度时,在疏水介质中比亲水介质中更能提到一定值的αw,这样,同一种酶在疏水溶剂中比在亲水溶剂中所需要的水要少,而最适系统含水量随着溶剂lgP的增大而减小。在脂肪酶催化丁酸与丁醇的酯合成反应中,在不同溶剂中反应速度的最高值不同,而达到最大值时溶剂中的含量也不相同,但达到最大值时最适水活度却基本相同,均在0.5~0.6之间(图1)[14],反映出最适水活度不受溶剂的影响。

图1 不同溶剂中水活度对催化酯合成活力的影响
有机溶剂替代结合水直接作用于酶的微环境水化层,剥去了酶“必需水”层从而影响酶的催化活性之外 ,溶剂对酶活性影响的另一种方式是溶剂通过对底物或产物扩散产生影响而制约酶的活性。溶剂疏水性的强弱直接影响底物和产物在溶剂相和酶环境中的分配,疏水性强的溶剂虽然有利于维持酶的微环境,但其与疏水性的底物之间的作用力不利于底物从溶剂相扩散到酶微环境中,同样会导致酶活力的下降。这样,采用单一组分的溶剂催化反应很难达到理想的效果,因此需要构筑新的反应体系。许建和等[15]在固定化脂肪酶催化酮洛芬的酯化反应中使用了由异辛烷作主溶剂,甲苯为助溶剂的混合溶剂体系。崔玉敏等[16]在固定化酶催化奈普生的酯化反应中采用了异辛烷作主溶剂,四氯化碳为助溶剂的混合溶剂体系,都取得了比较好的实验结果。在混合溶剂系统中,所选溶剂的极性、配比要适当,原则上应兼顾酶的活性和底物的溶解性两个方面,底物在混合溶剂中要有一定的溶解度而酶要有较高的活性。此外,在多数情况下,酶不溶于有机溶剂,酶在溶剂中分散性低,酶-酶堆积对酶-底物间相互作用会产生阻碍,不利于底物接近每一个酶分子,结果导致酶的催化效率低。
1.2 有机溶剂对脂肪酶选择性的影响
酶高度的对映选择性和立体选择性,应用于手性药物和中间体的催化合成,可谓酶催化工艺最为突出的优势。在水溶液中进行酶催化反应,水的理化性质稳定,所提供的催化环境与酶在生物体内的接近,酶的对映选择性几乎固定不变。然而,由于许多有机底物的水溶性有限,需要在有机物-水共溶剂或有机溶剂中进行反应。但是,酶催化反应选择性能够被所用的有机溶剂(甚至在有机物-水共溶剂)的性质所影响,有时甚至影响非常显著。溶剂体系的不同,酶催化反应呈现出不同的对映选择性。作者以乙酸乙烯酯作酰化试剂[17],利用固定化假单胞菌脂肪酶(PSL/HOOC-MCF)在甲苯溶剂中拆分外消旋(R,S)-1-苯乙醇(表1),40 ℃下反应48 h,底物(R,S)-1-苯乙醇的转化率为50%,达到拆分反应的最大理论转化率,单一对映体(S)-1-苯乙醇对映体过量值(eeS)和(R)-乙酸苯乙酯对映体过量值(eeP)分别达到99%;当反应溶剂为正已烷时,eeP值下降为 96%,而 eeS值仍然保持为99%,说明在正已烷溶剂中除了(R)-1-苯乙醇发生反应外,少量的(S)-1-苯乙醇也发生了反应生成(S)-乙酸苯乙酯。
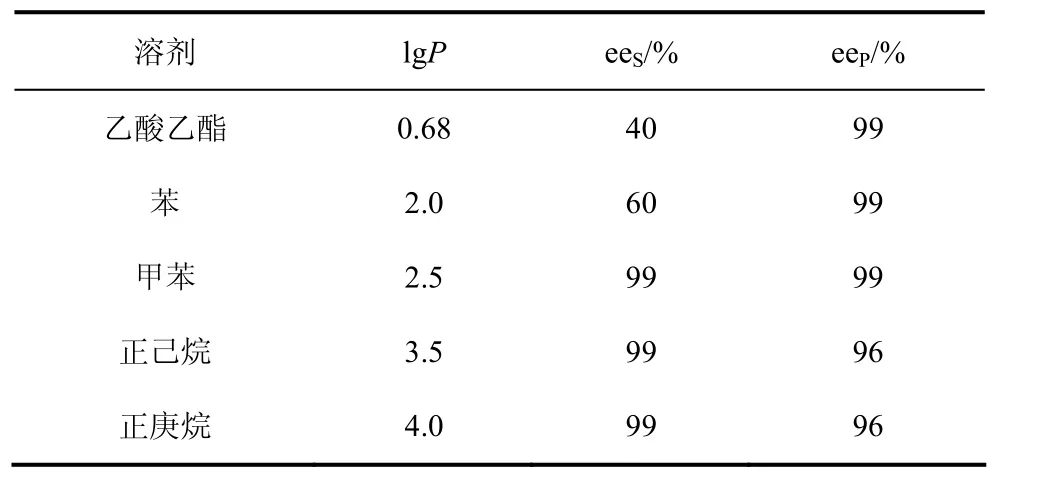
表1 溶剂对固定化脂肪酶PSL/HOOC-MCF对映选择性的影响
利用猪肝酯酶(PLE)催化内消旋环己烯二酯不对称水解反应生成半酯(图2)[18],介质磷酸盐缓冲溶液中加入二甲基亚砜、二甲基甲酰胺或叔丁醇时,水解反应的对映选择性均有所提高,但反应速率下降。从纯磷酸盐缓冲溶液改为加入10%(体积比)叔丁醇-缓冲溶液后,对映体过量值ee从55 %提高到96 %。
从目前的研究结果看,有机溶剂对酶对映选择性的影响是一个普遍的现象。目前,对于一个特定的酶催化反应,通过选择反应最适宜的有机溶剂,能够获得光学纯度高的单一手性对映体,布洛芬等外消旋化合物酶催化的适宜溶剂体系如表3。
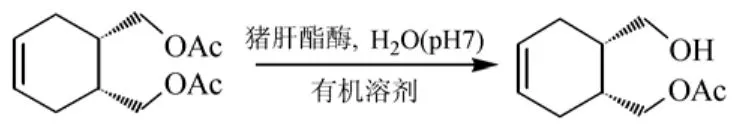
图2 脂肪酶PLE催化环己烯二酯不对称水解反应

表2 溶剂对猪肝酯酶催化的环己烯二酯不对称水解反应影响

表3 脂肪酶催化几种外消旋体酯化反应适宜的有机溶剂[18]
在有些情况中,有机溶剂还影响了酶的立体选择性,出现了对映选择性倒转的现象。米曲霉蛋白酶在催化N-乙酰丙氨酸氯乙酯与丙醇转酯化反应(图3),当溶剂从乙腈改为四氯化碳时,对映体偏向从 L-对映体变到 D-对映体[20]。假单胞菌脂肪酶在环己烷中催化潜手性二氢吡啶二羧基酯类衍生物水解产生R构型的产物,但是在异丙醚中该反应的产物为S构型[21]。
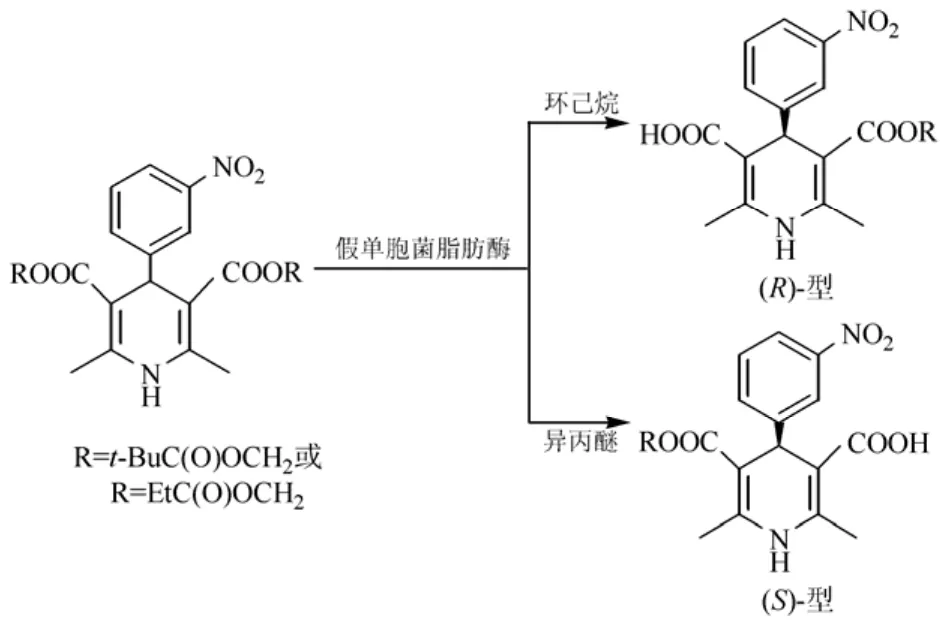
图3 脂肪酶催化潜手性二氢吡啶二羧基酯类衍生物选择性水解反应
2 酶催化合成β-内酰胺类抗生素的溶剂体系
β-内酰胺类抗生素主要分为青霉素类和头孢菌素类,二者约占全部抗生素年产量的75%以上。化学法合成抗生素步骤繁琐、条件苛刻,并且产生大量的三废。而酶法具有工艺简捷、条件温和、催化效率和选择性高等优点,同时省去了吡啶等毒性物质的使用,体现了低碳和绿色工艺技术[22-23]。青霉素G酰化酶(EC 3.5.1.11,PGA)在半合成β-内酰胺类抗生素产业中发挥着十分重要的作用,它既能够催化水解青霉素G产生6-氨基青霉烷酸,又能够催化合成各种不同的半合成青霉素和半合成头孢霉素,因而产生了巨大的经济效益[24-26]。在半合成β-内酰胺抗生素体系中,PGA催化的缩合过程可分为热力学控制和动力学控制。热力学控制的反应是水解反应的逆过程,酶仅用于加快达到平衡的速度,但不影响达到平衡时底物和产物的浓度。动力学控制的缩合反应中,PGA将母核与酰基供体结合形成目标产物半合成抗生素,起着转移酶的功能;但同时也催化产物和酰基供体的水解反应,产物的合成速率与水解速率之比(S/H)成为衡量反应体系重要的经济指标[27]。如青霉素G酰化酶催化7-氨基脱乙酰头饱烷酸(7-ADCA)和 D-苯甘氨酸甲酯(D-PGM)合成头孢氨苄体系(图4),PGA可催化7-ADCA 与D-PGM发生缩合反应生成头孢氨苄,也可催化头孢氨苄和D-PGM发生水解反应,生成副产物 D-苯甘氨酸(D-PG),存在着头孢氨苄合成与D-苯甘氨酸甲酯水解反应的竞争,产物最终的收率取决于合成速率和水解速率的相对程度,即合成与水解比 S/H。为了抑制水解反应速率,应选择在有机溶剂或有机化物-缓冲溶液中进行酶催化合成反应。
2.1 有机物-水溶剂体系
2.1.1 有机物-水共溶剂体系
甲醇和甘油等亲水性有机化合物与缓冲溶液能够互溶,形成有机物-缓冲溶液共溶剂体系。Kim等[28]在合成匹氨西林水相体系中,分别加入亲水性有机溶剂二甲基亚砜、甲醇、乙醇、乙腈,在 2%(体积比)的有机物-缓冲液共溶剂体系中进行反应,发现缓冲溶液中添加少量有机物,PGA的水解活性比合成活性均出现降低,但水解活性下降的幅度要高于合成活性,这意味着通过溶剂的调整可以在一定程度上调控合成反应与水解反应的相对速率。在氨苄西林合成的体系中加入醇类有机物[29-30],在含有乙二醇、丙三醇和1,3-丁二醇的缓冲共溶剂中,酶能够保持良好的活性,氨苄西林产率均较水相中反应有不同程度的提高,但合成速率均有所降低。Chow等[31]选择在甲醇-水和乙二醇-水共溶剂中合成阿莫西林,发现在甲醇-水共溶剂中合成与水解比S/H值高于乙二醇-水中。作者利用合成的亲水性聚合物磁性载体在水相中制备固定化PGA[32],固定化酶在乙二醇中合成氨苄西林的产率为96.7%,合成与水解比S/H值为 1.60,产率和S/H值均明显高于在缓冲溶液中进行的反应。实验也得到,在同等的反应条件下,固定化 PGA催化进行反应,产率和合成/水解比 S/H值均高于游离酶。Aguirre等[33]在醇类-缓冲溶液溶剂中合成头孢氨苄(表4),在 50%(体积比)乙二醇-缓冲溶液中,大幅度地提高了反应的合成/水解比,S/H值达1.351,是水相中的 2.4倍,头孢氨苄的产率为64.1%。有机物-水共溶剂体系中通过水活度的降低,能够有效地抑制产物和底物的水解,导致头孢氨苄的产率提高。但在抑制水解反应进行的同时,合成速率也在降低,如在 50% 在有机物-水共溶剂体系中,合成速率为0.350 mmol/(L·min),而在水相中的合成为0.932 mmol/(L·min),这可能是由于亲水性有机物易夺取酶表面的“必需水”,抑制了酶的活性。2.1.2 有机物-水不共溶剂体系

图4 青霉素G酰化酶催化合成头孢氨苄
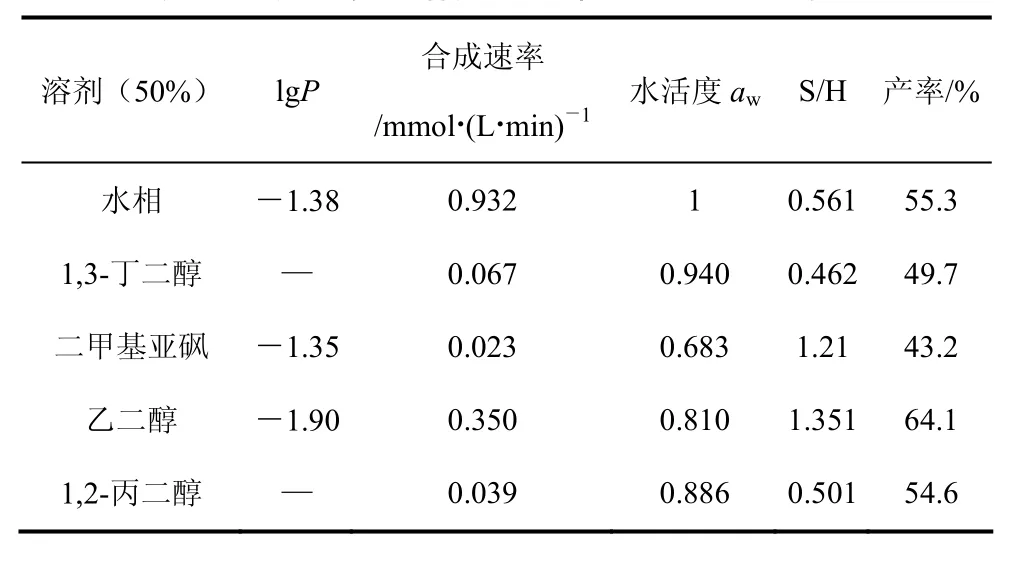
表4 有机/水共溶剂对产率和S/H值的影响
水相中添加疏水性有机溶剂,会形成有机物-水不共溶剂体系。受底物在水中或亲水性有机物-水共溶剂体系的不溶性所限,人们尝试以有机物-水不共溶剂作酶催化反应的溶剂。Park等[34]在乙酸乙酯-缓冲液(30%,体积比)和四氯化碳-缓冲液(30%,体积比)中合成头孢唑林,产率较在磷酸盐缓冲溶液中分别提高了65%和56%。合成头孢唑林的母核是 7-苯乙酰胺基-3-氯甲基头孢烷酸对甲氧卞酯,酰基供体为4-氮唑-1-乙酸甲酯,二者疏水性强,在疏水性乙酸乙酯和四氯化碳溶剂中能够溶解,这样在反应过程中底物分子容易与酶活性中心接触,有利于酶催化反应进行;同时有机物分子的存在对水解反应产生了抑制作用,总的结果导致合成头孢唑林产量提高(表5)。
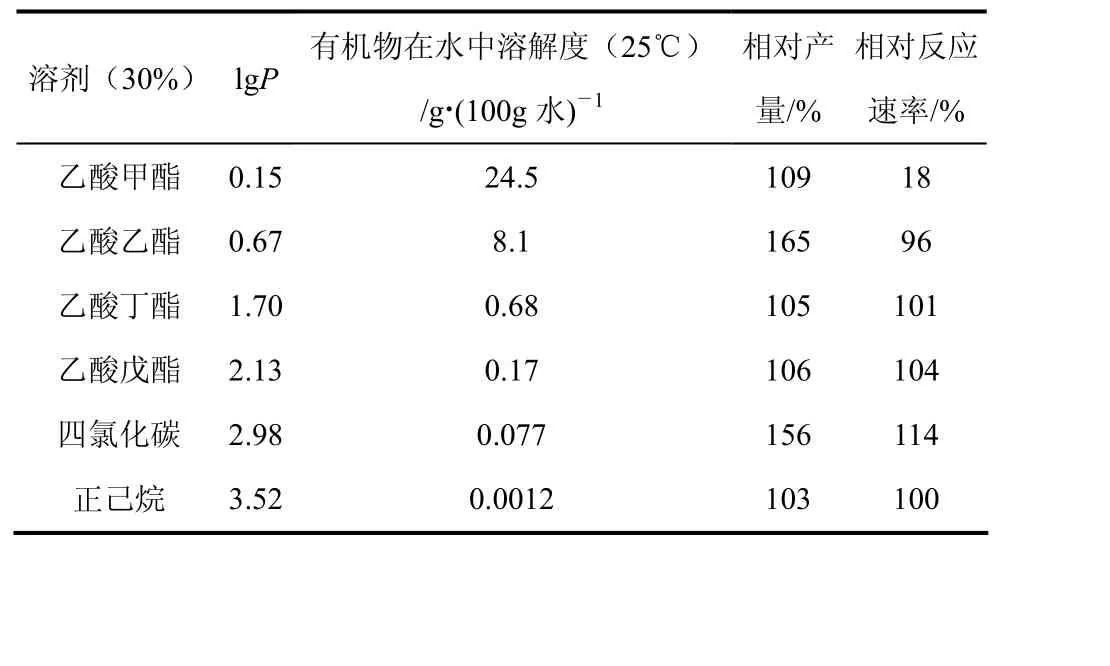
表5 头孢唑林在有机物-水不共溶溶剂中的酶催化合成
有机溶剂引入到水相中具有增加底物的溶解度、抑制水解反应、控制酶的选择性以及从低沸点的有机溶剂中易于回收产物等优势。但是有机溶剂对酶活性和稳定性不可避免的存在一些负面影响。在PGA催化合成匹氨西林的有机物-水不共溶剂体系的实验中得到,在添加环状脂肪族(环己醇,环己酮),杂环脂肪族(二氧六环,四氢呋喃)和芳烃类(吡啶,酚)的缓冲溶液中,酶的活性很低,在这些有机物-水不共溶溶剂进行反应,匹氨西林的合成速率远低于水相[28],其原因很可能是溶剂分子与酶疏水性活性中心之间的相互作用使得酶不能发挥催化作用。有机物-水不共溶剂体系有利于疏水性底物的溶解、水活度的降低,但疏水性溶剂与酶之间的疏水性相互作用导致酶部分失活亦不容忽视。
2.2 反胶束体系和双水相体系
在有机物-水溶剂体系中合成β-内酰胺类抗生素,在一定程度上能够抑制产物和底物的水解。但有机溶剂对酶活性的影响导致反应速率降低,这对于工业化生产是不利的,建立可控制水解但对酶活影响小的新合成体系是值得研究探索的课题。
反胶束体系是表面活性剂分子在非极性溶剂中自发形成纳米级的与正常胶束结构相反的一种油包水胶体分散系[35]。在反胶束中,表面活性剂分子在界面上定向排列,碳氢链伸向有机相;极性头或荷电头部及抗衡离子则向内排列,形成极性核,水可溶解到极性核中形成一个纳米级的“水池”[36-37]。由于反胶束体系能够较好地模拟酶的天然环境,因而,大多数酶在其中能够保持活性和稳定性,甚至表现出超活性。利用 AOT/异辛烷反胶束体系进行酶法合成头孢氨苄研究中发现,侧链D-苯甘氨酸甲酯的水解明显受到抑制,这可能是因为反胶束中的水被表面活性剂的极性头束缚住而使水活度大大降低的缘故。
双水相体系是利用两种不同高聚物的水溶液或一种高聚物和一种无机盐的水溶液,因其浓度不同而形成互不相溶的两液相体系。不同物质进入双水相体系后,由于表面性质、电荷作用和各种作用力如氢键和离子键等的存在和环境的影响不同,在两相间的分配则不同。调整双水相体系浓度,将反应物和催化剂分配于下相,产物分配于上相,实现反应与产物分离与耦合,既消除了产物的水解和底物抑制问题,同时酶的活性在高聚物以及盐溶液体系得到了保持,从而提高了催化反应的效率。Hernandez-Justiz等[38]在聚乙二醇(600)-硫酸铵双水相体系中,利用青霉素G 酰化酶催化合成头孢氨苄,较单相酶促反应的产率提高了35 %。Wei等[39]在聚乙二醇(400)-硫酸镁组成的双水相体系中合成头孢氨苄,产率比传统反应体系中提高了39%。作者用环氧基功能化介孔分子筛 SBA-15 固定青霉素酰化酶在双水相体系中合成氨苄西林[40],产率为80 %,而在水相体系中合成氨苄西林,其产率仅为27 %。
反胶束体系和双水相体系很好地解决了酶在有机溶剂中的失活问题,同时能够有效控制底物和产物的水解,在半合成β-内酰胺抗生素中得到了应用。但也存在表面活性剂以及双水相体系黏度大,目标产物从反应体系分离困难,反胶束体系中表面活性剂对底物产生污染等问题,这些问题的解决仍需要进行大量的研究工作。
3 结 语
手性药物的立体化学特性会影响其药效或产生毒性,光学纯手性药物的开发已经在世界各地广泛地开展,酶催化已在一些手性药物和中间体中得到了应用,但对于已知的2000多种酶的总体而言,这些酶中只有极少数被用于有机合成中,这其中尚有需要研究解决的生物问题,也有化学问题,而适宜于某一有机合成反应溶剂的选择是需要的,有时甚至是必需的。尽管目前对于溶剂效应的行为机理不是十分清楚,但溶剂对酶活性和选择性产生的影响,在酶催化合成手性化合物中的调控作用日显突出,有时确实是巨大的。随着蛋白工程和工业微生物的不断发展,稳定的、耐有机溶剂的、廉价的适用于多种底物的酶的不断开发,随着溶剂效应机理的揭示和溶剂工程的应用,伴随着当今有机化学、生物化学和微生物学等多学科的交融发展,酶在手性药物合成中的应用会更为广阔,在工业生产方面会取得更多突破。
[1]Bhushan I,Parshad R,Qazi G H,et al. Lipase enzyme immobilization on synthetic beaded macroporous copolymers for kinetic resolution of chiral drugs intermediates[J].Proc. Biochem.,2008,43:321-330.
[2]季青春,曹艳,任伟,等. 假单胞菌脂肪酶手性拆分研究进展[J]. 化工进展,2010,29(4):722-744.
[3]Zaks A,Klibanov A M. Enzymatic catalysis in organic media at 100℃[J].Science,1984,224(4654):1249-1251.
[4]罗旭,钱俊青. 叔丁醇体系中脂肪酶催化合成蔗糖乙酸酯[J]. 高校化学工程学报,2010,24(3):451-455.
[5]Zhang Y M,Li J,Han D F. An efficient resolution of racemic secondary alcohols on magnetically separable biocatalyst[J].Biochem. Biophys. Res. Commun.,2008,365:609-613.
[6]邱树毅,姚汝华. 有机溶剂中的酶催化——水和有机溶剂的影响[J]. 工业微生物,1996,16(3):40-45.
[7]Zaks A,Klibanov A M. The effect of water on enzyme action in organic media[J].J. Biol. Chem.,1988,263(17):8017-8021.
[8]Laane C,Boeren S,Vos K,et al. Rules for optimization of biocatalysis in organic solvents[J].Biotechnol. Bioeng,1987,30(1):81-87.
[9]Hernandez-Rodrigueza B,Cordovab J,Barzanac E,et al. Effects of organic solvents on activity and stability of lipases produced by thermotolerant fungi in solid-state fermentation[J].J. Mol. Catal. B:Enzym.,2009,61(3-4):136-142.
[10]Frings K,Koch M,Hartmeier W. Kinetic resolution of 1-phenyl ethanol with high enantioselectivity with native and immobilized lipase in organic solvents[J].Enzyme Microb. Technol.,1999,25(3-5):303-309.
[11]朱洁,刘洪湖,胡英. 有机溶剂中脂肪酶催化的 2-辛醇动力学拆分[J]. 分子催化,1998,12(5):323-328.
[12]刘军民,许建和,刘幽燕,等. 混合溶剂系统中固定化脂肪酶对酮基布洛芬的催化酯化反应[J]. 高等学校化学学报,1998,19(2):1959-1963.
[13]Yennawar N H,Yennawar H P,Farber G K. X-ray crystal structure of gamma-chymotrypsin in hexane[J].Biochemistry,1994,33(23):7326-7336.
[14]罗贵民. 酶工程[M]. 北京:化学工业出版社,2003:226-227.
[15]许建和,刘军民,许学书,等. 混合溶剂系统对脂肪酶酯化活性和选择性的影响[J]. 生物工程学报,1999,15(2):267-269.
[16]崔玉敏,魏东芝,俞俊棠. 有机介质中固定化酶催化萘普森与硅醇的酯化反应[J]. 华东理工大学学报,1998,24(4):410-414.
[17]Xue P,Yan X H,Wang Z. Lipase immobilized on HOOC-MCF:A highly enantioselective catalyst for transesterification resolution of(R,S)-1-phenylethanol[J].Chin. Chem. Lett.,2007,18(4):929-933.
[18]Guanti G,Banfi L,Narisano E,et al. Enzymes in asymmetric synthesis:Effect of reaction media on the PLE catalysed hydrolysis of diesters[J].Tetrahedron. Lett.,1986,27(38):4639-4642.
[19]Persichetti R A,Lalonde J J,Govardhan C P,et al. Candida rugosa lipase:Enantioselectivity enhancements in organic solvents[J].Tetrahedron. Lett.,1996,37(36):6507-6510.
[20]Sakurai T,Margolin A L. Control of enzyme enantioselectivity by the reaction medium[J].J. Am. Chem. Soc.,1988,110(21):7236-7237.
[21]Hirose Y,Kariya K,Sasaki I,et al. Drastic solvent effect on lipase-catalyzed enantioselective hydrolysis of prochiral 1,4-dihydropyridines[J].Tetrahedron.Lett.,1992,33(47):7157-7160.
[22]Xue P,LU G Z,Liu W Y. Poly(GMA/MA/MBAA)copolymer beads:A highly efficient support immobilizing penicillin G acylase[J].Chin. Chem. Lett.,2006,17(1):129-133.
[23]Lü Y J,Guo Y L,Wang Y Q,et al. Immobilized penicillin G acylase on mesoporous silica:The influence of pore size,pore volume and mesophases[J].Microporous. Mesoporou. Mater.,2008,114: 507-510.
[24]Xue P,Xu F,Xu L D. Epoxy-functionalized mesostructured cellular Foams as effective support for covalent immobilization of penicillin G acylase[J].Appl. Surf. Science,2008,255(5):1625-1630.
[25]薛屏,刘海峰,杨金会. 亲水性环氧聚合物磁性微球的制备及其固定化青霉素酰化酶[J]. 化工学报,2008,59(2):443-449.
[26]宋建彬,任孝修. 以壳聚糖为载体固定化青霉素酰化酶的研究[J].化工进展,2004,23(2):181-184.
[27]Du L,Wu Q,Chen C X,et al. A two-step,one-pot enzymatic synthesis of ampicillin from penicillin G potassium salt [J].J. Mol. Catal. B:Enzym.,2009,58:208-211.
[28]Kim M G,Lee S B. Penicillin acylase-catalyzed synthesis of pivampicillin:Effect of reaction variable and organic solvents[J].J. Mol. Catal. B:Enzym.,1996,1(2):71-80.
[29]Wei D Z,Yang L. Effects of ethylene glycol on the synthesis of ampicillin using immobilized penicillin G acylase[J].J. Chem. Technol. Biotechnol.,2003,78(4):431-436.
[30]Illanes A,Fajardo A. Kinetically controlled synthesis of ampicillin with immobilized penicillin acylase in the presence of organic cosolvents[J].J .Mol. Catal. B:Enzym.,2001,11(4-6):587-595.
[31]Chow Y,Li R J,Wu J C,et al. Modeling and optimization of methanol as a cosolvent in amoxicillin synthesis and its advantage over ethylene glycol[J].Biotechnol. Bioprocess. Eng.,2007,12(4):390-398.
[32]Xue P,Song X D,Cao X R. An effcient synthesis of ampicillin on magnetically separable immobilized penicillin G acylase [J].Chin. Chem. Lett.,2010,21(4):765-768.
[33]Aguirre C,Toledo M,Medina V,et al. Effect of cosolvent and pH on the kinetically controlled synthesis of cephalexin with immobilised penicillin acylase[J].Proc. Biochem.,2002,38(3):351-360.
[34]Park C B,Lee S B,Ryu D Y. Penicillin acylase-catalyzed synthesis of cefazolin in water-solvent mixtures:Enhancement effect of ethyl acetate and carbon tetrachloride on the synthetic yield[J].J. Mol. Catal. B:Enzym.,2000,9(4-6):275-281.
[35]Tonova K,Lazarova Z. Reversed micelle solvents as tools of enzyme purification and enzyme-catalyzed conversion[J].Adv. Biotechnol.,2008,26:516-532.
[36]Feitosa E,Catelam K T,Hasmann F A. Phase diagrams of a CTAB/organic solvent/buffer system applied to extraction of enzymes by reverse micelles[J].J. Chromatogr. B,2008,862(1-2):58-63.
[37]Sun Y,Bai S,Gu L,et al. Effect of hexanol as a cosolvent on partitioning and mass transfer rate of protein extraction using reversed micelles of CB-modied lecithin[J].Biochem. Eng. J.,1999,3(1):9-16.
[38]Hernandez-Justiz O,Fernandez-Lafuente R,Terreni M,et al. Use of aqueous two-phase systems forin situextraction of water soluble antibiotics during their synthes is by enzymes immobilized on porous supports[J].Biotechnol. Bioeng.,1998,59(1):73-79.
[39]Wei D Z,Zhu J H,Cao X J. Enzymatic synthesis of cephalexin in aqueous two-phase systems[J].Biochem. Eng. J.,2002,1(2-3):95-99.
[40]宋肖单,李丽,薛屏. 固定化青霉素酰化酶在双水相体系中催化合成氨苄西林[J]. 宁夏大学学报,2010,31(1):74-77.
Solvent effect on catalytic synthesis of chiral compouds with lipase and penicillin G acylase
XUE Ping,CAO Xuerong
(Key Laboratory of Energy Resources and Chemical Engineering,Ningxia University,Yinchuan 750021,Ningxia,China)
Synthesis of chiral drugs and intermediates catalyzed by enzyme has high efficiency,energy saving and environment-friendliness advantages. This paper reviews the solvent effect on the enzymatic reaction in non-aqueous media with lipases,namely,the activity and enantioselectivity of enzyme adjusted by solvent system to improve the efficiency of catalytic reaction. The kinetically controlled synthesis of β-lactam antibiotics with penicillin G acylase was introduced in different solvent systems,including the organic-water miscible solvents,organic-water immiscible solvents,reverse micelles and aqueous two-phase system. The yield of kinetically controlled synthesis of β-lactam antibiotics and synthesis/hydrolysis ratio(S/H)could be enhanced by designing an effective solvent system to better utilize the substrates.
solvent effect;lipase;penicillin G acylase;chiral compands;enantioselectivity
O 643.4
A
1000–6613(2011)07–1577–07
2010-12-21;修改稿日期:2011-01-17。
国家973计划前期研究专项(2010CB534916)及国家自然科学基金(21064005)项目。
及联系人:薛屏(1962—),女,博士,教授,主要从事生物催化研究。E-mail ping@nxu.edu.cn。

