病原芽胞杆菌几丁质酶产生菌的筛选与活性鉴定
蔡亚君,桂 震,李 锋,杨小俊
病原芽胞杆菌几丁质酶产生菌的筛选与活性鉴定
蔡亚君,桂震,李锋,杨小俊
(武汉纺织大学 环境工程学院,湖北 武汉 430073)
通过特异引物PCR方法和水解圈活性法对62株苏云金芽胞杆菌菌株、26株蜡状芽胞杆菌菌株及18株球形芽胞杆菌菌株进行了几丁质酶产生菌的筛选。所测苏云金芽胞杆菌中除4株野生型菌株外均为阳性结果,蜡状芽胞杆菌仅1株为阴性结果,球形芽胞杆菌全为阴性结果,且水解圈法观察结果与PCR检测结果一致。在此基础上,通过DNS比色法对几丁质酶产生菌株的几丁质酶比活力也进行了测定。对这些具有致病性的病原芽胞杆菌几丁质酶的研究对于研究其致病机理及对其进行遗传改良具有重要的理论和实际应用价值。
几丁质酶;苏云金芽胞杆菌;蜡状芽胞杆菌;球形芽胞杆菌;比活力;致病
几丁质(chitin)为聚β-1,4-乙酰葡萄糖胺,是一种广泛存在于自然界的直链状高分子生物多聚体。自然界每年生成的几丁质数以百亿吨计,是储量仅次于纤维素的天然聚合物。几丁质是许多真菌细胞壁的主要成分,也大量存在于昆虫或节肢动物的甲壳及昆虫的中肠中。几丁质酶(chitinase)可催化水解几丁质的β-1,4糖苷键生成N-乙酰-D-氨基葡萄糖(NAG),广泛存在于微生物、植物、昆虫和脊椎动物中,在环境保护和农业等方面有着广泛的应用前景。至今,芽胞杆菌属中已有环状芽胞杆菌(),蜡状芽胞杆菌(,简称),苏云金芽胞杆菌(,简称)等相继发现产几丁质酶的菌株。
是目前世界上应用最广泛的生物杀虫剂,在多种害虫的综合防治中发挥了重要的作用。与以及炭疽芽胞杆菌(.,简称)关系紧密,它们具有相似的形态特征和较高DNA 同源性[1]。事实上,同、、蕈状芽胞杆菌(.,简称)、假真菌样芽胞杆菌(.)以及韦氏芽胞杆菌(.,简称) 已经被归类于芽胞杆菌属蜡状芽胞杆菌群[2,3 ]。
考虑到与菌株间的同源性关系,我们对本实验室保存的87 株蜡状芽胞杆菌群菌株,包括62 株、26 株菌株进行了几丁质酶活性的检测及其活力的测定,另外也对在蚊虫防治中广泛应用的球形芽胞杆菌(,简称)的18株菌株同时进行了研究。对致病性病原芽胞杆菌几丁质酶的研究对于研究其致病性及其遗传改良具有重要的理论和实际应用价值。
1 材料与方法
1.1菌株
所有菌株为武汉病毒研究所虫媒病毒媒介控制实验室保存。
1.2培养基
LB液体培养基:1.0 %NaCl,1.0 %蛋白胨,0.5 %酵母粉,pH值为7.0;LB固体培养基:LB液体培养基中加入2 %琼脂。
几丁质酶诱导培养基:10 %胶体几丁质(湿重),0.1 % (NH4)2SO4,0.3 % KH2PO4,0.1% MgSO4·7H2O,0.7% K2HPO4,0.05%柠檬酸钠,0.02%酵母粉,pH值为7.0;几丁质诱导平板:在上述诱导培养基中加入2. 0 %琼脂粉。
胶体几丁质的制备:将10 g几丁质粉末投入180 mL浓盐酸中,搅拌2 h溶解后再加入1 L预冷的95%乙醇,搅拌30 min后-20℃保存备用。使用时取10 mL液体先离心,沉淀用50 mL 0.1 M 磷酸钠盐缓冲液(pH7.0)洗涤三次后溶于9 mL 0.1 M 磷酸钠盐缓冲液(pH6.0)中,最后得到浓度约为100 mg/mL的胶体几丁质。
1.3几丁质酶基因检测
根据Genbank中芽胞杆菌几丁质酶基因全序列的高度保守序列,应用分子生物学软件DNASTAR设计、上海申工生物工程技术服务有限公司合成了一对几丁质酶基因部分序列扩增引物CHI1:5’-TTGGGTACTTTCCTTCGTGG-3’,CHI2:5’-CGTATTTGCTGCTGGGTCAT-3’。PCR反应体系为:模板(将新鲜活化的菌液离心收集候悬浮于适量ddH2O中,沸水浴10 min后迅速置于冰上冷却10 min,离心取上清作为PCR模板)5 µL,10×Taq reaction buffer 2.5 µL,2.5 mM dNTPs 0.5 µL,Taq polymerase 1 U,10 pM引物各1 µL,加ddH2O至25 µL。扩增程序为:94 ℃预变性10 min,94℃变性30 sec,50℃退火3 min,72℃延伸3 min,循环28次后72℃延伸7 min。
1.4几丁质水解活性检测
菌株的几丁质水解活性通过水解圈法进行检测,即在几丁质酶诱导平板上打直径为0.5 cm的孔,取50 µL在30 ℃、200 r/min条件下LB 液体培养基过夜培养的各芽胞杆菌培养物加入孔中,30 ℃温箱中先正置培养12 h 后再倒置培养72 h,0.1%刚果红水溶液染色后观察水解圈的有无及大小。
1.5DNS比色法测定产酶菌的酶活力
将菌种在30 ℃、200 r/min条件下LB 液体培养基过夜培养后的200 µL培养物加入至5 mL几丁质酶诱导培养基中,30 ℃、200 r/min 培养72 h ,培养物12,000 r/min离心20 min,收集上清,参照刘铭等[4]通过DNS比色法测定酶活力大小,一个酶活力单位(U) 定义为合适温度下每小时产生1 μg 还原糖的酶量。
2 结果与分析
2.1芽胞杆菌几丁质酶基因PCR检测
以CHI1/CHI2作为引物,通过PCR方法检测本室芽胞杆菌中几丁质酶基因的分布,结果发现,所有18株球形芽胞杆菌菌株(分别为菌株 IAB59,IAB763,IAB769,IAB872,IAB881,SD7001,LP1-G,CoK31,NRS1693,DaK64,2314-2,2317-2,LFB-Fricon 2711,CIP5125,NRS1184,ATCC-14577,2173,KellenQ)的几丁质酶基因检测结果均呈阴性,完全观察不到PCR扩增带(电泳图片未显示);在26株蜡状芽胞杆菌野生菌株中,仅有一株(B294)的PCR结果呈阴性,有2株(B505,B601)可见微弱的带,而其余23株均能观察到明显的扩增带(见表1);在检测的苏云金芽胞杆菌31株标准血清型菌株和31株分离菌株中,除4株野生型菌株(PF31、PF33、PF35和PF38)检测结果为阴性,H34血清型菌株扩增带较弱外,其余菌株检测结果均为明显的阳性反应(见表1)。

图1 Bacillus thuringiensis 菌株几丁质酶活时相分析
2.2芽胞杆菌几丁质水解活性检测及活力测定
几丁质水解活性圈检测表明,在18株球形芽胞杆菌菌株中,完全观察不到几丁质水解现象;26株蜡状芽胞杆菌野生菌株中,仅有一株(B294)完全不产生几丁质水解活性,有6株(B182、B231、B234、B310、B449、B505)产生微弱的几丁质水解活性,而其余19株均能观察到明显的几丁质水解活性,其中有5株(B089、B126、B281、B424、B538)具有很高的与阳性对照菌株沙雷氏菌S3相当的几丁质水解活性;在苏云金芽胞杆菌中,除四株野生型菌株(PF31、PF33、PF35和PF38)外,其余27株野生型菌株和所有31株标准血清型菌株均能产生明显的水解圈,其中,野生菌株Gr-9和H4标准血清型菌株T04A001的水解圈直径最大(见表1)。
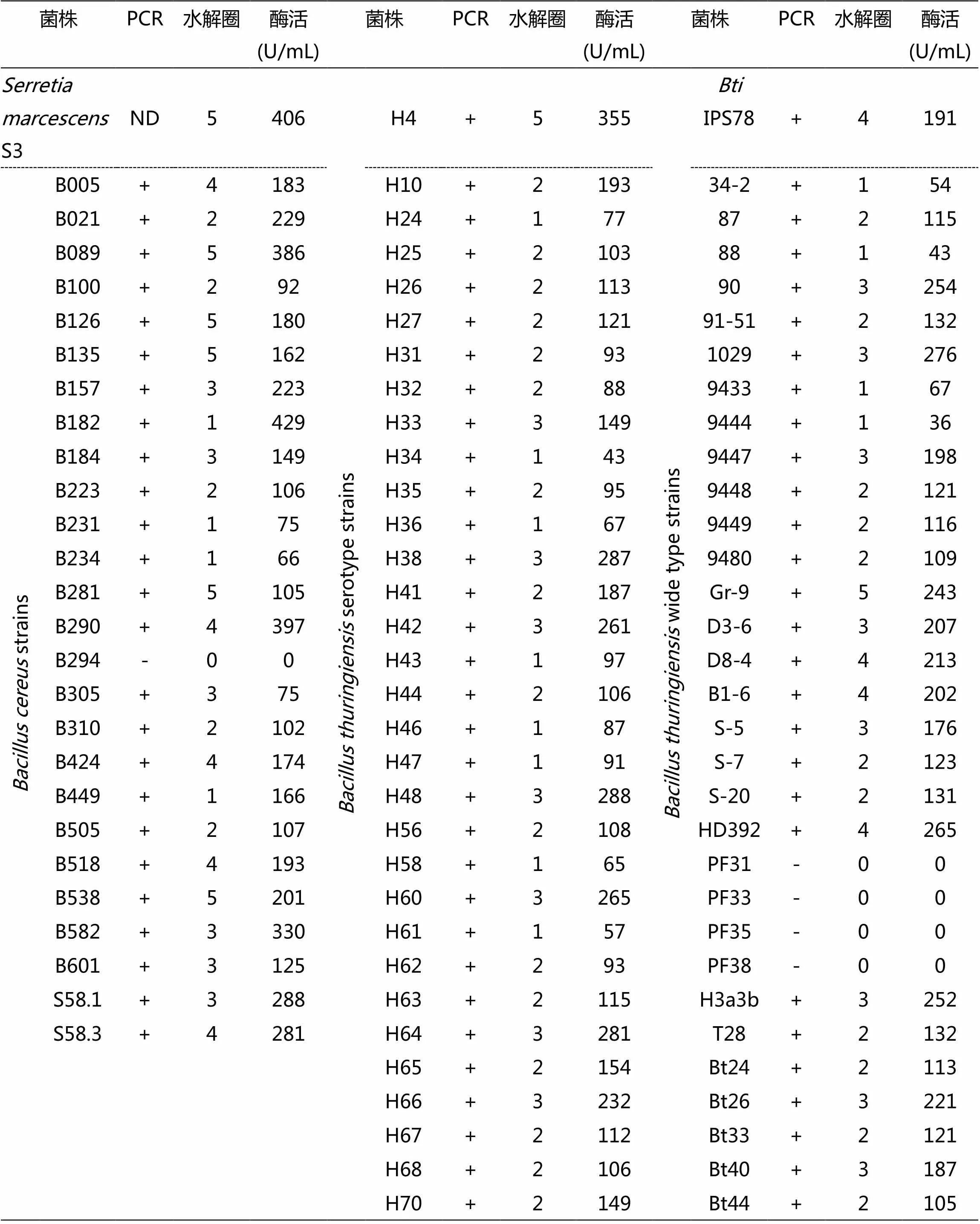
表1 致病芽胞杆菌产几丁质酶活性分析总表
+: 阳性结果;-: 阴性结果。几丁质水解活性: R (水解圈半径) -r (孔半径);0: 无水解圈, 1: R-r≤1mm, 2: 1<R-r≤2mm, 3: 2<R-r≤3mm,4: 3<R-r≤4mm,5: R-r>4mm。
DNS比色法对蜡状芽胞杆菌和苏云金芽胞杆菌菌株进行了几丁质酶比活力的测定(见表1)。在蜡状芽胞杆菌中,B182、B290、B089和B582的几丁质酶产量最高,分别为429、397、386、330 U/mL,与S3的几丁质酶产量(406 U/mL)相当。在苏云金芽胞杆菌中,H4血清型菌株T04A001的几丁质酶产量较高(355 U/mL),本研究中作为PCR检测和水解圈活性检测阳性对照的IPS78菌株的几丁质酶产量略低,为191 U/mL。
2.3产几丁质酶菌株产酶特性分析
选取了菌株中的H4血清型菌株T04A001和野生型的HD392、Gr-9菌株绘制了其在几丁质诱导培养基上生长时的产酶曲线(见图1),同时时相镜检观察各阶段培养物的芽胞生长变化,发现几丁质酶酶活在菌株的对数生长末期、芽胞初始形成期(12 h)达到最高,分别可达到496、413、393U/ml,此后芽胞形成并逐渐脱落,酶活也随之开始逐渐下降。
3 讨论
在本研究中,检测的大部分蜡状芽胞杆菌和苏云金芽胞杆菌均含有几丁质酶基因和不同程度的产生几丁质酶,证明蜡状芽胞杆菌和苏云金芽胞杆菌普遍都能产生几丁质酶。所用的PCR和水解圈的检测方法结果一致,表明这两种方法都具有很好的可靠性。水解圈的大小和我们根据DNS方法测定的几丁质酶比活力结果并不完全一致,推测与测定几丁质酶比活力时的取样时间有关,如图1中所测三株菌株的最高酶活均在12 h处,而到72 h时酶活已经降到了很低程度。而本研究中所用PCR方法中的所用引物参照的主要是蜡状芽胞杆菌群菌株的几丁质酶基因,且几丁质水解活性的检测方法也不一定适合球形芽胞杆菌,因此在球形芽胞杆菌未检测到几丁质酶活性,并不能说明所有球形芽胞杆菌都不能产几丁质酶。
大量研究证明,外源几丁质酶的加入对微生物杀虫剂具有增效作用[5];在苏云金芽胞杆菌中表达几丁质酶,使几丁质酶与杀虫晶体蛋白共表达,能提高对鳞翅目害虫的毒力[6-8]。在几丁质酶对双翅目害虫的研究方面,已证明几丁质酶对埃及伊蚊具有微弱毒力[9],且通过在球形芽胞杆菌中表达几丁质酶,已显著提高了球形芽胞杆菌对致倦库蚊幼虫抗性品系的抗性[10],不仅对球形芽孢杆菌在蚊虫防治中逐渐引起的抗性问题有了解决办法,对于苏云金芽胞杆菌在害虫防治实际应用中逐渐严重的抗性问题也提供了解决思路。因此,本研究对病原芽胞杆菌几丁质酶产酶菌株的筛选和活性测定对于病原芽胞杆菌在生物防治中的更好应用也具有重要意义。
[1] Helgason E, Caugant D A, Olsen I, et al. Genetic structure of population of Bacillus cereus and B. thuringiensis isolates associated with periodontitis and other human infections[J]. J Clin Microbiol, 2000, 38 (4) : 1615-1622.
[2] Lechner S, Mayr R, Francis K P, et al. Bacillus weihenstephanensis sp. nov. is a new psychrotolerant species of the Bacillus cereus group[J]. Int J Syst Bacteriol, 1998, 48(4): 1373- 1382.
[3] Nakamura L K. Bacillus pseudomycoides sp. nov[J]. Int J Syst Bacteriol, 1998, 48(3): 1031- 1035.
[4] Liu M, Cai Q X, Liu H Z, et al.Chitinolytic activities in Bacillus thuringiensis and their synergistic effects on larvicidal activity[J]. J Appl Microbiol, 2002, 93: 374-379.
[5] Sampson M N, Gooday G W. Involvement of chitinases of Bacillus thuringiensis during pathogenesis in insects[J]. Microbiology, 1998, 144: 2189-2194.
[6] Lertcanawanichakul M, Wiwat C, Bhumiratana A, et al. Expression of chitinase-encoding genes in Bacillus thuringiensis and toxicity of engineered B. thuringiensis subsp. aizawai toward Lymantria dispar larvae[J]. Curr Microbiol, 2004, 48: 175-181.
[7] Tantimavanich S, Pantuwatana S, Bhumiratana A, et al. Cloning of chitinase gene into Bacillus thuringiensis subsp. aizawai for enhanced insecticidal activity[J]. J Gen Appl Microbiol, 1997, 43: 341-347.
[8] Thamthiankul S, Moar W J, Miller M E, et al.Improving the insecticidal activity of Bacillus thuringiensis subsp. aizawai against Spodoptera exigua by chromosomal expression of a chitinase gene[J]. Appl Microbiol Biotechnol, 2004, 65: 183-192.
[9] Thamthiankul S, Suan-Ngay S, Tantimavanich S, et al. Chitinase from Bacillus thuringiensis subsp. Pakistani[J]. Appl Microbiol Biotechnol, 2001, 56: 395-401.
[10]Cai Y J, Yan J P, Hu X M, et al. Improving the insecticidal activity against resistant Culex quinquefasciatus mosquitoes by expression of chitinase gene chiAC in Bacillus sphaericus[J]. Appl Environ Microbiol, 2007, 73: 7744-7746.
Chitinolytic ActivityDetection in Pathogenic Bacillus sp. Strains
CAI Ya-jun, GUI Zhen, LI Feng, YANG Xiao-jun
(College of Environmental Science and Engineering, Wuhan Textile University, Wuhan Hubei 430073, China)
The presence of chitinase gene and the chitinolytic activity among pathogenic Bacillus sp. strains have been detected by PCR method and chitinase activity assays. The results showed that no chitinase gene and chitinase production been observed in 1 of 26 Bacillus cereus strains, 4 of 62 B. thuringiensis strains and all 21 B. sphaericus strains. All other strains could produce chitinolytic activity during their growth. The investigation of chitinase-producing strains in pathogenic Bacillus sp. provide us more information for the research of Bacillus sp. strains’ pathogenesis and chitinase’ application potency in insect control.
Chitinase; Bacillus thurinngiensis; B.cereus; B.sphaericus chitinolytic activity; pathogenic
Q89
A
1009-5160(2011)03-0058-04
蔡亚君(1980-),女,博士,讲师,研究方向:应用微生物遗传改良.
武汉纺织大学校基金项目(2008Z24).

