羟基化锌催化臭氧氧化去除水中痕量磺胺嘧啶
周宁娟,薛 罡,卜 聃,刘亚男 (东华大学环境科学与工程学院,上海 201620)
羟基化锌催化臭氧氧化去除水中痕量磺胺嘧啶
周宁娟,薛 罡*,卜 聃,刘亚男 (东华大学环境科学与工程学院,上海 201620)
以实验室制备的羟基化锌(ZnOOH)为催化剂,研究了其催化臭氧化去除水中痕量磺胺嘧啶(SD)的效能,通过研究叔丁醇对催化效果的影响,推断了催化反应机理,探讨了臭氧投加量、水质因素、催化剂投加量和使用次数对催化性能的影响因素.结果表明,ZnOOH对臭氧氧化水中的SD有较强的催化活性.催化剂表面结合的羟基基团有利于催化反应.在优化的实验条件下,蒸馏水中反应30min时,催化臭氧化比单独臭氧化对SD的去除率提高了47.7%.催化过程遵循自由基反应机理,SD的去除效果随催化剂投加量的增加而提高,催化剂在重复使用后催化效果基本不变,水中的氯离子可以明显降低催化剂的活性,偏碱性条件下,催化效果更佳.
羟基化锌;催化臭氧化;磺胺嘧啶;羟基自由基
磺胺嘧啶(SD)是一种应用广泛的抗生素类药物.由于磺胺类药物亲水性强,很容易被雨水冲刷进入到地表水或者渗滤到地下水中,从而进入到食物链影响环境和人体健康[1-2].因此,研究此类化合物的去除机理与方法具有实际意义和应用价值.
SD是性质相对稳定的抗生素类物质,因此不能用生物降解的方法处理.传统的饮用水处理工艺对部分溶解性微量有机污染物去除能力十分有限[3-5].目前国内常用的高级氧化工艺中臭氧化降解是主要的方法之一.但臭氧分子对有机物的氧化有强的选择性[6].已有的研究表明[7-9],采用臭氧和其他氧化剂联用技术可以更好地提高对有机污染物的降解效率.
过度金属羟基化物作为催化剂用于臭氧氧化工艺,是近几年来的新方法,其中利用羟基化锌催化臭氧降解磺胺类物质的研究还鲜见报道.本实验采用实验室自制的羟基化锌作为臭氧化的催化剂,对羟基化锌催化臭氧化去除水中痕量的 SD的效能和催化机理进行了探讨,为实际给水系统中处理有机污染物提供理论支持和科学依据.
1 材料与方法
1.1 材料
SD 储备液:称取 0.01g SD 标准品(纯度>99.0%)溶于适量 75%乙腈,完全溶解后转移至100mL容量瓶中,用75%的乙腈定容,放在棕色瓶内,置于-20oC冷冻避光保存.标准使用液现用现配,用75%乙腈溶液定容;3mL/500mg的C18固相萃取柱,QSC-12T 型可调氮吹仪,用于固相萃取;HPD-25型无油真空泵,HL-5型恒流泵,控制进水流量;0.1mol/L的 Na2S2O3溶液,臭氧化反应的终止剂;其他化学试剂均为分析纯.
催化剂:采用碱式沉淀法[7]制得羟基化锌(ZnOOH)催化剂,将沉淀在60℃干燥处理19h,把所得固体研细、过筛,取粒径均匀(约< 0.35mm)的部分备用.
1.2 实验装置及流程

图1 实验装置与流程Fig.1 Schematic diagram of experiment system
HLO-820A 型臭氧水质处理机(温州市雅歌环保设备有限公司).实验过程中,臭氧和水样均连续通入反应器,臭氧投加量通过改变进气量和进水流量控制.实验在自制的有机玻璃柱中进行(图1),其中臭氧接触反应柱内径为70mm,实验进水为常规给水处理的出水,进水口在柱底部上方20mm 处.经臭氧发生器产生的臭氧气体,由柱下端的钛板布气盒(孔径约20μm)进入柱内,在水位上升的过程中与废水充分接触,出水口与进水口相距约 900mm,接触柱上方接尾气回收装置.在各分析时刻从取样口取样,所取水样立即用0.1mol/L的 Na2S2O3溶液终止臭氧反应,样品经预处理后进行液相色谱分析.SD的初始反应浓度为 200μg/L,反应温度为常温,催化剂投加量为100mg/L.
1.3 分析方法
水中臭氧浓度采用碘量法测定.所取水样经0.45µm 滤膜过滤后,用固相萃取富集浓缩,然后利用高效液相色谱方法进行定量测定.检测条件为:色谱柱用AgilentZORBAX Exlipse XDB-C18柱(150mm×4.6mm,5µm),流动相为水(用乙酸调节pH值至4)和乙腈(体积比为7525),∶流速为1mL/min,柱温为35℃,检测波长为269nm,进样量为20µL.该方法的检出限为5ng/mL.
2 结果与讨论
2.1 催化氧化对以蒸馏水和自来水为本底的磺胺嘧啶的去除
分别以蒸馏水和以自来水为本底配制SD水样,对这2种水样分别进行臭氧氧化、ZnOOH催化臭氧氧化和 ZnOOH吸附的实验,实验结果如图2、图3所示.对比图2、图3可知,自来水中单独臭氧氧化对SD的去除效率与蒸馏水大致相同,且在这2种本底水样中,SD的去除大部分发生在30min以内,30min以后去除甚少.这个现象符合O3在水中分解的两端理论[10],即通常加入到天然水中的臭氧,其消耗分为2个步骤:快速消耗和在其之后的缓慢分解,第 1步也称为 ID阶段(instaneous ozone demand),这一阶段水中的天然有机物(NOM) 或还原性物质消耗一部分臭氧生成羟基自由基(·OH),·OH 的氧化能力更强,氧化去除 SD的效果较臭氧分子好.同时自来水水样中SD催化氧化的去除率比蒸馏水水样下降了近10%,这可能是因为自来水中的某些无机离子(Cl-等)抑制了臭氧化过程中·OH的生成.
为研究催化剂对目标物的吸附作用,对催化剂进行了静态吸附实验,结果表明催化剂对目标物没有吸附作用,这与ZnOOH的表面性质和SD的结构特性有关.有研究显示[7],催化剂表面的OH 原子团易于吸附亲电性的有机物分子,而在原水 pH值范围内,SD呈现的质子状态为中性,导致ZnOOH对SD的吸附能力很弱.
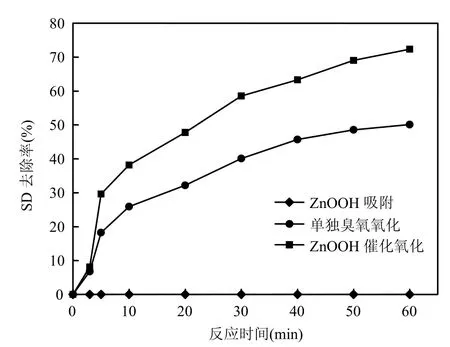
图2 羟基化锌催化臭氧氧化去除蒸馏水水样中的SDFig.2 Catalytic ozonation of SD dissolved in distilled water by ZnOOH
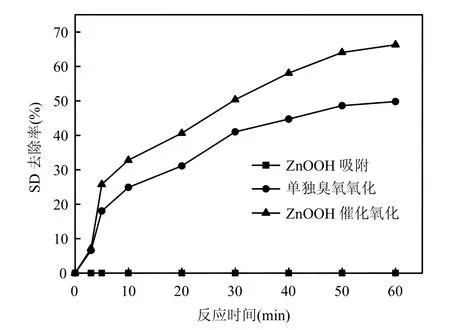
图3 羟基化锌催化臭氧氧化自来水本底中的SD Fig.3 Catalytic ozonation of SD dissolved in tap water by ZnOOH
2.2 ZnOOH催化氧化去除SD的机理
2.2.1 溶液中羟基自由基的氧化 以上结果表明ZnOOH对SD几乎没有吸附作用,而且单独臭氧氧化对目标物的去除率比催化氧化时低很多,因此SD的氧化降解机理是由于臭氧自分解生成羟基自由基(·OH) 的间接氧化作用[11],催化剂的使用加速了这一过程,提高了·OH的生成速率,使SD 的去除率明显增加.为了验证这个推测,考察了自由基抑制剂对催化过程的影响.
叔丁醇是一种非常强的自由基抑制剂,它能与羟基自由基反应生成惰性中间物质,反应常数为(k)5×108L/(mol·s)[12],从而有效地终止臭氧分解自由基的链反应[13].
由图4可以看出,催化剂的加入使SD的去除率大大提高,当水样中加入一定浓度的叔丁醇时,SD的去除受到很明显的抑制,甚至于低于单独臭氧氧化的水平.反应 30min时,臭氧单独氧化对SD的去除率为51.13%,ZnOOH催化臭氧氧化对SD的去除率为98.83%,加入1mg/L的叔丁醇后,催化臭氧氧化对SD的去除率仅为19.73%.同时,加入叔丁醇也使单独臭氧氧化反应受到抑制,对目标物的去除率也大大降低.另外,如图4 所示,无论是单独臭氧氧化还是ZnOOH催化臭氧氧化,加入相同浓度的叔丁醇溶液后,两种工艺降解 SD的能力基本相同,这也证明了叔丁醇通过控制自由基的生成来影响水样中 SD降解的机理.因此,叔丁醇的加入有效抑制了水中羟基自由基的生成和它对SD的去除.从而证明了ZnOOH催化氧化SD的反应过程为羟基自由基反应的机理[7].

图4 叔丁醇对ZnOOH催化臭氧氧化SD的影响Fig.4 Effect of t-BuOH on catalytic ozonation of SD with ZnOOH
2.2.2 催化剂表面羟基的影响 本实验对不同温度下烘干的 ZnOOH催化效能进行了研究,结果如图5所示.由图5可见,催化剂的活性随着烘干温度的升高而下降,该现象与陈忠林等[7]的研究相符.其中在50℃烘干的ZnOOH催化剂活性最高,去除SD的能力最强,100oC和200℃烘干下的催化剂活性稍有降低,但在反应60min时,这3种温度下烘干的催化剂催化氧化去除SD的效率基本相同.在 500℃时催化剂活性明显下降,可能是由于该温度范围内催化剂部分表面羟基缩合失水,导致去除效果降低.800℃烘干的催化剂活性最低,去除效果最差.这是由于催化剂表面结合有大量的羟基[7],在高温烘干时会失去大部分结合羟基,使催化剂表面性质发生改变.上述现象说明 ZnOOH催化臭氧氧化分解生成羟基自由基⋅OH 的过程中,催化剂的结合羟基起着重要的作用,引发一系列的反应[14]:


图5 催化剂制备温度对ZnOOH催化臭氧氧化SD的影响Fig.5 Effect of ZnOOH preparation temperature on catalytic ozonation of SD
这些结合羟基一方面可能来自于催化剂本身结构中的羟基,另一方面,由于金属氧化物和羟基化物表面存在不饱和的金属离子配位键,使得表面形成自由力场,具有一定的吸附力[15],在水中容易形成表面羟基,这些表面羟基的含量直接关系到催化剂的催化活性.以上分析表明,ZnOOH催化臭氧化降解SD反应符合羟基自由基反应机理.同时,催化剂羟基缩合失水可能导致其表面积发生变化,对催化剂的活性也会有所影响.
2.3 影响因素分析
2.3.1 臭氧投加量对SD去除的影响 图6表示固定催化剂投加量,不同臭氧浓度对以蒸馏水为本底时SD的去除效果.由图6可以看出,SD的去除率随着臭氧投加量的增加逐渐增强.反应3min时,投加0.5mg/L臭氧时,SD去除率仅为5.7%;而投加 1.5mg/L臭氧时,去除率已经达到 41.71%,相当于0.5mg/L臭氧反应30min时SD的去除率;在反应30min后去除率达98.83%且趋于稳定.因此后续实验选择1.5mg/L作为臭氧最佳投加量.

图6 臭氧浓度对SD去除率的影响Fig.6 Effect of ozone concentration on SD removal
2.3.2 pH值的影响 图7为不同的pH值条件下,反应30min后臭氧氧化和ZnOOH催化氧化分别对以蒸馏水为本底SD的去除情况.随着pH值的增大,臭氧氧化 SD的去除率逐渐增大,在碱性条件下增大幅度最高.这是由于OH-是O3分解链反应的引发剂,在碱性条件下,·OH生成速率会提高
[16],直接导致了臭氧氧化反应效率的提高.pH值对两种氧化方式的影响规律相同,只是ZnOOH催化氧化在酸性条件下去除率增加更快.在中性pH值附近两种氧化方式去除效果相差最大.考虑到去除效果和仪器的综合因素,最后选择原蒸馏水的pH值,不加以改变.
2.3.3 催化剂投加量的影响 投加不同量的催化剂时,水中SD的去除情况如图8所示,反应前20min内,目标物去除率随着催化剂投加量的增加而迅速提高,之后增加趋于平缓.投加 100,150mg/L催化剂在反应20min后,去除效果基本相同.由图2可知,羟基化锌对SD没有吸附去除,因此可以理解为催化剂投加量增加时,比表面积随之增加,对 O3的吸附量变大,中间性强氧化性物质的产量增多,因而导致表面羟基增加,催化臭氧分解生成·OH的浓度变大,所以 SD 的去除效果与催化剂的投量成正比关系.

图7 pH值对羟基化锌催化氧化磺胺嘧啶的影响Fig.7 Effect of pH on catalytic ozonation of SD with ZnOOH

图8 羟基化锌投加量对SD去除率的影响Fig.8 Effect of ZnOOH dosage on the catalytic ozonation of SD
2.3.4 水体中氯离子的影响 自来水采用氯气消毒时会产生高浓度的 Cl-,排放到水体后会造成自然水体 Cl-的升高,因而本实验考察了 Cl-对SD去除的影响,以蒸馏水为本底,采用原水pH值,如图9,在NaCl投加量为40mg/L的情况下, Cl-的存在对磺胺嘧啶的去除存在部分的抑制作用,20min时去除率下降了近13%.这可能是因为Cl-本身具有还原性,而臭氧具有强的氧化性,由链反应引发的羟基自由基则具有更强的氧化性,于是产生的氯离子消耗了部分氧化剂,进而减弱了SD 的去除率.同时,氯离子也可以吸附在催化剂表面,占据催化活性中心[17-18],从而导致催化剂的活性降低.
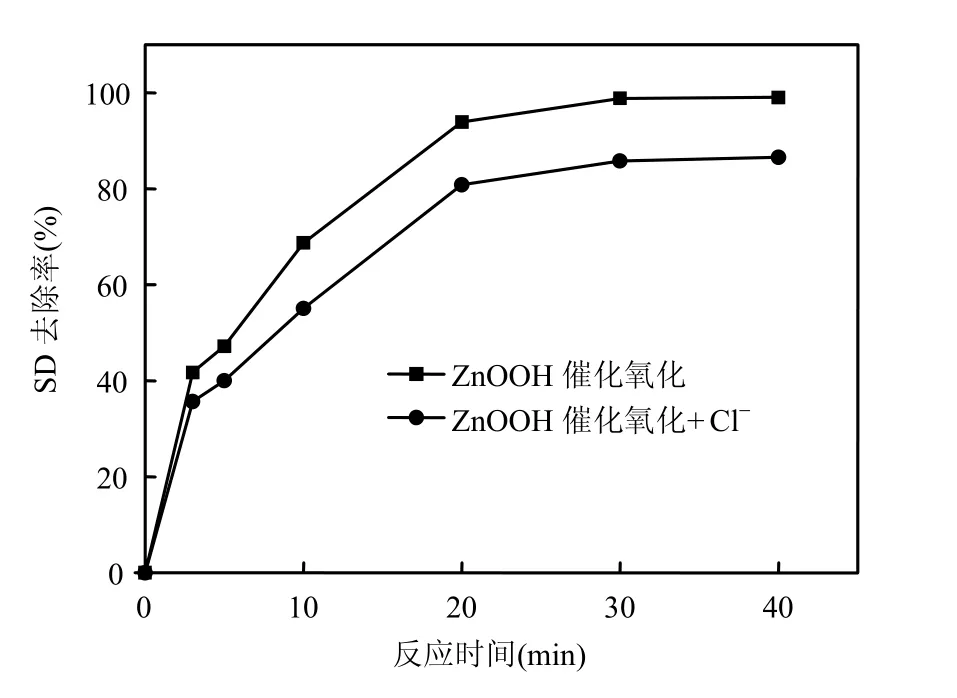
图9 Cl-对ZnOOH催化氧化去除SD的影响Fig.9 Effect of Cl-on catalytic ozonation of SD with ZnOOH
2.3.5 催化剂循环使用次数对催化效果的影响 图10为不同使用次数的催化剂对目标物的去除效果,由图10可知,在前30min内,催化剂多次使用对目标物的去除比第 1次使用时略有降低,但在反应30min时去除效果基本相同,因此催化剂的使用次数对催化能力有一定的影响,但影响不大.重复使用过的催化剂经 XRD分析没有发生结构的变化,反应后的水溶液经原子吸收光谱检测,没有发现锌离子溶出.实验证明 ZnOOH可以用做实际水处理工程的催化剂.
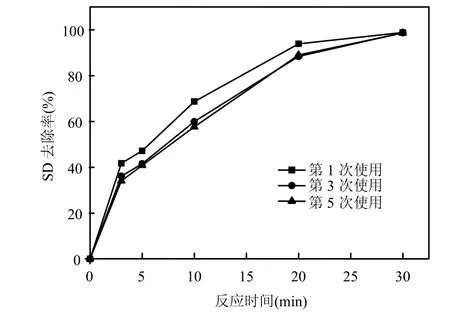
图10 ZnOOH重复使用对去除SD的影响Fig.10 Effect of ZnOOH reuse on the catalytic ozonation of SD
3 结论
3.1 ZnOOH 催化臭氧产生的·OH 和催化剂表面结合的·OH 基团加强了催化剂的活性,使得水中痕量 SD的去除效率显著提高.在本实验条件下,SD的去除率随着臭氧投加量的增加而升高;在中性条件下,催化剂具有较高的催化效率.
3.2 水中Cl-对催化臭氧化去除SD有一定的抑制作用,所以自来水水样中目标物的去除率低于蒸馏水;催化剂的催化效能在偏碱性条件下较好,但在原水pH范围内SD的去除效率也很高,综合考虑各种因素,在试验过程中保持原水 pH值,不加以改变.
3.3 催化剂投加量的增加也会提高 SD的去除效率且可以重复使用.
[1] Sukul P, Lamshöft M, Zühlke S, et al. Sorption and desorption of sulfadiazine in soil and soil-manure systems [J]. Chemosphere,2008,(73)1344-1350.
[2] Sukul P, Spiteller M. Sulfonamides in the Environment as Veterinary Drugs [J]. Reviews of Environmental Contamination and Toxicology, 2006,187,67-101.
[3] Adams C, Wang Y, Loftin K, et al. Removal of antibiotics from surface and distilled water in conventional water treatment processes [J]. Environ. Eng., 2002,128:253-260.
[4] Nakada N, Shinohara H, Murata A, et al. Removal of selected pharmaceuticals and personal care products (PPCPs) and endocrine-disrupting chemicals (EDCs) during sand filtration and ozonation at a municipal sewage treatment plant [J]. Water Research, 2007,41:4373-4382.
[5] Boyd G, Reemtsma H, Grimm D, et al. Pharmaceuticals and personal care products ( PPCPs) in surface and treated waters of Louisiana, USA and Ontario, Canada [J]. Science of the Total Environment, 2003,311:135-149.
[6] 张彭义,余 刚.臭氧/活性炭协同降解有机物的初步研究 [J].中国环境科学, 2000,20(2):159-162.
[7] 陈忠林,徐贞贞,贲 岳,等.ZnOOH/O3催化臭氧化体系去除水中痕量对氯硝基苯 [J]. 环境科学, 2008,28(11):2550-2556.
[8] 张 涛,陈忠林,马 军,等.水合氧化铁催化臭氧氧化去除水中痕量硝基苯 [J]. 环境科学, 2004,25(4):43-47.
[9] 马 军,张涛,陈忠林,等.水中羟基氧化铁催化臭氧分解和氧化痕量硝基苯的机理探讨 [J]. 环境科学, 2005,26(2):78-82.
[10] HoignéJ , Bader H. Characterization of water quality criteria for ozonation processes Part Ⅱ : Life time of added ozone [J]. Ozone:Science and Engineering, 1994,16(2):113-120.
[11] Wu J N, Rudy K, Spark J. Oxidation of aqueous phenol by ozone and peroxides [J]. Advances in Environment Research, 2000,4(4):339-346.
[12] 蔡国庆.臭氧催化氧化去除水中高稳定性有机污染物的研究[D]. 哈尔滨:哈尔滨工业大学, 2001.
[13] AWWA Research Foundation and Compagie Générale des Eaux Foundmental Aspects. Ozone in water treatment : application and engineering [M]. Michigan, USA: Lewis Publisher, 1991:18-19.[14] Kasprzyk-Hordern B, Zilek M, Nawrocki J. Catalytic ozonation and methods of enhancing molecular ozone reactions in water treatment [J]. Applied Catalysis B: Environmental, 2003,46(4):639-669.
[15] Elizarova G L, Zhidomirov G M, Parmon V N. Hydroxides of transition metals as artificial catalysts for oxidation of water to dioxygen [J]. Catalysis Today, 2000,58(2):71-88.
[16] 陈万义,赵忠华,薛振祥,等.农药生产与合成 [M]. 北京:化学工业出版社, 2000.
[17] Sunada F, Heller A. Effects of water, salt, and silicone overcoating of the TiO2photocatalyst on the rates and products of photocatalytic oxidation of liquid 3-octanol and 3-octanone [J].Environmental Science and Technology, 1998,32(2):282-286.
[18] Conceicao M, Mateus D A. Kinetics of photodegradation of the fungicide fenarimol in natural waters and in various salt solutions:salinity effects and mechanistic considerations [J]. Water Research, 2000,34(4):1119-1126.
致谢:感谢东华大学分析测试中心对实验的大力支持和帮助.
Catalytic ozonation of trace sulfadiazine in water by ZnOOH.
ZHOU Ning-juan, XUE Gang*, BU Dan, LIU Ya-nan (School of Environmental Science and Engineering, Donghua University, Shanghai 201620, China). China Environmental Science, 2011,31(2):233~238
ZnOOH prepared in laboratory was used as a catalyst in the ozonation of trace sulfadiazine (SD) in water. The catalytic mechanism was deduced base on the effect of radical inhibitor t-BuOH on the reaction. The influences of O3dose,water quality parameters (pH, chloride anion concentration), catalyst dose and catalyst reuse on the SD removal were also examined. ZnOOH had excellent catalytic activity in SD ozonation. The hydroxyl groups combined on the catalyst surfaces played a part in the catalytic reactions. The removal of SD dissolved in distilled water increased by 47.7% at reaction time of 30min in ozonation with zinc hydroxide compared to the ozonation without catalyst under optimal conditions. The catalytic reaction process followed a hydroxyl radical reaction mechanism and the SD removal improved with increasing dosage of catalyst. ZnOOH can be reused for several times without obvious reduction of catalytic activity and Cl-in water could greatly decrease the catalytic activity of ZnOOH. The optimal catalytic activity of ZnOOH achieved at weak basic solution.
zinc hydroxide;catalytic ozonation;sulfadiazine;hydroxyl radical
X703.1
A
1000-6923(2011)02-0233-06
2010-06-18
教育部新世纪优秀人才计划(NECT-07-0175);上海市基础研究重点项目(08JC1400500);上海市自然科学基金(10ZR1401100);教育部博士点基金新教师项目(200802551001)
∗ 责任作者, 教授, xuegang@dhu.edu.cn
周宁娟(1985-),女,河南省鹤壁市人,东华大学环境科学与工程学院硕士研究生,主要从事水污染控制研究.发表论文2篇.

