Fe(Ⅵ)的特性分析及在水处理中的应用
阚连宝,段庆茹,王宝辉,陈 平
(1东北石油大学土木建筑工程学院,黑龙江 大庆 163318;2东北石油大学石油经济与管理研究所,黑龙江 大庆 163318;3东北石油大学化学化工学院,黑龙江 大庆 163318)
进展与述评
Fe(Ⅵ)的特性分析及在水处理中的应用
阚连宝1,段庆茹2,王宝辉3,陈 平1
(1东北石油大学土木建筑工程学院,黑龙江 大庆 163318;2东北石油大学石油经济与管理研究所,黑龙江 大庆 163318;3东北石油大学化学化工学院,黑龙江 大庆 163318)
高铁酸盐是一种新型的水处理药剂。本文从结构化学、电化学、热分解特性及稳定性的角度,系统分析了高铁酸盐的物化特性,阐述了高铁酸盐制备方法,综述了高铁酸盐在水处理方面的应用。以Fe(Ⅵ)预氧化水源水工艺为例,介绍了高铁酸盐的具体应用,结果表明,1.0 mg/ L的高铁酸盐预氧化即可显著提高混凝效果,沉后水和滤后水浊度去除率分别达到 98.58%、99.94%,水中色度、UV254等有机物综合指标均呈明显下降趋势,与此同时,水中锰、铁浓度也显著降低。另外,高铁酸盐预氧化可有效地去除水中细菌和大肠菌群。最后,还根据高铁酸盐工程应用实际情况,提出了工程应用的建议。
Fe(Ⅵ);特性;水处理
高铁酸盐是一类新型高效多功能水处理剂,是氯类杀菌剂的理想替代品。高铁酸盐的开发和利用正日益显示出其广阔的应用前景。采用X射线光电子能谱(XPS)、红外光谱(IR)、拉曼光谱(Raman)、X射线衍射(XRD)、差热分析(DTA)、程序升温反应(TPR)、穆斯堡尔谱(Mössbauer)、18O同位素示踪等对Fe(Ⅵ)化合物固体结构、液相离子构型、光、电、磁、热电导、电化学、分析方法、分解动力学等方面的性质进行了分析研究,这对推广其应用大有用途。
1 Fe(Ⅵ)化合物的理化特性
1.1 Fe(Ⅵ)化合物的结构化学特性
FeO42-的晶相具有正四面体结构,在晶体中,FeO42-呈略有畸变扭曲的四面体结构,Fe原子位于四面体的中心,4个O原子位于4个顶角上[1-2]。葛善海等[3]通过同位素18O与K2FeO4水溶液中的氧交换示踪实验,由质谱分析发现FeO42-离子中的4个氧原子完全等价,并据此认为FeO42-在水溶液中呈理想的Td对称。在水溶液中,这4个氧缓慢地与水分子中的氧原子进行交换。现已制备出的MAFeO4与 M2AFeO4型的 Fe(Ⅵ)化合物。冯长春等[4]用Mössbauer 谱、XPS、IR,结合群论推算,认为固态K2FeO4中的FeO42-离子呈现畸变的四面体结构。如图1所示,该图是优化得到的K2FeO4中FeO42-的最低能量构型图。
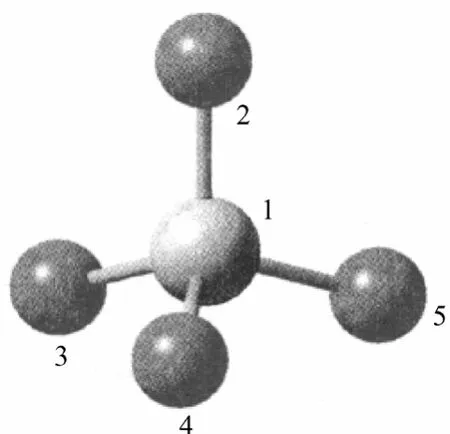
图1 FeO的结构示意图
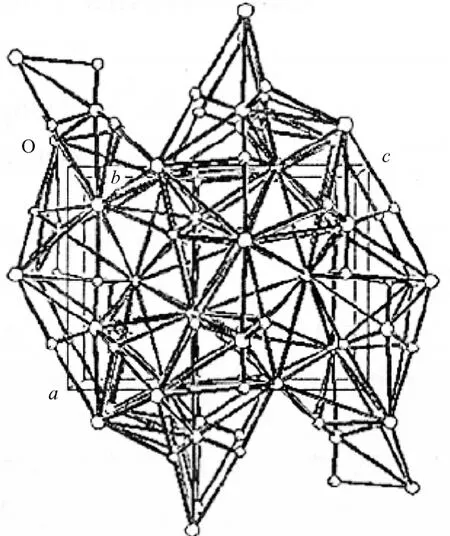
图2 K2FeO4晶胞结构图
由图2可知,四面体的6个键角也有不同程度的差别。由此可见,该四面体构型有轻微的畸变。此结论证实了冯长春等[4]用群论推算出的固态K2FeO4中离子呈现畸变的四面体结构的推断。
1.2 Fe(Ⅵ)化合物的电化学特性
1958年,Wood等[5]通过测定高铁酸钾与高氯酸在298 K下的反应热,得到了一些相关的热力学数据,进而计算出Fe(Ⅵ)/Fe(Ⅲ)电对在酸性和碱性条件下的标准电极电位分别为+2.20 V、+0.72 V。可见其具有较高的标准电极电势可制造高能高铁电池[6]。
在酸性介质中,其还原方式为

纳米级高铁酸盐作为电池的正极材料,可制造储能密度大、体积小、质量轻、寿命长、高电压、高容量的新型无污染化学电源。纳米高铁酸钾电池比功率及放电电流均是普通电池的3~10倍。
1.3 Fe(Ⅵ)化合物的热分解特性
Fe(Ⅵ)高温下分解,对高铁酸钾的热分析研究表明,Fe(Ⅵ)分解为Fe(Ⅲ)过程中有Fe(Ⅳ)和Fe(Ⅴ)的形成。Scholder等曾报道高铁酸钾的分解方程式为(700 ℃以下与700 ℃以上)

但高铁酸钾热分解过程中的穆斯堡尔谱[7]却否认了有五价铁中间分解产物的观点。丛文博等[8]应用Mössbauer、DTA、IR和XRD等多种分析方法相结合,证明了文献上记载的50 ℃开始热分解反应的只是脱吸附水,在干燥空气中的分解到230 ℃方才开始。高铁酸钾按下式分解

1.4 Fe(Ⅵ)化合物的稳定性
K2FeO4为暗红色有光泽的粉末状晶体。图3是K2FeO4的形貌图。从图中可以看出,K2FeO4颗粒比较大,其晶体呈板状,且表面较为光滑。
高铁酸钾在水溶液中极易溶,而在非水溶液中不溶。在含有Ba(OH)2的KOH电解质中可以获得低溶解度的 K2FeO4,且其溶解度均随着 Ba(OH)2浓度的增大而减小;在高浓度的氢氧化物如 KOH和CsOH中,K2FeO4的溶解度很小;但K2FeO4在LiOH、NaOH中有相对较高的溶解度[9]。

图3 K2FeO4晶体的SEM形貌图
高铁酸钾具有很高的化学稳定性。在 71 ℃干燥保存一个月并未测出明显的分解;在150 ℃干燥保存,30 min内并不分解;只有在400 ℃敞口保存,用 FTIR观察 K2FeO4在 30 min内才完全分解为Fe(Ⅲ)[10]。
但在酸性或中性溶液中,高铁酸根离子能迅速被水还原成三价铁的化合物,同时释放出氧气[11]。
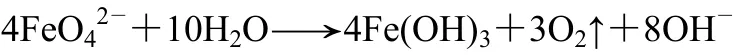
高铁酸根离子在碱介质中也表现出不稳定性,按以下3种形式发生分解:①当pH值较低时,高铁酸盐在水溶液中自发分解,分解产物主要是三价铁离子和氧气;②在碱性介质中,高铁酸盐也能发生自身分解,生成氢氧化铁并放出氧气;③当高铁酸盐与水中某些还原性物质发生反应时,生成三价铁或其氢氧化物。
根据该反应中各物质的热力学函数,经简单计算可得如下反应[13]。

再由吉布斯方程ΔG=ΔH-TΔS,可见任意温度下总有ΔG<0。即:FeO42-具有明显的热力学不稳定性,但在动力学上是可以改善其不稳定性的。

图4 Fe(Ⅵ)形态的氧化还原分解机理[12]
高铁酸盐的分解机理如下[14]。

在不同碱溶液中的分解速率方程和速率常数如表1所示。
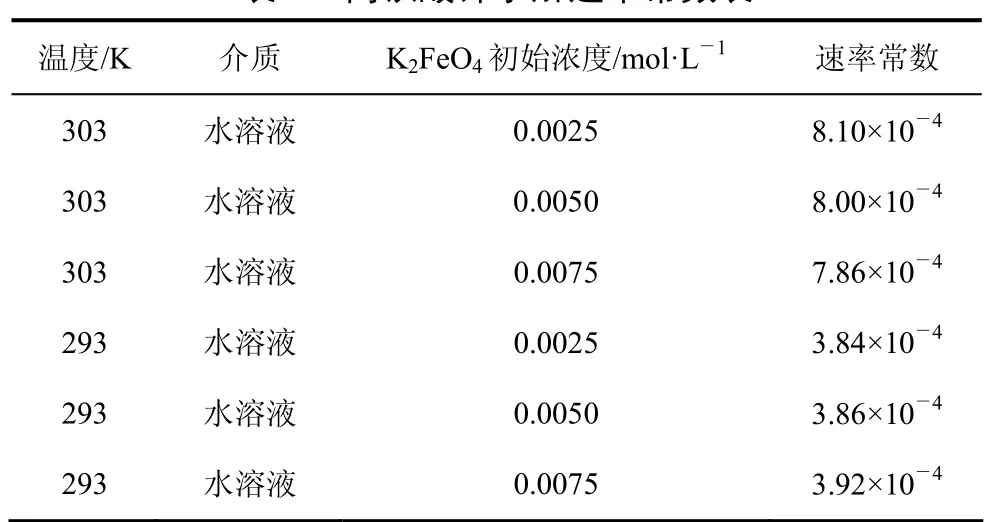
表1 高铁酸钾水解速率常数表
2 Fe(Ⅵ)的制备方法
高铁酸钾的制备方法主要有次氯酸盐氧化法、电解氧化法和过氧化物氧化法[15]。次氯酸盐氧化法是将Cl2通入KOH溶液,生成KClO作为强氧化剂将 Fe3+在碱性条件下氧化为 FeO42-与 K+共沉析出K2FeO4晶体。电解氧化法是电解液采用14 mol/L到16 mol/L的氢氧化钾溶液,阳极采用比表面积较大的铁丝网电极,阴极采用石墨电极,电源采用直流稳压电源,槽电压3~7 V,表观电流密度80 mA/cm2,电解槽采用有PVC隔膜的电解槽,电解8 h左右,阳极室即可得高铁酸钾溶液。过氧化物氧化法是采用金属的过氧化物氧化铁盐或铁的氧化物制备K2FeO4,如Na2O2/FeSO4体系,其过程是将 Na2O2、FeSO4在密闭、干燥的环境中混合,加热到700 ℃反应1 h,得到含Na2FeO4的粉末,过氧化物氧化法的产品纯度和收率较高,但反应需要高温、干燥的环境。
3 高铁酸盐在水处理中的应用
3.1 用于生活饮用水的杀菌灭藻
1974年Murmann与Robinson首次发现高铁酸钾具有明显的灭菌作用。投加6 mg/L的高铁酸钾处理30 min,可将原水中20~30万个/mL细菌去除至小于100个/mL,达到生活饮用水标准。后来的研究表明[16],高铁酸钾对大肠杆菌(E.coli)也有良好的灭活作用,其灭活率随pH值降低而升高。用高铁酸钾氧化二级处理厂出水发现,接触时间和高铁酸钾浓度对灭活f2病毒有重要影响[17],影响程度随pH值变化,并且高铁酸钾的灭活效率优于HClO和ClO-。高铁酸钾对 Qβ噬菌体的灭活作用受到高铁酸钾浓度和接触时间的影响,并且高铁酸钾退色后仍有灭活作用,说明高铁酸钾分解后生成的中间价态氧化成分具有长时间氧化效应。研究发现,带正电的微生物对高铁酸钾的抵抗作用强于带负电微生物[18];f2病毒对高铁酸钾的抵抗性等于或略低于大肠杆菌的抵抗性。
高铁酸钾的杀菌效率可以通过与其它氧化剂联合使用得到提高。试验证明,投加2 mg/L的臭氧可以杀死水中 99%的肠型菌素,但如果用 5 mg/L高铁酸钾进行预处理,1 mg/L的臭氧就可以杀死肠菌总数的99.9%。5 mg/L的高铁酸钾足以使二级水处理废水中的肠菌总数降至2.2 MPN/400 mL的水平。
高铁酸钾的杀菌能力可以描述为[19]
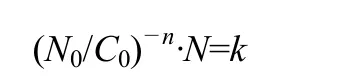
式中,C0为高铁酸根浓度;N0、N分别为试验开始时和试验中的细菌数,个/mL;n、k为常数,对大肠杆菌n=1.89,k=4×10-10。
高铁酸盐可以有效杀死藻类,尤其对杀灭水华蓝绿藻效果很好,对其它藻类也能大部分杀灭[20]。用自制的高铁复合药剂处理夏季水华地表水,除藻效率可以达70%~90%,药剂投加量少,见效快,无残留毒性,对饮用水的安全无威胁。杀藻机理为药剂与藻类充分接触并伴以剧烈的机械搅拌,破坏细胞壁、细胞膜,进入细胞体内,由表及里导致死亡。
3.2 氧化去除有机污染物
高铁酸钾可以选择性的去除水中的许多有机物。研究表明,高铁酸钾在氧化50%醇类的同时能够有效降低水中联苯、氯苯等难降解有机物浓度。高铁酸盐可以有效去除饮用水中优先有机物。在20 NTU的浑浊水样中,30 mg/L高铁氧化40 min,可以将水中0.1 mg/L的三氯乙烯全部去除,也可将其中100%的萘、84.4%的溴二氯甲烷、61%的二氯苯和12.8%的硝基苯除去,但氧化产物还不清楚,这说明高铁酸盐的氧化与絮凝的协同作用对水中优先有机污染物的去处是十分有效的。
高铁酸盐作为氧化剂用于放射处理也具有明显的效果。如按摩尔比1∶1投加K2FeO4可以将废水中的BHP氧化为羧基形态;过量K2FeO4则将废水中BHP完全降解为CO2。可将高铁酸盐作为一中强氧化剂,对选择性地去除水与废水中的药剂污染物具有重要的应用价值。
3.3 高铁酸盐的絮凝、吸附沉降与除臭作用
高铁酸盐降解得到的五价铁盐、四价铁盐等水解中间产物可能比铝盐、二价铁盐、三价铁盐形成的水解产物具有更强的脱稳能力和网捕功能。更多不同水解形态的形成意味着高铁在降低胶体颗粒物的ζ电位方面比其它无机絮凝剂具有更高的效率。多种水解产物经历聚合作用后,产物都是氢氧化铁。
实验表明[21],适量投加K2FeO4,能够将一般地表水中99%的可沉淀悬浮物和94%的浊度除去,这比同样条件三价铁盐的絮凝效果好得多。当加入高铁酸盐的浓度为8 mg/L时,二级废水中大约86%的固体悬浮物可被去除。而且只要K2FeO4投量大于6 mg/L,则悬浮物的去除率均大于80%。用 K2FeO4处理废水中放射性核素的烧杯试验表明,K2FeO4对废水中的镅和钚均有明显的去除作用[22]。
高铁酸盐的分解产物Fe(OH)3是一种优良吸附剂,Murmann等用 K2FeO4吸附沉降去除水中金属离子取得良好效果。且铁残留量很低,通常小于20 µg/L。
高铁酸盐对含硫臭味的水有特殊的除臭作用,用2~5 mg/L的K2FeO4就能将湖水中典型的硫臭味很快地完全去除,其效果优于活性炭吸附。
高铁酸盐能迅速将生物污泥中产生的恶臭物质控制到可接受的程度,有效地去除生物污泥中的H2S、CH3SH和 NH3等恶臭物质,将NH3氧化成NO3-,将H2S、CH3SH氧化成SO42-,处理后的污泥可以用做化学肥料和土壤调节剂,有利于废物资源化[23]。
3.4 高铁酸盐的多功能协同作用
高铁酸盐是具有绿色、环保、友好的水处理药剂[24],使用高铁酸盐净水是一个氧化、絮凝、吸附、消毒等[25]协同作用并连续发生的过程,这也是高铁酸盐相对其他水处理药剂的优势所在。如果原水用5 mg/L的K2FeO4处理、沉淀或过滤后,会产生如下变化或处理结果:①溶液的 pH值略有上升,因此可使一些痕量金属粒子沉降下来;②产生臭味的H2S和某些有机物被去除;③铁的配合物或二价铁被降低到0.02 mg/L以下;④BOD浓度降低,水中含氧量稍有增加;⑤痕量金属如Cd2+、Zn2+、Cu2+、Hg2+等将被吸附共沉淀一部分;⑥绝大部分细菌将被杀死;⑦绝大部分病毒将失去活性。
4 Fe(Ⅵ)预氧化工艺具体应用实例
4.1 水源情况
以地表水为原水的给水处理厂位于东北地区,其水源的补给由附近的河水提供。该水源地水中含有大量的天然有机物,另外,补给的河水受到工业废水的严重污染,尤其在夏季,河水的大量流入使水源地污染加重。某一期间原水平均水质如表 2所示。
4.2 工艺流程与处理效果
首先将高铁酸盐水处理药剂(或其复合药剂)配制一定浓度的工作液,然后通过投加设备定量地投加于取水口、混合池、原水输送管道等。高铁酸盐预氧化不需要增加大型设备,不需改变现有的常规处理工艺流程。采用常规混凝沉淀工艺处理,在水质恶化期,如色度升高,嗅、味严重,出厂水水质不能得到保证。在混凝剂投加之前投加高铁酸盐,经过混合反应后,可以使色度降低至国家水质标准要求之下,嗅、味完全去除。
高铁酸盐(或其复合药剂)预氧化处理具有氧化、吸附、共沉、消毒、杀菌、除藻等多功能的净水效能。相对常规混凝处理,水中有机污染物和重金属的去除率提高50% 左右;除藻效率提高1倍。工艺设备流程见图 5;实践证明高铁酸盐投量为 1 mg/L、硫酸铝投量为 70 mg/L时处理效果较好。经高铁酸盐预氧化混凝后水质的变化见表3。
利用高铁酸钾对水源水进行预氧化后加入混凝剂硫酸铝混凝沉淀,发现高铁酸钾预氧化可以强化混凝效果,该过程形成的絮体大小比单独铝盐混凝形成的絮体大,进而提高絮体沉淀性能。对于高有机污染地表水,强化混凝效果更佳。同时,对于低温低浊水,高铁预氧化也可以有效地降低其浊度。用高铁酸钾进行预氧化,也可有效提高藻类的去除率。通过中试证明单独投加硫酸铝时,去除藻类效果不理想。当投加少量高铁酸钾进行预氧化后,再经硫酸铝混凝,对藻类去除率可达97.85%,比单独硫酸铝混凝除藻去除率提高10%~20%,水中藻类总量下降2 个数量级[26]。该过程中高铁酸钾发挥其氧化杀藻能力,在一定程度上抑制藻类的萌发和生长的同时,也由于生成Fe(OH)3等絮凝剂增加了藻类的去除。
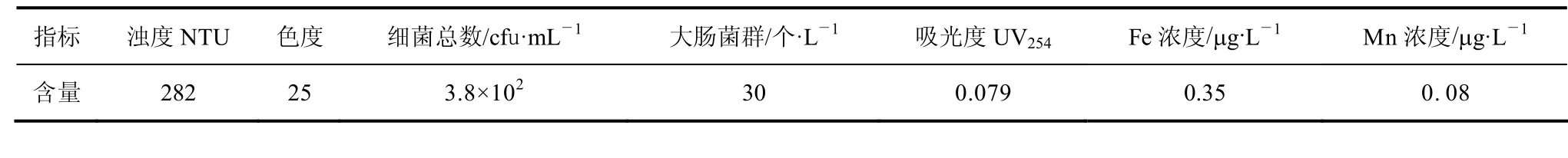
表2 原水典型水质

图5 工艺设备流程图
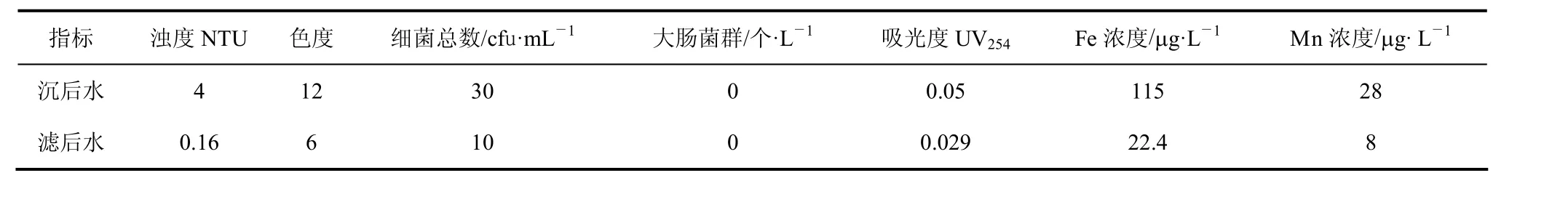
表3 高铁酸盐预氧化处理后水质指标
4.3 高铁酸盐水处理工程应用中的建议
针对高铁酸盐在工程应用存在问题,对其投加方式进行改进。其中一种方法是,先将高铁酸盐溶解在pH=11.5的碱性溶液中(在碱性溶液中高铁酸盐是较稳定的),然后用高压的水枪或压缩空气将溶液喷压到水体里。这种方式的目的就是要让高铁酸根快速扩散,增加和细菌、病毒、污染物的接触机会,但处理仍然达不到预期的效果,推测原因可能是高铁酸根即将扩散时就基本上与水分子反应掉了。另一种方法是,将高铁酸盐制成细小颗粒,颗粒外面裹包着一层薄薄的在水里可慢慢溶解的胶膜。由于胶膜的保护作用,加到水里的高铁酸盐颗粒不会立即和水起反应,使得高铁酸盐有充足的时间扩散到整个水体和水中的细菌、病毒及有机污染物充分地接触,从而大幅度地提高水消毒和水处理的效果。不过,这种方法成本高,很难在市场竞争中得到广泛的推广。 因此,寻找一种高效经济又实用的方法,让高铁酸盐在水里扩散分布过程中不丧失或少丧失其氧化能力,让其有更多的机会和细菌、病毒、污染物接触,正是一些从事高铁酸盐应用开发研究者努力追求的目标。
5 结 语
因此,高铁酸盐是一种对人类和生物安全、对环境无二次污染的理想绿色高效的水处理剂。高铁酸盐处理后的水源水,其浊度和细菌学指标等均能满足国家生活饮用水水质标准。
[1]Golf H,Murmann R K. Studies on the mechanism of isotopic oxygen exchange and reduction of ferrate(Ⅵ)ion(FeO42-)[J].AmericanChemical Society,1971,93(23):6058-6065.
[2]Hoppe M L,Schlemper E O,Murmann R K. Structure of dipotassium ferrate(Ⅵ)[J].Acta. Cryst.,1982,38:2237-2239.
[3]葛善海,衣宝廉,张华民,等.质子交换膜燃料电池模型研究进展[J]. 电化学,2002(4):71-73.
[4]冯长春,周志浩,蒋凤生,等.高铁酸钾的结构研究[J]. 化学世界,1991(3):102-105.
[5]Wood R H. The heat free energy and entropy of the ferrate(Ⅵ)ion[J].American Chemical Society,1958,80:2038-2041.
[6]Licht S,Wang Baohui,Ghosh S. Energetic Iron(Ⅵ)Chemistry:The super iron battery[J].Science,1999,285(13):1039-1042.
[7]Rush J D. Pulse Radiolysis studies of alkaline Fe(Ⅲ) and Fe(Ⅵ) solutions. Observation of transient iron complexes with intermediate oxidation states[J].American Chemical Society,1986,l08(8):523-525.
[8]丛文博,张宝宏,杨红.新型电极材料高铁酸盐的合成研究[J]. 应用科技,2002,29(3):56-58.
[9]Licht S,Vera N,Ghosh S,et al. SrFeO4:Synthesis,Fe(Ⅵ) characterization and the strontium super-iron battery[J].Electrochemistry Communications,2001,3(7):340-345.
[10]Licht S,Vera N,Wang Baohui. Rapid chemical synthesis of the barium ferrate super-iron Fe(Ⅵ) compound,BaFeO4[J].Power Sources,2002,109(1):67-70.
[11]杨卫华,王建明,张鉴清.几种Fe(Ⅵ)化合物的物理性质、电化学性能及稳定性研究[J]. 物理化学学报,2005(1):3-4.
[12]曲久辉.高铁酸盐的多功能水处理效果及应用展望[J].中国给水排水,1997,13(3):21-23.
[13]贾汉东,马宁,孙红宾,等.FeO42-离子在水溶液中稳定性的研究[J].郑州大学学报:自然科学版,1999,31(1):66-69.
[14]Ernst T,Wawrzenczyk M,Cyfert M,et al. Effect of pH on the kinetics of ferrate(Ⅵ)decomposition[J].Bull Acad. Poc. Sci. Ser. Chim,1979,17(10):773-778.
[15]夏庆余,方熠,吴挡兰,等. 绿色氧化剂高铁酸盐的制备与应用[J].化工进展,2005,24(3):245-249.
[16]Waite T D . Feasibility of waste water treatment with ferrate [J].Environ. Eng.—ASCE,1979,105:1023-1034.
[17]Schink T,Waite T D. Inactivation of f2virus with ferrate(Ⅵ)[J].Water Research,1980,14(4):1705-1717.
[18]吴耀国,姜向春,吉青杰.无机盐高铁酸钾在水处理中的应用[J].无机盐工业,2005,37(10):49-51.
[19]Kazama F.Inactivation of coliphage Qβby potasium ferrate[J].FEMS Microbiol. Lett.,1994,118:345-350.
[20]田宝珍,曲久辉,雷鹏举.饮用水水源的化学灭藻[J].环境化学,2001,20(1):65-68.
[21] DeLuca S J,Cantelli M,DeLuca M A. Ferrate versus traditionalcoagulants in the treatment of combined industrial wastes[J]. WaterSci. Technol.,1992,26:2077-2080.
[22] White D A,Franklin G S. A preliminary investigation into the use ofsodium ferrate in water treatment [J]. Environ. Technol.,1998,19:1157-1160.
[23] Sharma Virender K,Bloom John T,Joshi Vishwas N. Oxidation ofammonia by ferrate(Ⅵ)[J]. Environ. Sci.,1998 ,33(4):635.
[24] Sharma Virender K.Application of ferrate(Ⅵ)in the treatment ofindustrial wastes containing metal-complexed cyanides:A greentreatment[J]. Journal of Environmental Sciences , 2009 , 12 :1347-1352.
[25] Sharma Virender K.Potassium ferrate(Ⅵ):An environmentlyfriendly oxidant[J].Advances in Environmental Research,2002,2:143-156.
[26] Ma Jun,Liu Wei. Effectiveness of ferrate(Ⅵ)preoxidation innhancing the coagulation of surface water[J]. Water Research,2002,36:4959-4962.
[5]Hála E,Boublik T. Correlation of equilibrium data in three- and more
[21]DeLuca S J,Cantelli M,DeLuca M A. Ferrate versus traditional coagulants in the treatment of combined industrial wastes[J].Water Sci. Technol.,1992,26:2077-2080.
[22]White D A,Franklin G S. A preliminary investigation into the use of sodium ferrate in water treatment [J].Environ. Technol.,1998,19:1157-1160.
[23]Sharma Virender K,Bloom John T,Joshi Vishwas N. Oxidation of ammonia by ferrate(Ⅵ)[J].Environ. Sci.,1998 ,33(4):635.
[24]Sharma Virender K.Application of ferrate(Ⅵ)in the treatment of industrial wastes containing metal-complexed cyanides:A green treatment[J].Journal of Environmental Sciences,2009,12:1347-1352.
[25]Sharma Virender K.Potassium ferrate(Ⅵ):An environmently friendly oxidant[J].Advances in Environmental Research,2002,2:143-156.
[26]Ma Jun,Liu Wei. Effectiveness of ferrate(Ⅵ)preoxidation in nhancing the coagulation of surface water[J].Water Research,2002,36:4959-4962.
Analysis of Fe(Ⅵ) characteristics and its application to water treatment
KAN Lianbao1,DUAN Qingru2,WANG Baohui3,CHEN Ping1
(1College of Civil and Architecture Engineering,Northeast Petroleum University,Daqing 163318,Heilongjiang,China;2Petroleum Economics and Management Instilute,Northeast Petroleum University,Daqing163318,Heilongjiang,China;3College of Chemistry & Chemical Engineering,Northeast Petroleum University,Daqing 163318,Heilongjiang,China)
Ferrate(Fe(Ⅵ))is a new type of water treatment chemicals. From the point of view of structural chemistry,electrochemistry,thermal decomposition characteristics and stability,the physical and chemical characteristics of Fe(Ⅵ) were analyzed,and the preparation of ferrate was described. Its application to water treatment was summarized,such as pre-oxidation by ferrate,and the specific applications were outlined. The results showed that 1.0 mg / L ferrate pre-oxidation could significantly improve the effect on coagulation,Water after sedimentation and filtration turbidity removal rate reached 98.58% and 99.9% respectively. Water colority,UV254and other organic composite indicator were significantly decreased. At the same time,manganese and iron were also significantly reduced. In addition,ferrate pre-oxidation could effectively remove bacteria and E.coli. Finally,according to the practical situation,the paper offers advice on engineering application of ferrate.
Fe(Ⅵ);characteristics;water treatment
TQ 031.7;X 703.1
A
1000-6613(2011)08-1848-07
2010-12-31;修改稿日期2011-02-14。
黑龙江省教育厅科学技术研究项目(11551021)。
及联系人:阚连宝(1979—),男,讲师,硕士,现从事水资源保护、水处理及水质微污染控制等领域的教学和研究工作。E-mail kanlianbao2008@163.com。

