β-月桂烯在有机反应中的应用研究进展
连建伟,夏建陵,2,黄 坤,杨小华,汪 梅
(1中国林业科学研究院林产化学工业研究所;生物质化学利用国家工程实验室;国家林业局林产化学工程重点
开放性实验室;江苏省生物质能源与材料重点实验室,江苏 南京 210042;2中国林业科学研究院林业新技术研究所,北京 100091)
进展与述评
β-月桂烯在有机反应中的应用研究进展
连建伟1,夏建陵1,2,黄 坤1,杨小华1,汪 梅1
(1中国林业科学研究院林产化学工业研究所;生物质化学利用国家工程实验室;国家林业局林产化学工程重点
开放性实验室;江苏省生物质能源与材料重点实验室,江苏 南京 210042;2中国林业科学研究院林业新技术研究所,北京 100091)
β-月桂烯是一种化学性质活泼的天然产物。本文综述了β-月桂烯在各种有机反应中的研究进展,回顾了β-月桂烯在还原反应、氧化反应和其它反应中的应用。重点介绍了其在Diels-Alder反应中的研究现状,包括了β-月桂烯与丙烯醛、丙烯酸甲酯和马来酸酐等亲二烯体的Diels-Alder反应,分析了不同亲二烯体与β-月桂烯反应的难易。最后,展望了β-月桂烯的应用研究方向。
β-月桂烯;Diels-Alder反应;还原反应;氧化反应
我国松脂资源丰富,特别是两广和云南地区,其中双江地区云南松脂中含有高达30.3%的β-蒎烯[1]。工业上β-蒎烯经热异构化可以制备纯度约为 80%的β-月桂烯,精馏后可将纯度提升至99%。β-月桂烯也存在于多种天然精油中,但含量较低。
β-月桂烯也称香叶烯,化学名称是 7-甲基- 3-亚甲基-1,6-辛二烯。分子中具有3个不饱和的碳碳双键,易于发生多种化学反应,如Diels-Alder反应、还原反应和氧化反应等。
1 β-月桂烯在Diels-Alder反应中的应用
β-月桂烯中含有顺式的共轭双烯结构,可以与亲二烯体(如丙烯醛、丙烯腈和丙烯酸甲酯等),发生Diels-Alder反应,反应后的产物可以作为香料直接使用或者作为化工中间体来使用。其中,合成香料研究较多也较为成熟的是用月桂烯来合成柑菁醛、柑菁酸甲酯和龙涎酮等。
1.1 β-月桂烯与丙烯醛的Diels-Alder反应
β-月桂烯与丙烯醛的 Diels-Alder反应式(1)可以得到两种异构体,它们分别是对位和间位柑菁醛,其中对位柑菁醛不仅具有更加优异的性能,而且用途广泛,所以,人们不断研究开发各种方法以提高对位产物的比例。湖南师范大学银董红等以ZnCl2为催化剂[2]分别研究了微波固相法制备催化剂[3]、离子液体辅助催化[4]、ZnCl2负载在NaY分子筛[5]和MCM-41沸石[6-7]上等方法对提高对位柑菁醛的影响,所得产物中对位/间位柑菁醛的比例达到 93/7;其中,微波固相法制备的ZnCl2/MCM-41催化剂不仅制备过程简单而且该催化剂活性和选择性都较为优异,ZnCl2离子液体构成的催化剂可以多次重复使用且催化活性和选择性基本保持不变。

1.2 β-月桂烯与丙烯酸甲酯的Diels-Alder反应
Veselovsky等[8]研究了β-月桂烯与丙烯酸甲酯的Diels-Alder反应,在常温下反应得到了73%的对位柑菁酸甲酯。Yin等[2]采用AlCl3做催化剂使该反应的对位选择性(p/m)提高到了12.4,柑菁酸甲酯的产率最高达 93.1%,但是该方法要求绝对无水,操作条件较为苛刻。Oskooie[9]以硅胶为催化剂,在微波辐射下对该反应进行了研究,但是其得到的对位柑菁酸甲酯的比例却不尽如人意。
1.3 β-月桂烯与马来酸酐的Diels-Alder反应
Goldblatt等[10]将β-月桂烯精馏后与马来酸酐等摩尔进行Diels-Alder反应,收集190~195 ℃/1.067 kPa(绝压)下馏分,得到了沸点为33~34 ℃的具有木香香气的加成物4-(4-甲基-3-戊烯基)-4-环己烯-1,2-酸酐。罗金岳等[11]制备了 SO42-/TiO2-ZrO2固体超强酸并将其催化该反应。陆占国等[12]发现该反应加氢产物有很高的焊接活性,可应用于电子领域里的焊接。另外,酸酐的化学性质非常活泼,可以直接作为工业品应用于生产生活,如固化剂,也可以用做有机合成的中间体,但是他们却都没有对该加成物在工业中的应用加以研究。
1.4 β-月桂烯的Diels-Alder反应在全合成中的应用
1.4.1 合成龙涎酮
龙涎酮具有强烈的龙涎香和木香香气,被广泛应用于各种洗涤剂和香水中[13]。John等[14]利用β-月桂烯合成了龙涎酮,合成路线如反应式(2)所示。夏建陵等[15]对该合成路线进行了改良研究,通过实验确定了适宜的工艺条件,利用自制催化剂Cat-Ⅱ代替了条件苛刻的 AlCl3催化剂,针对环化反应制备了催化剂Cat-Ⅲ,为工业化生产龙涎酮提供了有力的指导。

1.4.2 合成[(1R,6R)-4-(4-甲基-3-戊烯基)-6-苯基-3-环己烯]-苯甲酮
Corbett等[16]以苯乙酮和苯甲醛为原料经醛酮缩合反应[17]合成了查尔酮,查尔酮与β-月桂烯经Diels-Alder反应得到目标产物[(1R,6R)-4-(4-甲基-3-戊烯基)-6-苯基-3-环己烯]-苯甲酮,它不仅可以作为药物直接使用,也可以作为合成其它药物的中间体。文献[16]中合成了一种新型催化剂“aluminum hexagonal molecular silica(Al-HMS)”用于催化月桂烯与查尔酮的Diels-Alder反应。在Al-HMS的催化下,查尔酮与β-月桂烯的Diels-Alder反应条件温和、目标产物选择性较好且易分离,但其催化反应所需时间较长、目标产物收率较低(61%),反应如式(3)所示。
1.4.3 合成5,5-二甲基-5,6,7,8,9,10-六氢蒽-1,4-二酚
5,5-二甲基-5,6,7,8,9,10-六氢蒽-1,4-二酚是一种具有细胞毒性的化合物,它对多种肿瘤细胞具有抑制作用。海维[18]以β-月桂烯和对苯醌为原料,以三氟化硼-乙醚为催化剂,通过Diels-Alder反应得到过渡态产物,过渡态产物中醌式和烯醇式结构在Lewis酸作用下,支链烯烃和桥环烯烃双键发生亲电加成,得到目标产物。通过实验得出了原料最佳配比及反应条件,所得目标产物经高效液相色谱分析、元素分析和NMR等分析手段,验证了结构。其反应如式(4)所示。
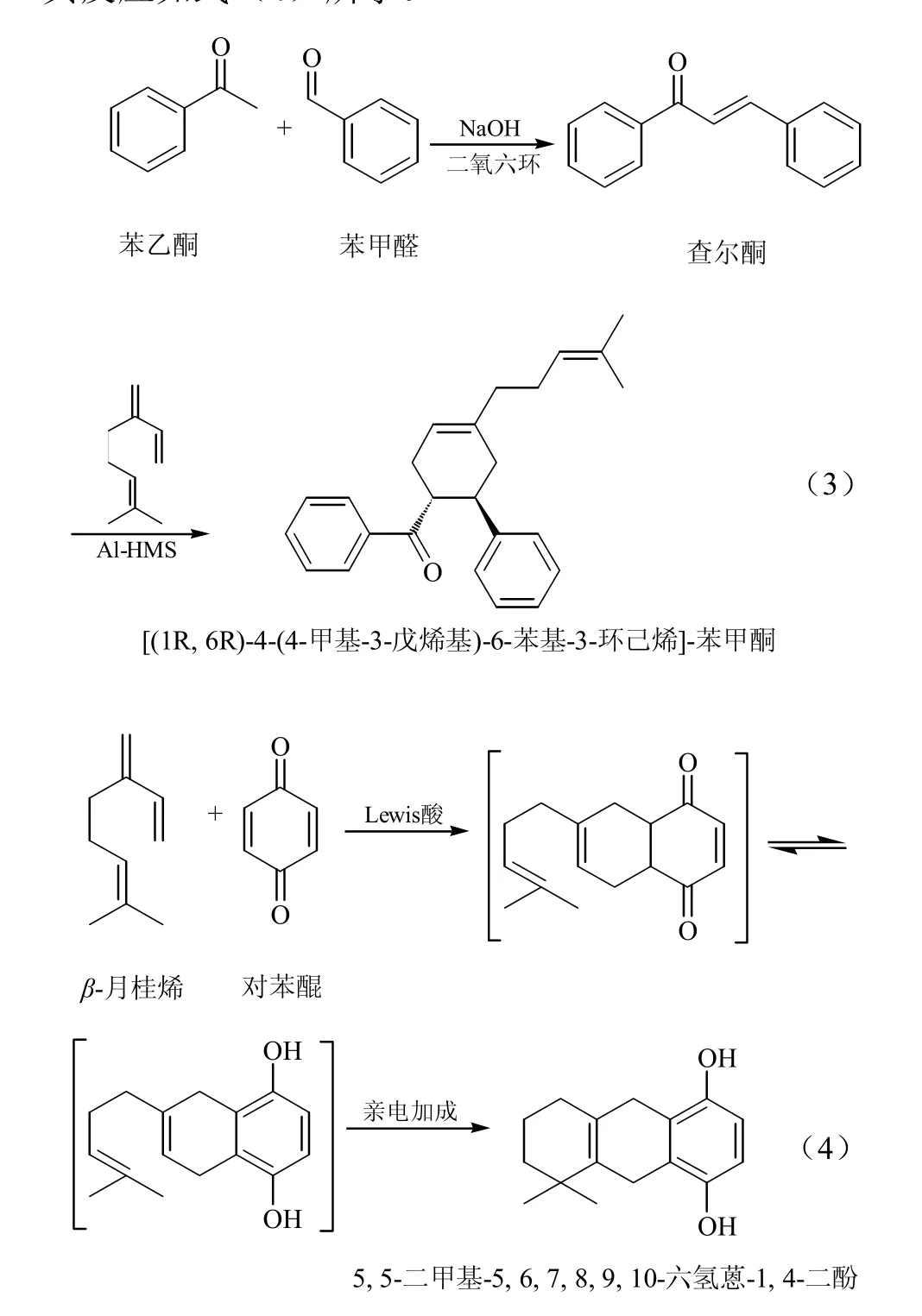
1.5 β-月桂烯的其它亲二烯体的Diels-Alder反应
Sasaki等[19-20]系统研究了月桂烯与炔类、烯类和含杂原子亲二烯体的Diels-Alder反应。反应在氮气氛围下进行,所得产物(发生Diels-Alder反应)产率为精馏后数值,其它实验参数列于表1中。
从表1中可以看出,空间位阻小、连有吸电子基团的亲二烯体具有反应速率快、产率高的优点;含杂原子的亲二烯体中与氮氮双键的 Diels-Alder反应更加容易进行。随着催化剂的发展及 Lewis酸应用的推广,β-月桂烯的亲二烯体的 Diels-Alder反应的产率和选择性已被大大提高如β-月桂烯与苯醌[21]和丙烯腈[22]的产率分别达到了 81%和86.8%。

表1 β-月桂烯与各种亲二烯体的Diels-Alder反应
2 β-月桂烯的还原反应
在酸性或碱性条件下,β-月桂烯分子中3个碳碳双键可发生还原反应[23]。碱性还原通常为硼氢化反应,酸性还原通常需要在金属或金属配合物[24]的辅助催化下进行。
2.1 β-月桂烯的硼氢化反应
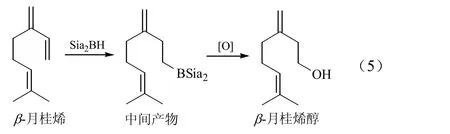
Brown等[25]将 B2H6溶于四氢呋喃中制备了有机硼化物Sia2BH,然后在N2氛围下加入等摩尔的新蒸馏出的β-月桂烯,在0~10 ℃下保持4 h即得式(5)中的中间产物,再进行氧化处理就得到了目标产物β-月桂烯醇。目标产物经IR和NMR检测,验证了其结构为式(5)所示。后来有研究者分别用不同的有机硼化物对β-月桂烯的碳碳双键进行了羰基化[26]和选择性加成得到手性化合物[27],目标产物都实现了分离和验证,但是,有机硼化物反应条件苛刻,大大限制了其在工业上的推广应用。
2.2 β-月桂烯的金属辅助催化氢化
Robles-Dutenhefner等[28-29]采用溶胶凝胶法,在不同条件下制备了一系列 Pd/SiO2催化剂用于催化β-月桂烯的加氢反应[式(6)]。制备催化剂的条件不同,6种加氢产物的配比也不同,通过控制制备催化剂的条件可以控制不同加氢产物的配比。
Speziali等[30]制备了一系列钌、铬、铱和铑金属配合物催化剂用于β-月桂烯的催化加氢反应。通过实验得出铑配合物对该反应的催化活性最高,化学选择性最好。通过对反应条件的优化,使式(6)中3-6异构体的选择性达到了98 %,月桂烯的转化率达到了80 %。对加氢后[式(6)中3-6异构体]的β-月桂烯进行进一步的氧化或其它反应的选择性将比β-月桂烯的选择性大大提升。

3 β-月桂烯的氧化反应
β-月桂烯的氧化产物有特殊的香味,可用于合成香料和化妆品。月桂烯的自动氧化[31]和光敏氧化[32]已有报道,分别得到了β-月桂烯的不同衍生物,包括醇[33]、氧化物、酮和聚合产物。近年来,越来越多的研究者对β-月桂烯进行选择性氧化和环氧化的研究,提高了β-月桂烯的应用价值。
3.1 β-月桂烯的选择性氧化
Goncalves等[34]对β-月桂烯的选择性氧化进行了研究,得到了两种比例相当的氧化产物。实验以含有LiCl的冰乙酸为溶剂、PdCl2-CuCl2作催化剂,先对溶剂进行通氧处理15 min,加入β-月桂烯,搅拌至反应结束。产物经分离和检测分析后,验证为式(7)中所示结构。这两种异构体含有环戊烯的骨架,具有令人愉悦的花香和果香味道,能够被用于作为合成香料的中间体。


3.2 β-月桂烯的环氧化反应
β-月桂烯的环氧化反应可以得到3种异构体,如式(8)所示。其中,间氯过苯甲酸(MCPBA)氧化β-月桂烯的产物几乎全部为异构体1。由于共轭双键的稳定效应,异构体2和3需要经过中间体才能得到。Fauchet等[35]经过两步反应得到了环氧β-月桂烯的异构体2和3。第一步,以二氯甲烷为溶剂,用高锰酸钾将β-月桂烯氧化为二醇羟基的中间体并将两种中间体分离;第二步,对分离后的中间体分别进行相同的反应,在中间体中加入吡啶溶剂,然后在0 ℃下加入磺酰氯,搅拌3 h,脱水即可得到相应的环氧化物,产物经 H1NMR鉴定为式(8)中所示结构。β-月桂烯的3种环氧化异构体经改性研究[36],得到了一系列β-月桂烯的醛和酮衍生物,这些衍生物是合成香料和维生素的重要中间体。
4 β-月桂烯的其它反应
4.1 β-月桂烯合成维生素E
β-月桂烯可以和活泼亚甲基发生偶联反应形成碳碳键。Dhanalakshmi等[37]以咪唑类离子液体为溶剂,在铑配合物和三苯基磷三磺酸钠(TPPMS)催化下,对β-月桂烯和乙酰乙酸乙酯的偶联反应进行了研究。研究发现,该催化体系能够高选择性地催化β-月桂烯和乙酰乙酸乙酯的偶联反应,偶联产物收率达93%,且没有副产物生成。文中还对偶联产物进行了脱水和脱羰基反应等研究,通过一系列合成反应制备了维生素E。反应如式(9)所示。

4.2 β-月桂烯的聚合
β-月桂烯可以发生自聚反应,也可以与其它含碳碳不饱和键的化合物发生聚合反应,聚合后可以作为高分子材料直接应用于日常生活或工业生产[38-39]。Johanson等[40]研究了乳液中β-月桂烯的自聚、与苯乙烯共聚以及与苯乙烯和丁二烯的三元共聚反应,发现三元共聚物材料的拉伸强度和伸长率分别达到了17.2 MPa和500 %。
5 展 望
β-月桂烯是一种化学性质活泼的天然产物,可以应用于有机反应的众多领域,如文中提到的合成抗肿瘤活性物质、合成酸酐应用工业生产和合成维生素E等,但是目前工业上却只用于合成香料,这大大限制了它的应用。今后,β-月桂烯的研究有望朝着下列5个方向发展,以更全面地开发利用β-月桂烯,使其更大程度地服务于国民生产生活。
(1)加大对其空间异构体的分离及衍生物的合成研究。如β-月桂烯的Diels-Alder反应应该得到内型和外型的混合物,应加大得到其单一物质的性质及其应用的研究,以更好地开发其在合成医药方面的潜能。
(2)寻找新的植物,提取出更高纯度的β-月桂烯。如文献[41]曾报道乳香胶油中含有高达57.9%的β-月桂烯,开展这方面的研究对β-月桂烯产量提高、生产成本降低及应用价值增加有积极作用。
(3)通过一系列化学反应,对β-月桂烯进行改性,得到性能优异的深加工产品,为β-月桂烯工业化拓展奠定基础。如β-月桂烯与马来酸酐的Diels-Alder反应产物,既有月桂烯的柔性链又有化学活性高、工业应用广的酸酐官能团,可应用于多种工业助剂的研究开发。
(4)对β-月桂烯进行催化裂解,得一系列小分子,如乙烯[42-43]等,为替代石化资源、推进可持续发展战略拓宽道路。
(5)利用选择性好、能耗低、环境友好型生物方法[44-45],辅助研究开发β-月桂烯,积极响应低碳环保政策的推广。
[1]宋湛谦. 中国松脂特征与松属分类[M]. 北京:中国林业出版社,1998:186.
[2]Yin Donghong,Yin Dulin,Fu Zaihui,et al. The regioselectivity of Diels-Alder reaction of myrcene with carbonyl-containing dienophiles catalysed by Lewis acids[J].Journal of Molecular Catalysis A:Chemical,1999,148:87-95.
[3]银董红,尹笃林,伏再辉,等. 微波固相法制备 ZnCl2/NaY催化剂[J]. 催化学报,1999,20(4):419-422.
[4]李昌志,银董红,李标模,等. ZnCl2离子液体中高区域选择性合成对位柑菁醛[J]. 催化学报,2005,26(3):194-198.
[5]Liu Jianfu,Yin Donghong,Yin Dulin,et al. ZnCl2supported on NaY zeolite by solid-state interaction under microwave irradiation and used as heterogeneous catalysts for high regioselective Diels-Alder reaction of myrcene and acrolein[J].Journal of Molecular Catalysis A:Chemical,2004,209:171-177.
[6]银董红,秦亮生,刘建福,等. 微波固相法制备 ZnCl2/MCM-41催化剂及其催化性能[J]. 物理化学学报,2004,20(9):1150-1154.
[7]Liu Jianfu,Yin Donghong,Qin Liangsheng,et al. New catalysts for Diels-Alder reaction of myrcene and acrolein prepared by solid-state interaction of MCM-41 silica and ZnCl2[J].Studies in Surface Science and Catalysis,2005,156:815-822.
[8]Veselovsky V V,Gybin A S,Lozanova A V,et al. Dramatic acceleration of the diels-alder reaction by adsorption on chromatography adsorbents[J].Tetrahedron Letters,1988,29(2):175-178.
[9]Oskooie H A. Diels-Alder reaction of myrcene with carbonyl containing dienophiles supported on silica gel under microwave irradiation[J].Phosphorus,sulfur,and Silicon,2004,179:1165-1167.
[10]Goldblatt L A,Palkin S. Vapor phase thermal isomerization ofα- andβ-Pinene[J].J. Am. Chem. Soc.,1941,63:3517-3522.
[11]罗金岳,安鑫南,雷福厚. 固体超强酸SO42-/TiO2-ZrO2催化β-月桂烯与马来酸酐的Diels-Alder反应的研究[J]. 林产化学与工业,2007,27(6):90-94.
[12]陆占国,小林直,张亚丽. 以为原料的新单萜衍生物合成及构造解析[J]. 化学与黏合,2005,27(3):131-134.
[13]赵振东,刘先章. 松节油的精细化学利用(Ⅲ)[J]. 林产化工通讯,2001,35(3):38-43.
[14]John B H,Sanders J M. Perfume compositions and perfume articles containing one isomer of an octahydrotetramethyl acetonaphthone:US,3929677[P]. 1975.
[15]夏建陵,彭淑静. 合成龙涎酮香料的研究[J]. 南京林业大学学报,1995,19(4):33-38.
[16]Corbett L J,Weavers R T. Aluminosilicate catalysis of chalcone Diels-Alder reactions[J].Synthetic Communicatons,2008,38(4):489-498.
[17]陆国元. 有机反应与有机合成[M]. 北京:科学出版社,2009:131.
[18]海维. 月桂烯合成蒽二酚类化合物的研究[D]. 南京:南京林业大学,2009.
[19]Sasaki T,Eguchi S,Ishii T. Studies on reactions of isoprenoids. Ⅳ. The reactivity of myrcene in 1,4-cycloaddition reactions[J].The Journal of Organic Chemistry,1969,34(12):3749-3753.
[20]Sasaki T,Eguchi S,Ishii T. et al. Studies on reactions of isoprenoids.Ⅶ. The 1,4-cycloaddition reactions of Nitrosobenzene with isoprene,chloroprene,and myrcene[J].J. Org. Chem.,1970,35(12):4273-4275.
[21]Gordaliza M,Corral J,Castro A,et al. Synthesis and bioactivity of new antineoplastic terpenylquinones[J].Bioorg. Med. Chem. Lett.,1996,6:1859-1864.
[22]关永怡,黄志舒,英柏宁. 月桂烯的Diels-Alder反应及其在合成香料方面的应用[J]. 香料香精化妆品,1990(3):18-19.
[23]Akutagawa S,Otsuka S. Metal-Assisted terpenoid synthesis. 3. A myrcene magnesium compound as a new example of an enediylmetal system formed from a conjugated diene and its synthetic applications[J].Journal of American Chemical Society,1976,98(23):7420-7421.
[24]Evans W J,Giarikos D G,Tobledo C B,et al. Reactivity of the substituted butadienes , isoprene and mrcene , with decamethylsamarocene[J].Organometallics,2001,20:5648-5652.
[25]Brown H C,Singh K P,Garner B J. Hydroboration of terpenes Ⅰ. The selective hydroboration of myrcene with dislamylborane[J].Journal of Organometallic Chemistry,1963,1:2-7.
[26]Murphy R,Prager R H. Organoboranes in organicsynthesis Ⅸ. Carbonylation products of organoboranes derived from myrcene[J].Journal of Organometallic Chemistry,1978,156:133-147.
[27]Satoh M,Nomoto Y,Miyaura N,et al. New convenient approach to the preparation of(z)-allylic boronatesviacatalytic 1,4-hydroboration of 1,3-dines with catecholborane[J].Tetrahedron Letters,1989,30(29):3789-3792.
[28]Tskahashi M,Urata H,Suzuki H,et al. Regioselective introduction ofo-nucleophiles intoβ-myrcene andtrans-ocimene using palladium(Ⅱ)compllexes[J].Journal of Organometallic Chemistry,1984,266:327-336.
[29]Robles-Dutenhefner P A,Speziali M G,Sousa E M B,et al. Selective hydrogenation of myrcene catalyzed by sol-gel Pd/SiO2[J].Applied Catalysis A:General,2005,295:52-58.
[30]Speziali M G,Moura F C C,Robles-Dutenhefner P A,et al. Selective hydrogenation of myrcene catalyzed by complexes of ruthenium,chromium,iridium and rhodium[J].Journal of Molecular Catalsis A:Chemical,2005,239:10-14.
[31]Dieckmann R H,Palamand S P. Autoxidation of some constituents of hops. The monoterpene hydrocarbon,myrcene[J].J. Agr. Food Chem.,1974,22(3):498-503.
[32]Kenney R L,Fisher G S. Photosensitized oxidation of myrcene[J].J. Am. Chem. Soc.,1959,81(16): 4288-4291.
[33]Houlihan W J,Levy J,Mayer J. The structure of the alcohol obtained by the hydration of myrcene[J].J. Am. Chem. Soc.,1959,81(17):4692-4694.
[34]Goncalves J A,Howarth O W,Gusevskaya E V. Palladium catalyzed oxidation of monoterpenes:Novel oxidation of myrcene with dioxygen[J].Journal of Molecular Catalysis A:Chemical,2002,185:97-104.
[35]Fauchet V,Miguel B A,Taran M,et al. Epoxides from myrcene:Selective obtention[J].Synthetic Communications,1993,23(18):2503-2510.
[36]Fauchet V,Miguel B A,Taran M,et al. Epoxides from myrcene:New versatile tools for the synthesis of functionalized acyclic terpenoids[J].Synthetic Communications,1999,29(21):3673-3684.
[37]Dhanalakshmi K,Vaultier M. Rhodium catalysed coupling reaction of myrcene with ethyl acetoacetate in the ionic liquid 1-ethyl-3-methylimidazolium triflimide[J].Tetrahedron,2003,59:9907-9911.
[38]Cawse J L,Stanford J L,Stillt R H. Polymer from renewable sources:5. Myrcene-based polyols as rubber-toughening agents in glassy polyurethanes[J].Polymer,1987,28:368-374.
[39]Berg K J,Horst J,Boon J J,et al.Cis-1,4-poly-β-myrcene:The structure of the polymeric fraction of mastic resin elucidated[J].Tetrahedron Letters,1998,39:2645-2648.
[40]Johanson A J,Mckennon F L,Goldblatt L A. Emulsion polymerization of myrcene[J].Industrial and Engineering Chemistry,1948,40(3):500-502.
[41]Daferera D,Tarantilis P A,Polissiou M. Quantitative analysis ofα-pinene andβ-myrcene in mastic gum oil using FT-Raman spectroscopy[J].Food Chemistry,2002,77:511-515.
[42]Kolicheski M B,Cocco L C,Mitchell D A,et al. Synthesis of myrcene by pyrolysis ofβ-pinene:Analysis of decomposition reactions[J].J. Anal. Appl. Pyrolysis,2007,80:92-100.
[43]Stolle A,Ondruschka B. Comment to the paper “Synthesis of myrcene by pyrolysis ofβ-pinene:Analysis of decomposition reactions” by M. B. Kolicheski et al. [J. Anal. Appl. Pyrol(80)2007 92-100][J].J. Anal. Appl. Pyrolysis,2008,81:136-138.
[44]Miyazawa M,Murata T. Biotransformation ofβ-myrcene by the larvae of common cutworm[J].Journal of Agricultural and Food Chemistry,2000,48(2):123-125.
[45]Thompson M L,Marriott R,Dowle A,et al. Biotransformation ofβ-myrcene to geraniol by a strain of Rhodococcus erythropolis isolated by selective enrichment from hop plants[J].Appl. Microbiol. Biotechnol.,2010,85:721-730.
Research progress of application ofβ-myrcene in organic reactions
LIAN Jianwei1,XIA Jianling1,2,HUANG Kun1,YANG Xiaohua1,WANG Mei1
(1Institute of Chemical Industry of Forestry Products,Chinese Academy of Forestry;National Engineering Lab. for Biomass Chemical Utilization;Key and Lab. on Forest Chemical Engineering,State Forestry Administration,Key Lab. of Biomass Energy and Material,Nanjing 210042,Jiangsu,China;2Institute of New Technology of Forestry,Chinese Academy of Forestry,Beijing 100091,China )
β-Myrcene is a natural product with active chemical properties. The applications ofβ-myrcene in reduction reaction,oxidation reaction and other reactions are reviewed and its research progress in various organic reactions is summarized. The research ofβ-myrcene in Diels-Alder reactions is mainly introduced,including reactions betweenβ-myrcene and dienophiles,such as acrolein,methyl acrylate and maleic anhydride and their degrees of difficulty are analyzed. Finally,the research directions ofβ-myrcene in applications are prospected.
β-myrcene;Diels-Alder reaction;reduction reaction;oxidation reaction
O 629.9
A
1000-6613(2011)08-1826-06
2011-01-10;修改稿日期2011-03-23。
林业公益性行业科研专项(201104031)及国家自然科学基金青年科学基金项目(31000280)。
连建伟(1985—),男,硕士研究生。E-mail lianjw868@163.com。联系人:夏建陵,研究员,主要从事生物质资源的化学改性和应用研究及环氧固化剂的研究与开发。E-mail xiajianling@126.com。

