杂多化合物K5CoW12O40·20H2O合成条件的探讨
李 杰
(赤峰学院 化学化工学院,内蒙古 赤峰 024000)
杂多化合物K5CoW12O40·20H2O合成条件的探讨
李 杰
(赤峰学院 化学化工学院,内蒙古 赤峰 024000)
设计探索了钨钴杂多酸钾的合成方法条件,通过改变试剂的加入顺序,改变溶液的酸度和温度,探索合成过程的影响因素.在显微镜下观察了晶体的形状,并利用红外对其进行了表征.
钨钴杂多酸钾;合成;红外光谱;影响因素
1 杂多类化合物简介
杂多类化合物的合成最早起源于1826年[1],科学家BerzeLius发现将钼酸铵加到磷酸中会产生黄色沉淀,这就是现在人们熟知的钼黄(NH4)3PMo12O40.1848年,生成这种黄色化合物的沉淀法被应用到分析化学上.但直到1862年Marignac发现了钨硅酸及其盐后,这些杂多化合物的组成才被确定下来.到20世纪初,已发现近60多种不同的杂多酸及几百种盐.现在,人们已经发现有近70种元素可作为杂多酸中的杂原子.杂多化合物已形成了一类庞大而重要的化合物.多年来,人们对杂多酸的研究长盛不衰.
在经典的杂多化合物的合成中,人们研究较多的两种常见组成类型为具有Keggin结构的阴离子[XM12O40]和具有Dawson结构的阴离子[X2M12O62].具有Keggin结构的阴离子有5种异构体,其中α—Keggin结构中的杂原子XO4四面体以桥氧被4个M3O13单元包围在中间.在M3O13单元中,3个MO6八面体之间两两共边后,3个单元又共一个顶点构成M3O13.4个M3O13单元之间靠共顶点氧而构成α—Keggin结构,如图1所示.
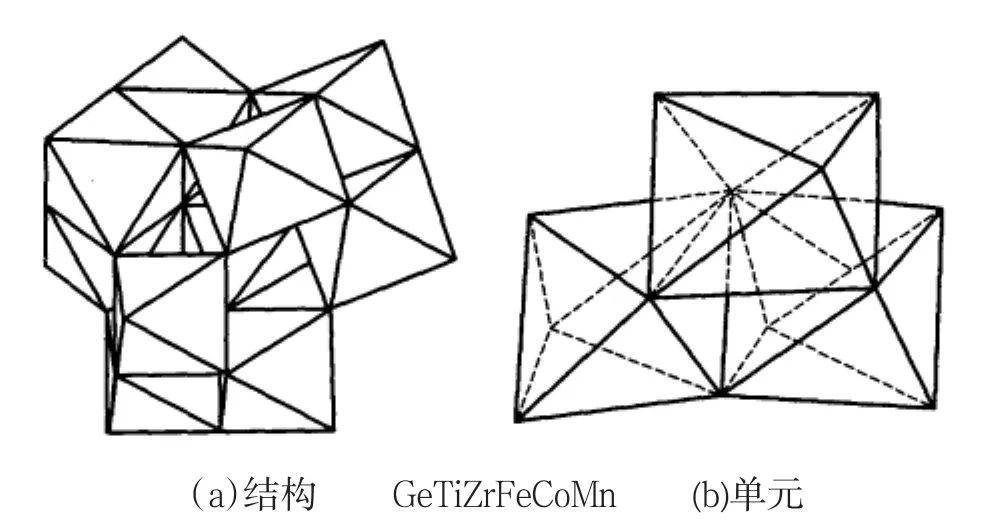
图1 α-Keggin结构和M3O13单元
杂多化合物具有优异的性能,在石油化学工业中广泛用作高效均相催化剂,用作许多染料的沉淀剂,用作新颖树脂交换剂,钼的杂多化合物还用作阻燃剂.杂多类化合物在医学、药学、生物化学等领域的潜在应用价值引起了科学家们的极大兴趣.
2 实验部分
2.1 实验原理
许多金属(Ge、Ti、Zr、Fe、Co、Mn)和非金属(B、Si、P、As、Te)原子都可以和 Mo或 W 的 MO6八面体一起形成杂多酸[2].酸化含有所需的简单阴离子的溶液或者在先酸化钼酸根或钨酸根阴离子后再引入杂原子都可得到杂多酸根离子,加入合适的阳离子,杂多酸盐从水溶液中析出.

合成杂多化合物K5CoW12O4020H2O的实验是:加热酸化的醋酸钴和钨酸钠溶液,加入KCl固体,用硫酸酸化反应产物,用K2S2O8做氧化剂,将Co2+氧化为Co3+,产物中有较多杂质,经重结晶后控制合适的结晶速度,可得到纯净的金黄色大棒状晶体.
在实验中,试剂的加入顺序、合适的反应温度和溶液的pH控制都是非常重要的.
2.2 仪器与试剂
仪器:电子天平,生物显微镜,TJ270-30A红外分光光度计.
试剂:Na2WO4·2H2O,H2SO4,K2S2O8,CoAc2·4H2O,KCl,HAc都是 AR 纯试剂.
3 实验步骤
3.1 K5CoW12O40·20H2O 的合成[1]
醋酸钴溶液的配制:向13ml蒸馏水中加入2滴醋酸后,加入2.5g醋酸钴,搅拌溶解,得醋酸钴溶液.
钨酸钠溶液的配制:将19.8g钨酸钠溶于40ml蒸馏水中,用醋酸调pH至7,得钨酸钠溶液.
将醋酸钴溶液加入到已加热近沸的钨酸钠溶液中,小火煮沸混合物15min,且不断用玻璃棒搅拌,使醋酸钴溶液与钨酸钠溶液混合均匀,趁热加入13gKCl固体,充分溶解后将混合物冷却到室温,抽滤,以少量滤液洗涤沉淀物.
将沉淀物取出,加入40ml2mol.L-1的H2SO4,小火加热几分钟后过滤,弃去不溶物.将滤液加热近沸,搅拌下每次加入约0.5gK2S2O8(注意不要加入太快,以免溶液爆沸),直至溶液由蓝绿色转为橙色.煮沸5~8min,以分解过量的K2S2O8.
将上述混合物冷却到室温,得不纯的K5CoW12O40·40H2O晶体,吸滤,显微镜下观察到黄色棒状晶体和无色透明杂晶.将粗产品以10ml热蒸馏水重结晶,抽滤得黄色棒状晶体,此为一号产品.
3.2 K5CoW12O40·20H2O合成条件的探讨
3.2.1 改变试剂的加入顺序,先加入硫酸酸化,后加入氯化钾,其他条件不变
将醋酸钴溶液加入到已加热近沸的钨酸钠溶液中,此时混合物为蓝绿色沉淀,然后加入2mol.L-1的硫酸40ml,蓝绿色沉淀消失,变成蓝黑色透明溶液,溶液的pH值为1,属强酸性.
将此溶液小火煮沸15分钟后,慢慢地加入K2S2O8固体,(大约需要5g左右),不断搅拌使其溶解,此时有橙色沉淀,pH值为2,溶液仍显酸性.
再加入13gKCl,用玻璃棒搅拌,使其充分溶解,橙色沉淀慢慢的变成黄绿色沉淀,吸滤,将粗产品以10ml热蒸馏水重结晶,抽滤得二号产品.
3.2.2 改变体系的酸度,将2mol.L-1的H2SO4溶液改为1mol.L-1的H2SO4溶液,其他条件不变.
按K5CoW12O40·20H2O的合成方法将醋酸钴、钨酸钠、KCl制得的沉淀物,加入40ml1mol.L-1的H2SO4溶液,小火加热几分钟后过滤,弃去不溶物.将滤液加热近沸,搅拌下加入K2S2O8,煮沸5~8min,以分解过量的K2S2O8.冷却至室温,吸滤,得到浅绿色的晶体.将粗产品以10ml热蒸馏水重结晶,抽滤得三号产品.
3.2.3 把40ml 2mol.L-1的H2SO4换成40ml的蒸馏水
按照K5CoW12O40·20H2O的合成方法,把40ml 2mol.L-1的H2SO4换成40ml的蒸馏水,其它操作不变,实验中加入40ml蒸馏水,将滤液加热近沸,加入K2S2O8,溶液一直是蓝绿色的,煮沸5~8min,以分解过量的K2S2O8.将上述混合物冷却到室温,蓝绿色溶液慢慢的转变为棕灰色沉淀,没有得到晶体.
3.2.4 反应物温度对杂多酸盐的影响
按照K5CoW12O40·20H2O的合成方法,不加热,改为放置15min,其它条件不变.没有得到任何晶体.
3.3 K5CoW12O40·20H2O晶体外形观察
取少量的干燥一号产品的晶体放在干净的载玻片上,将载玻片置于显微镜下观察,可以看见晶体是黄色棒状的,如图2所示.

图2 钨钴杂多酸盐晶体
3.4 K5CoW12O40·20H2O晶体的红外光谱
取少量较纯净的、空气中自然干燥的晶体产物,加入100~200倍的KBr晶体,按要求研细后压片,测其红外光谱,以鉴定产物纯度及结构.

图3 一号产品的红外光谱图
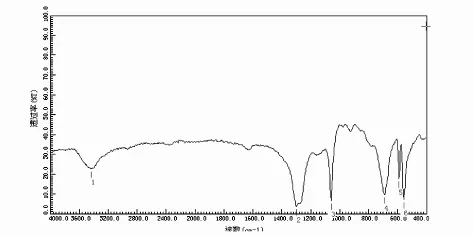
图4 三号产品的红外光谱图

图5 K5CoW12O40·20H2O标准红外谱图
4 结果和讨论
4.1 产物的红外光谱(IR)鉴定
杂多化合物往往有特征的红外光谱,图5是K5CoW12O40·20H2O 的 标 准 红 外 谱 图 ,除3400~3500cm-1和1620~1630cm-1两个结晶水的特征吸收峰外,CoW12O405-阴离子有4个特征吸收峰,其中955cm-1,895cm-1,758cm-1吸收峰与W-O键振动有关,而433cm-1吸收峰可能与Co-O键振动有关.
分析一号产品K5CoW12O40·20H2O的红外光谱图 , 分 别 在 1600cm-1、960cm-1、880cm-1、760cm-1、440cm-1处出现了强的吸收峰,与 K5CoW12O40·20H2O的标准谱比较,1600cm-1的吸收峰应是结晶水的吸收峰,其余的吸收峰数值和曲线波形与标准图谱基本一致,所以合成的一号产品可以认为是K5CoW12O40·20H2O由红外吸收峰及峰的位置分析,可归属于Keggin结构.
若产物含有杂质[1],则在IR图上1000~1200cm-1处有几个吸收峰,杂质较多时,该区域的吸收峰较强甚至会掩盖W-O955cm-1附近的特征吸收峰,并且在570~610cm-1处出现强吸收峰.此外,CoW12H2O405-在IR谱中的4个特征吸收峰可能有较小的位移,这是正常现象.

表1 K5CoW12O40·20H2O的红外光谱数据(cm-1)
三号产品是将2mol.L-1的H2SO4溶液改为1mol.L-1的H2SO4溶液,降低了K2S2O8氧化Co2+为Co3+的酸度,产物中有较多的杂质.在三号产品的红外谱图中,3490cm-1处有一吸收峰,这是水的吸收峰,分别在 1300cm-1、1080cm-1、760cm-1、600cm-1、520cm-1出现了强的吸收.掩盖了W-O955cm-1附近的特征吸收峰,而4个特征吸收峰也有较大的位移.所以可以认为三号产品是含有较多杂质的K5CoW12O40·20H2O.
4.2 改变试剂的加入顺序对产品的影响
根据实验原理,合成K5CoW12O40·20H2O是酸化醋酸钴和钨酸钠溶液,加入KCl固体,生成Co2+盐,用硫酸酸化反应产物,K2S2O8做氧化剂,将Co2+盐氧化为Co3+盐,经重结晶,得到纯净的金黄色大棒状晶体.设想先将生成的Co2+多酸氧化为Co3+的杂多酸,再加入KCl生成杂多酸盐也应该可行,但制备出的产品是黄色粉末状的,不是黄色棒状晶体,认为实验失败,原因还在探讨中.
4.3 酸度对产品的影响
从两次改变硫酸的浓度所得产物及产物的光谱图可以看出,H2SO4的浓度为2mol.L-1,可以得到浅绿色的晶体,所测红外谱图和标准红外谱图有一定的差别(杂质较多);把40ml 2mol.L-1的H2SO4换成40ml蒸馏水时,没有得到晶体,这说明酸度对杂多酸盐的合成是有很大影响的.
4.4 反应温度对产品的影响
合成时,将原来规定的煮沸几分钟都改成放置15min,结果没有得到任何晶体.说明只有在合适的温度条件下反应才能进行.
〔1〕张寒琦,徐家宁.综合和设计实验[M].北京:高等教育出版社,2006.
〔2〕朱文祥.中级无机化学[M].北京:高等教育出版社,2004.
O611.3
A
1673-260X(2011)08-0030-03

