干旱胁迫下菊花叶片的生理响应及抗旱性评价
栗燕,黎明,袁晓晶,李永华
(河南农业大学林学院,郑州450002)
干旱胁迫下菊花叶片的生理响应及抗旱性评价
栗燕,黎明,袁晓晶,李永华
(河南农业大学林学院,郑州450002)
为了科学地评价菊花的抗旱性并为抗旱育种提供理论依据,以盆栽金背大红、天下一品、泉香冲天、紫玉、国华皇专和俊河的舞6个观赏菊品种为试材,测定了不同干旱胁迫强度下叶片质膜透性、丙二醛(MDA)含量 、超氧化歧化酶(SOD)、过氧化物酶(POD)活性和叶绿素含量,并用隶属函数法综合评价不同品种菊花抗旱性。结果表明:随干旱胁迫强度的增加,6品种菊花叶片质膜透性持续增大,而叶绿素含量持续下降,SOD、POD含量呈现先升后降再升的趋势。国华皇专、紫玉叶片中MDA含量表现出持续上升的趋势,其他4个品种均呈现先降后升的趋势。隶属函数法综合评价6品种菊花抗旱性大小顺序为金背大红>天下一品>泉香冲天>紫玉>国华皇专>俊河的舞。
菊花;干旱胁迫;抗旱性;隶属函数法
菊花(Dendranthema×grandif lorum)是原产于我国的传统名花,属菊科菊属的多年生宿根草本植物,在庭院观赏、花坛布置、街景造型中得到了广泛应用。
目前,关于菊花的研究主要集中在花期调控[1-3]、品种分类[4-5]、苗期及花期生理生化变化[6]等方面。而在菊花抗性生理方面的研究较少,毛洪玉等[7]以地被菊试验材料研究了其抗寒性,发现抗寒性强的品种叶糖含量都高于抗寒性弱的品种,随着植物体内含水量的降低,其抗寒防冻能力增强。李云等[8]研究认为热激锻炼在一定程度上提高了菊花幼苗的耐热性,热激锻炼的菊花叶片相对电导率和MDA含量均较对照低,而可溶性蛋白质和脯氨酸含量均较对照低,而 POD和 SOD活性较对照强。目前,关于干旱胁迫对菊花叶片生理指标影响的研究未见报道。随着全球气候变暖,环境恶化,干旱连年频发,干旱胁迫已成为限制菊花生产与应用的瓶颈之一。因此,研究不同品种菊花的抗旱生理,选育出抗旱性强的菊花品种具有重要的意义。
本研究通过对6个观赏菊花品种在不同干旱胁迫强度下与抗旱性相关的生理指标的测定,并运用隶属函数法综合评价其抗旱性大小,旨在为用生理指标评价菊花的抗旱性提供科学依据,为菊花抗旱性育种提供有益参考。
1 材料与方法
1.1 材料
本试验在河南农业大学园林实验站进行。供试材料均为观赏菊品种,分别为金背大红、天下一品、泉香冲天、紫玉、国华皇专和俊河的舞,均由河南省开封市金谷园立体花坛有限公司提供。
1.2 方法
1.2.1 试验处理
2008年10月将菊花扦插苗定植于直径为18 cm 的花盆中(1株/盆),基质为V(细沙)∶V(园土)∶V(草炭)=1∶3∶1,露地栽培 ,常规管理 ,选取生长健壮、长势一致的菊花植株进行试验。
采用随机区组设计,设置干旱胁迫和正常浇水对照2个处理,分别于停水干旱胁迫后6 d、12 d和18 d取样测定各项指标,3次重复。
1.2.2 测定项目及方法
质膜相对透性采用相对电导率法[9]测定;叶绿素相对含量采用CIRAS-2型便携式叶绿素仪(英国PPS科学仪器公司)测定[10];MDA含量采用硫代巴比妥酸法[11]测定;SOD活性用氮蓝四唑(NBT)光还原法[12]测定;POD活性用愈创木酚氧化法[12]测定。
1.2.3 数据分析
应用SPSS 12.0统计分析软件对所得数据进行统计分析,并用隶属函数值法[13]对不同品种抗旱性进行综合评价。隶属函数值计算公式:
X(μ)=(X-Xmin)/(Xmax-Xmin) 。
上式中:X(μ)为隶属函数值,X为指标的平均值,Xmax为各品种对应指标的最大值,Xmin为各品种对应指标的最小值。
2 结果与分析
2.1 干旱胁迫下菊花叶片质膜透性的变化
由图1可见,随着干旱胁迫强度的增加,各菊花品种叶片的相对电导率均逐渐增加。干旱胁迫前期,相对电导率增加缓慢,干旱胁迫后期各菊花品种的相对电导率则大幅度上升。除国华皇专和俊河的舞叶片相对电导率在干旱12 d时才与对照显著差异外,其它4品种在干旱胁迫6 d时均开始与对照存在显著差异(P<0.05)。
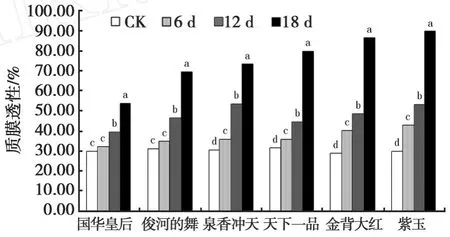
图1 干旱胁迫下菊花叶片质膜透性的变化Fig.1 Changes of protoplasmic membrance prenetrability under drought stress
在胁迫处理18 d时,叶片相对电导率的增加幅度因品种不同而表现出不同的特点。国华皇专的相对电导率与对照比增加了78.78%,其增加幅度最少;其次为俊河的舞(增加了122.17%)、泉香冲天(增加了139.8%)、天下一品(增加了 153.7%)、金背大红(增加了198.67%)、紫玉(增加了200.3%)。
2.2 干旱胁迫下菊花叶片中MDA含量的变化
由图2可见,随着干旱胁迫程度的加剧,国华皇专和紫玉叶片中MDA含量表现出持续上升的趋势,其他4个品种均呈现先下降后上升的趋势。国华皇专和俊河的舞在第18 d才达到显著差异水平;金背大红和泉香冲天在干旱第6 d时与对照差异显著,第12 d时反而无显著差异,第18 d时又达到显著差异水平;天下一品和紫玉在各时期均与对照差异显著(P<0.05)。干旱胁迫时间达6 d时,俊河的舞、泉香冲天、天下一品和金背大红MDA含量降至最低,分别为 7.123 nmol/g FW、9.925 nmol/g FW、4.239 nmol/g FW、4.056 nmol/g FW,这说明4个菊花品种对干旱胁迫有一定的抵抗能力,随着干旱胁迫时间的增长,其MDA含量均有明显的增加。当干旱胁迫结束时,金背大红MDA含量比自然状态下增加了37.4%,国华皇专、泉香冲天、天下一品、俊河的舞和紫玉与对照比分别增加了45.7%、46.4%、50.5%、70.2%、73.1%。
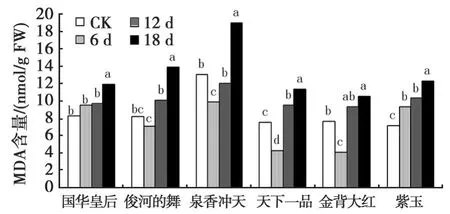
图2 干旱胁迫下菊花叶片MDA含量的变化Fig.2 Changes of MDA content under drought stress
2.3 干旱胁迫下菊花叶片中SOD和 POD活性的变化
由图3可见,随着胁迫强度的增加,6个品种菊花叶片的SOD和POD活性均呈现先增加后降低再增加的趋势,各品种在不同胁迫强度下均与对照存在显著差异(P<0.05)。
在本试验所设置的干旱胁迫强度下,6个品种菊花叶片中SOD活性差别不大(图3a)。但从整体趋势来看,在干旱胁迫前期,SOD活性先升高是因为植物在遭遇逆境时随着超氧自由基的增加进行的一种保护性应激反应。干旱12 d时,SOD活性又降低,这表明这时干旱胁迫已经加剧,超氧自由基的产生速度超过了机体自身的清除能力,表现出SOD活性降低。在干旱胁迫后期,SOD活性明显增加,这可能是在经历了前段时间的干旱胁迫后,植物体已产生了对此的适应能力,表现出较强的抗旱能力。
干旱胁迫导致POD活性上升,但由于品种间抗旱性差异,POD活性上升的幅度不尽相同(图3b)。其中,国华皇专在胁迫后期与对照比POD活性增加最多,为0.869 U/μg,其表现出了很强的抗旱性。
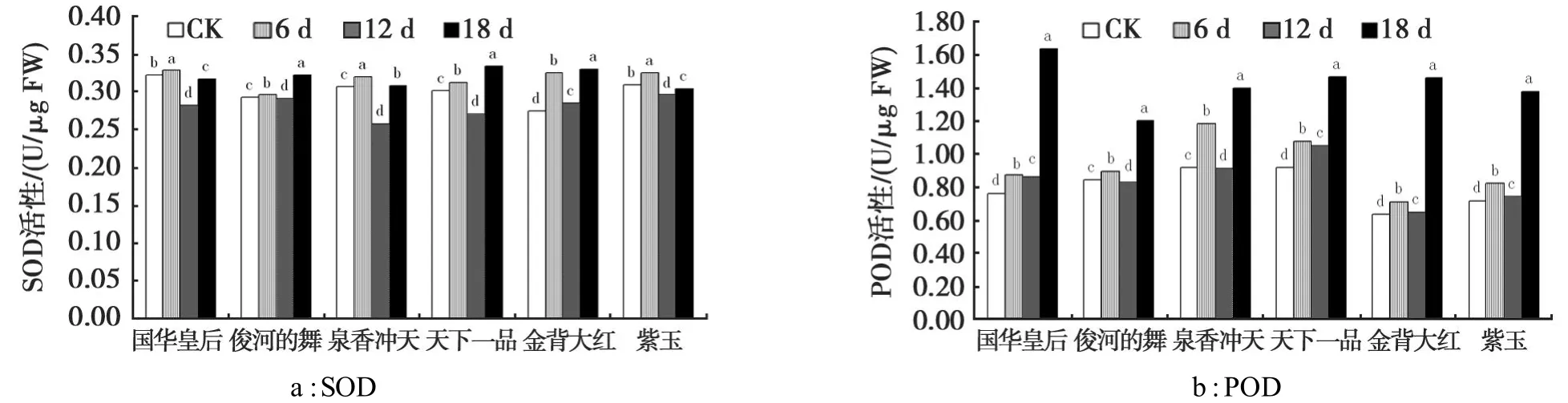
图3 干旱胁迫下菊花叶片SOD和POD活性的变化Fig.3 Changes of SOD and POD activity under drought stress
2.4 干旱胁迫对菊花叶片叶绿素相对含量的影响
由图4可见,叶绿素相对含量随着干旱胁迫时间的延长,总体上呈现缓慢下降的趋势,各品种在不同胁迫强度下均与对照存在显著差异(P<0.05)(图4)。图4中,对照菊花叶片叶绿素的相对含量保持在较高水平,胁迫18 d时,叶绿素的相对含量均大幅度降低。
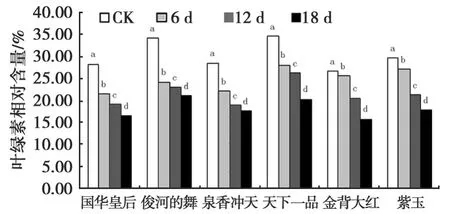
图4 干旱胁迫下菊花叶片叶绿素相对含量的变化Fig.4 Changes of chlorophyll relative content under drought stress
2.5 菊花抗旱性综合评价
结果见表1。
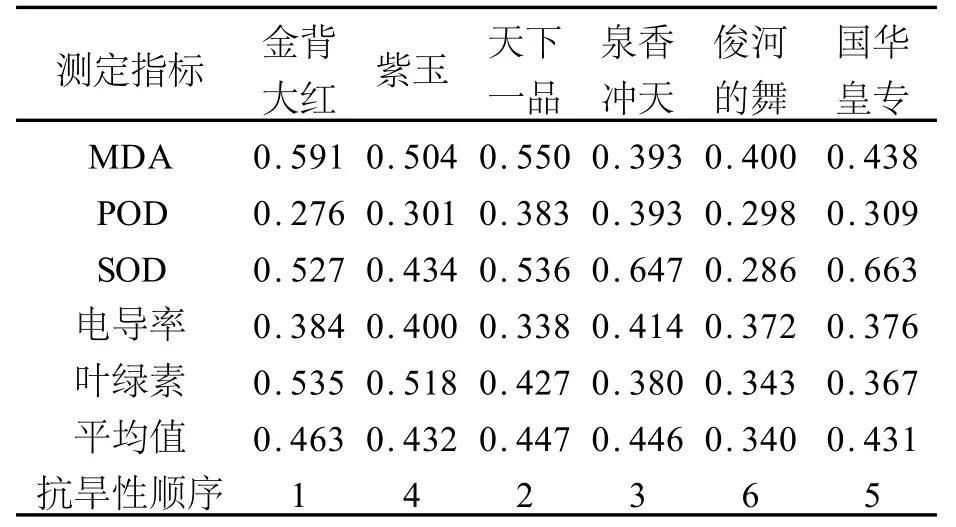
表1 六种菊花品种抗旱能力综合评价Tab.1 Comprehensive evaluation on drought-resistant capacity of six Chrysanthemum species
由表1可见,金背大红的隶属函数平均值最大,达到0.463,其次是天下一品,为0.447;泉香冲天,0.446;紫玉,0.435;国华皇专,0.431;俊河的舞的隶属函数值最小,为0.340。因此,按照隶属函数的综合评价值,对6个品种菊花抗旱能力进行排序为:金背大红>天下一品>泉香冲天>紫玉>国华皇专>俊河的舞。
3 讨论与结论
干旱胁迫可导致细胞代谢紊乱,使植物体内活性氧积累,植物将主动调动抗氧化酶类SOD、POD等来清除体内的活性氧,以保护细胞膜不受活性氧的攻击[14-16]。酶活性一般随胁迫增加而增加,或者是先增加后降低的基本势态[17]。在不同程度的干旱胁迫下,各类保护酶活性受胁迫程度的影响,在不同时期的活性高低表现不同。严重的逆境胁迫,如干旱、高温、低温、强光等综合作用使各类酶的活性降低,同时由于不同保护酶的催化底物不同,其对环境的适应性也不同,使不同处理、不同酶活性的变化规律也表现不同[18,22]。MDA含量的增加能够反映出物种抗旱能力的强弱,MDA增量越小,抗旱能力越强[23]。胁迫条件下植物体内产生的活性氧自由基会对细胞膜系统造成伤害,这些活性氧的清除依靠SOD和POD等酶的催化反应,从而免除或降低活性氧对细胞膜系统的伤害[24-26]。
本研究发现这6个品种菊花叶片中SOD、POD的含量均随干旱的加剧呈现出先增后降再增的趋势,这说明在一定干旱胁迫范围内,菊花通过酶活性增加,提高了适应干旱胁迫的能力。随着干旱胁迫的进一步加剧,超氧自由基的产生速度超过了机体自身的清除能力,表现出SOD、POD活性降低。在干旱胁迫后期,SOD、POD活性明显增加,可能是在经历了前段时间的干旱胁迫后,植物体已产生了一定的适应能力,表现出较强的抗旱性。
植物的抗旱性机制十分复杂,抗旱性是受多种因素影响和控制的复合遗传性状,因此,应对多个指标进行综合评价,进而弥补仅仅依靠单个指标进行评定的不确定性和片面性。以 MDA、POD、SOD、电导率和叶绿素5个生理指标为依据,应用隶属函数值法[13]对不同品种菊花的多种指标参数进行综合评价,用每一品种各项指标隶属度的平均值作为抗旱能力综合评价标准进行比较,平均值越大,抗旱能力就愈强。
本研究采用隶属函数法对6个品种菊花的抗旱能力进行综合评价,结果显示:金背大红>天下一品>泉香冲天>紫玉>国华皇专>俊河的舞,金背大红的抗旱性最强,而国华皇专的抗旱性较弱。而采用单一指标(MDA、电解质渗透率及 POD、SOD等)的测定结果及变化幅度均显示出国华皇专的抗旱性较好,初步证明了用不同的生理指标评价相同的菊花品种抗旱性会得到不相同的结果,单一指标难以判断植物对干旱的综合适应能力。
模糊数学综合隶属函数分析提供了一条在多指标测定基础上对材料特性进行综合评价的途径,将它应用于抗旱育种的选择,可以提高抗旱性筛选的可靠性。贾俊香等[27]、刘松涛等[28]、张微等[29]用同样的方法对多种苗木抗旱性进行了鉴定分析,也说明了这种方法具有一定的适用性。
[1]刘萍,常云霞,丁义峰.化学调控技术调整菊花生长、生理和开花研究现状[J].河南农业科学,2006(7):91-94.
[2]杨再强,罗卫红,陈发棣,等.赤霉素对单头切花菊发育和外观品质的影响[J].植物生理学通讯,2008,44(6):1095-1098.
[3]刘萍,程志卓,刘海英,等.AMP与ASA对菊花花瓣生理和花期调控的影响[J].西北农业学报,2009,18(1):258-261,266.
[4]杨雨,尚富德.开封地区菊花资源调查研究[J].河南大学学报:自然科学版,2008,38(3):293-295.
[5]雒新艳,刘倩倩,白新祥,等.北京地区独本菊品种资源及花型和花色分布研究[J].北方园艺,2009(7):183-188.
[6]田彦彦,王领,王林忠,等.不同生育期菊花叶片生理指标的比较研究[J].河南科学,2009,27(2):172-174.
[7]毛洪玉,祝朋芳,何小雨.地被菊的抗寒性和光照栽培试验[J].辽宁农业科学,2004(4):46-48.
[8]李云,张钢,杨际双.热激锻炼对高温胁迫下菊花生理代谢的影响[J].武汉植物学研究,2008,26(2):175-178.
[9]孙守家,赵兰勇,于守超.平阴玫瑰鲜花花蕾采后衰老生理机制研究[J].林业科学,2004,40(5):79-83.
[10]冯宝春,陈学森,何天明,等.枣树抗旱性研究初报[J].石河子大学学报:自然科学版,2004,22(5):397-400.
[11]张志良,翟伟菁.植物生理学实验指导[M].北京:高等教育出版社.2003.
[12]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[13]王新建,何威,杨淑红,等.豫楸1号4种砧木嫁接苗对干旱胁迫的生理响应[J].林业科学,2008,44(5):31-37.
[14]马丽,侯振安,梁永超,等.NaCl胁迫对棉花幼苗生理特性的影响[J].石河子大学学报:自然科学版,2008,26(2):180-184.
[15]Levittt J.Response of plants to environmental stress[M].New York:Academic Press,1972.
[16]Hanson A D,Nelsen C F.Everson E H.Evaluation of free Proline accumulation as an indox of drought using to con-tracting barley cultivars[J].Crop Sci,1977,17:720-726.
[17]鲁守平,孙群,洪露,等.不同种源地乌拉尔甘草发芽期抗旱性鉴定[J].植物遗传资源学报,2007,8(2):189-194.
[18]Singh T N.Aspinall D,Ptleg L G.Proline accumulation and Varietal adaptation to drought in barley.A potential matabolic measure of drought resistance[J].Nature New Biol,1972,236:188-190.
[19]杜金伟,崔世茂,金丽萍,等.水分胁迫对山杏渗透调节物质积累及保护酶活性的影响[J].内蒙古农业大学学报,2009,30(2):88-93.
[20]Marshall J,Rutledge R,Blumwald E,et al.Reduction in turgid water volume in jack pine,white spruce and black spruce in response to drought and paclobutrazol[J].Tree Physiology,2000,20(10):701-707.
[21]Zgallai H,Steppe K,Lemeur R.Effects of different levels of water stress on leaf water potential,stomatal resistance,protein and chlorophyll content and certain anti-oxidative enzymes in tomato plants[J].Jouranl of Integrative Plant Biology,2006,48(6):679-685.
[22]Arora A,Sairam R K,Srivastava G C.Oxidative stress and antioxidative system in plants[J].Current Science,2002,82:1227-1238.
[23]王琼,宋桂龙,韩烈保.5种野生护坡植物的抗旱综合性评价[J].福建农林大学学报:自然科学版,2008,37(2):153-157.
[24]Garay Arroyo A,Colmenero Flores J M,Garciarrubio A,et al.Highly hydrophilic proteins in prokaryote and eukaryotes are common during conditions of water deficit[J].J Biol Chem,2000,275:5668-5674.
[25]高蕾,刘丽君,董守坤,等.干旱胁迫对大豆幼苗叶片生理生化特性的影响[J].东北农业大学学报,2009,40(8):1-4.
[26]Paul E,Verslues,Manu Agarwal,et al.Methods and concepts in quantifying resistance to drought,salt and freezing abiotic stresses that affect plant water status[J].The Plant Journal,2006,45:523-539.
[27]贾俊香,贾炜珑.转基因玉米苗期抗旱性生理生化指标及综合评价的研究[J].山西农业大学学报,2005,25(4):331-333.
[28]刘松涛,赵喜茹,曹雯梅.应用模糊数学法综合评判旱地小麦新品种[J].安阳工学院学报,2008(4):94-96.
[29]张微,李春艳,曹连莆,等.春性小黑麦材料抗旱性的比较研究[J].石河子大学学报:自然科学版,2009,27(5):529-535.
Physiological Response to Drought Stress of Leaves and Drought-Tolerance Evaluation of SixDendranthema×grandif lorumCultivars
LI Yan,LI Ming,YUAN Xiaojing,LI Yonghua
(Forestry College,Henan Agricultural University,Zhengzhou 450002,China)
Drought tolerance of sixDendranthema×grandif lorumcultivars(Jinbeidahong,Tianxiayipin,Quanxiangchongtian,Ziyu,Guohuahuangzhuan andJunhedewu)under drought stress was evaluated with subordinative function,and the physiological and biochemical indexes such as exosmosis rate of cytoplasm,content of malondialdehyde(MDA),activities of superoxide dismutase(SOD)and peroxidase(POD),and the relative chlorophyll contents were measured.Comparing with control,with the degree of drought stress increase,the protoplasmic membrane penetrability of diferent species increased continually,while the chlorophyll contents were decreased gradually.The protective enzyme’s(SOD and POD)activity of six cultivars presented to rise first and then drop,and reached its maximum on 18 days in the condition of drought stress.The MDA content of Guohuahuangzhuan and Ziyu kept increasing,whereas other cultivars showed the trend of declining firstly and then rising.The comprehensive evaluation of the six cultivars was handled by using the subordinative function method.The drought tolerance of six chrysanthemum cultivars is in the following order:Jinbeidahong,Tianxiayipin,Quanxiangchongtian,Ziyu,Guohuahuangzhuan and Junhedewu.
Dendranthema×grandif lorum;drough stress;drought tolerance;subordinative function methord
S682.1 < class="emphasis_bold">文献标识码:A
A
2010-03-08
河南省重大科技专项(30400380)
栗燕(1978-),女,实验师,硕士,从事园林植物研究;e-mail:yanli1978@163.com。
李永华(1975-),男,副教授,博士,从事园林植物研究;e-mail:liyhhany@163.com。

