新疆苦豆子种子中生物碱类化学成分的研究
高红英,李国玉,王航宇,王金辉,2
(1石河子大学药学院/新疆特种植物药资源重点实验室,石河子832002;2沈阳药科大学中药学院,沈阳110016)
新疆苦豆子种子中生物碱类化学成分的研究
高红英1,李国玉1,王航宇1,王金辉1,2
(1石河子大学药学院/新疆特种植物药资源重点实验室,石河子832002;2沈阳药科大学中药学院,沈阳110016)
采用硅胶柱层析法、氧化铝柱层析法、Sephadex L H-20柱色谱法,以及重结晶等方法对新疆苦豆子种子中生物碱类化学成分进行研究,根据化合物的理化性质和光谱数据鉴定其结构。结果从新疆苦豆子种子中分离得到4个化合物,分别鉴定为9α-羟基苦参碱(Ⅰ)、苦参碱(Ⅱ)、槐定碱(Ⅲ)、氧化苦参碱(Ⅳ)。其中化合物Ⅰ为首次从本植物中分离得到。
苦豆子;生物碱;结构鉴定
苦豆子(Sophora alopecuroidesL.)为豆科槐属多年生草本植物,别名苦参草、苦豆根、苦甘草、西豆根、苦豆草、欧苦参等,主要分布于我国西北沙漠地区、华北地区以及中亚一带,生长在荒滩或盐碱土地,具有耐盐碱抗干旱等特性[1]。
在适合其生长的环境里,分布范围较广,分布量较大,是中国西北及华北地区的一种重要植物资源。其发达的地下根系对于保土固沙、生物固氮起着重要作用。苦豆子作为药用植物有清热解毒、祛风燥湿、止痛杀虫等作用[2]。
近年来对苦豆子的研究逐渐增多。研究表明,苦豆子地上部分含生物碱在6.1%~8.03%,种子约含生物碱8.11%。苦豆子生物碱有良好生物活性,被广泛用于临床,其不仅具有抗癌、抑癌、抑制和杀灭各种微生物的药理活性,而且对免疫系统、神经系统、心血管系统有广泛的药理作用[3]。
我们对苦豆子种子中生物碱类化学成分进行了研究,共分离得到4个化合物,分别为9α-羟基苦参碱(Ⅰ)、苦参碱(Ⅱ)、槐定碱(Ⅲ)、氧化苦参碱(Ⅳ),其结构见图1,其中化合物Ⅰ为首次从该植物中分离得的。
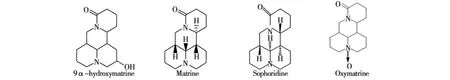
图1 化合物I-Ⅳ的结构Fig.1 The structures of compounds Ⅰ-Ⅳ
1 材料
X-5显微熔点测定仪(北京泰克仪器有限公司);Nicolet Nexus 470型红外分光光度计(日本日立);Shimadzu UV-2401紫外-可见分光光度计(日本岛津公司);VORIAN-600型核磁共振光谱仪测定(TMS作内标);薄层色谱用硅胶、柱层析硅胶以及柱层析氧化铝均为青岛海洋化工厂生产;其他试剂均为分析纯(天津市富宇精细化工有限公司)。
苦豆子药材采于新疆石河子市农试场,经石河子大学药学院谭勇教授鉴定为豆科槐属植物苦豆子种子,标本号为No.20070816006,样品保留于石河子大学药学院天然药物化学教研室。
2 提取与分离
苦豆子种子2 kg,5%NaOH浸提过夜,所得残渣用5%硫酸溶液提取,提取液过阳离子交换树脂,用含3%氨的95%乙醇进行洗脱,洗脱物经80%水合肼/活性炭后得总生物碱134 g,再经中性氧化铝柱分离 ,石油醚-丙酮(100∶0~0∶100)梯度洗脱 ,得到各洗脱流份。
利用反复中性氧化铝柱色谱、硅胶柱色谱、Sephadex L H-20和重结晶分离得到化合物Ⅰ70 mg,化合物 Ⅱ50 mg,化合物 Ⅲ30 mg,化合物 Ⅳ12 g。
3 结构鉴定
3.1 化合物Ⅰ
白色针状结晶(氯仿),易溶于氯仿、丙酮、甲醇、不溶于石油醚。C15H24N2O2,实验值m.p152~154℃,文献值m.p158~159 ℃。
IR VmaxKBr(cm-1):3257(O-H),2590,2778(反式喹诺里西丁类),1609(C=O,酰胺羰基信号峰);HR-ESI-TOF-MS m/z:265[M+H]+。
该化合物13C NMR谱数据中给出15个碳信号,δ169.3为一个羰基信号,结合1H-NMR谱给出的24个氢信号,可推测该化合物为喹诺里西丁类生物碱。
结合 IR中3257(O-H)以及 ESI/MS中246处的碎片离子峰可知,该化合物中含有一羟基,13CNMR谱中δ63.1处的碳信号为一连氧碳信号。
结合13C-NMR信号以及苦参碱类生物碱的结构特征可知,该碳信号即为连羟基的碳信号,1HNMR谱中δ2.07(s)即为该羟基信号峰。
该化合物Ⅰ的波谱数据见表1和表2,其13CNMR谱和1H-NMR谱数据与文献[4]对照一致,可判断该化合物为9α-hydroxymatrine。
3.2 化合物Ⅱ
白色柱状结晶(石油醚),易溶于氯仿、丙酮、甲醇、微溶于石油醚。C15H24N2O,实验值 m.p 81~83℃,文献值 m.p 80~82℃。
IR VmaxkBr(cm-1):2934,2886(C-H),2756,1651,1616(不饱和内酰胺),1465,1093;HR-ESITOF-MS m/z:249[M+H]+。
该化合物13C-NMR谱数据中给出15个碳信号,在最低场δ169.4处为一羰基信号,结合1HNMR谱给出的24个氢信号,可推测该化合物为喹诺里西丁类生物碱。
13C-NMR 谱中δ63.8、δ57.3、δ57.2、δ53.2、δ43.2为连氮的碳信号,另外,由1H-NMR谱低场处δ4.40(dd,J=12.6,4.2Hz),δ3.05(t,J=12.6Hz)信号可推测为喹诺里西丁类母核上17位分别处在e键和a键上的 2个氢信号,δ3.82(dt,J=9.6,6.0Hz)为11位连氮的叔碳上的氢信号。
化合物Ⅱ波谱数据见表1、表2,以上波谱数据与文献[5-7]对照一致,可确定为苦参碱(matrine),又根据其晶形及熔点值可确定本试验分得的苦参碱为δ-苦参碱。
3.3 化合物 Ⅲ
白色方晶(石油醚),易溶于氯仿、甲醇、不溶于石油醚。C15H24N2O,实验值 m.p 106~107 ℃,文献值 m.p 105~107℃。
IR VmaxkBr(cm-1):2922,2867(C-H),2795,2745,2725(Bohlmann band),1623(内酰胺的羰基信号);HR-ESI-TOF-MS m/z:249[M+H]+。
该化合物13C-NMR谱数据中给出15个碳信号,最低场δ169.9为一羰基信号,结合1H-NMR谱给出的24个氢信号,可推测该化合物为喹诺里西丁类生物碱。
该化合物 TLC与苦参碱对照,极性略小于苦参碱,且其1H-NMR谱呈现多重峰。
该化合物波谱数据见表1、表2,与文献[5-7]对照一致,结合其物理性状可确定该化合物为槐定碱(sophoridine)。
3.4 化合物 Ⅳ
白色棱晶(氯仿-乙醚),易溶于氯仿、甲醇,微溶于丙酮,不溶于石油醚。C15H24N2O2,实验值 m.p207~208℃,文献值 m.p205~207℃。
IR VmaxkBr(cm-1):2940,2879(C-H),2280,1612(内酰胺羰基信号),946(N-O);HR-ESI-TOF-MS m/z:265[M+H]+。
该化合物13C-NMR谱数据中给出15个碳信号,在最低场δ170.1为一羰基信号,13C-NMR中δ69.6、δ69.3、δ 67.1、δ 53.0、δ 41.7 为连氮的碳信号。
1H-NMR低场δ4.41(dd,J=12.6,5.4Hz),δ4.20(t,J=12.6Hz)为喹诺里西丁类母核上17位,分别为e键和a键上的2个氢信号,δ5.11(dt,J=10.2,5.4 Hz)为11位连氮的叔碳上的氢信号,1HNMR谱共给出24个氢信号。化合物Ⅳ波谱数据见表1、表2,与文献[5-6]中数据一致,故将其确定为氧化苦参碱(oxymatrine)。
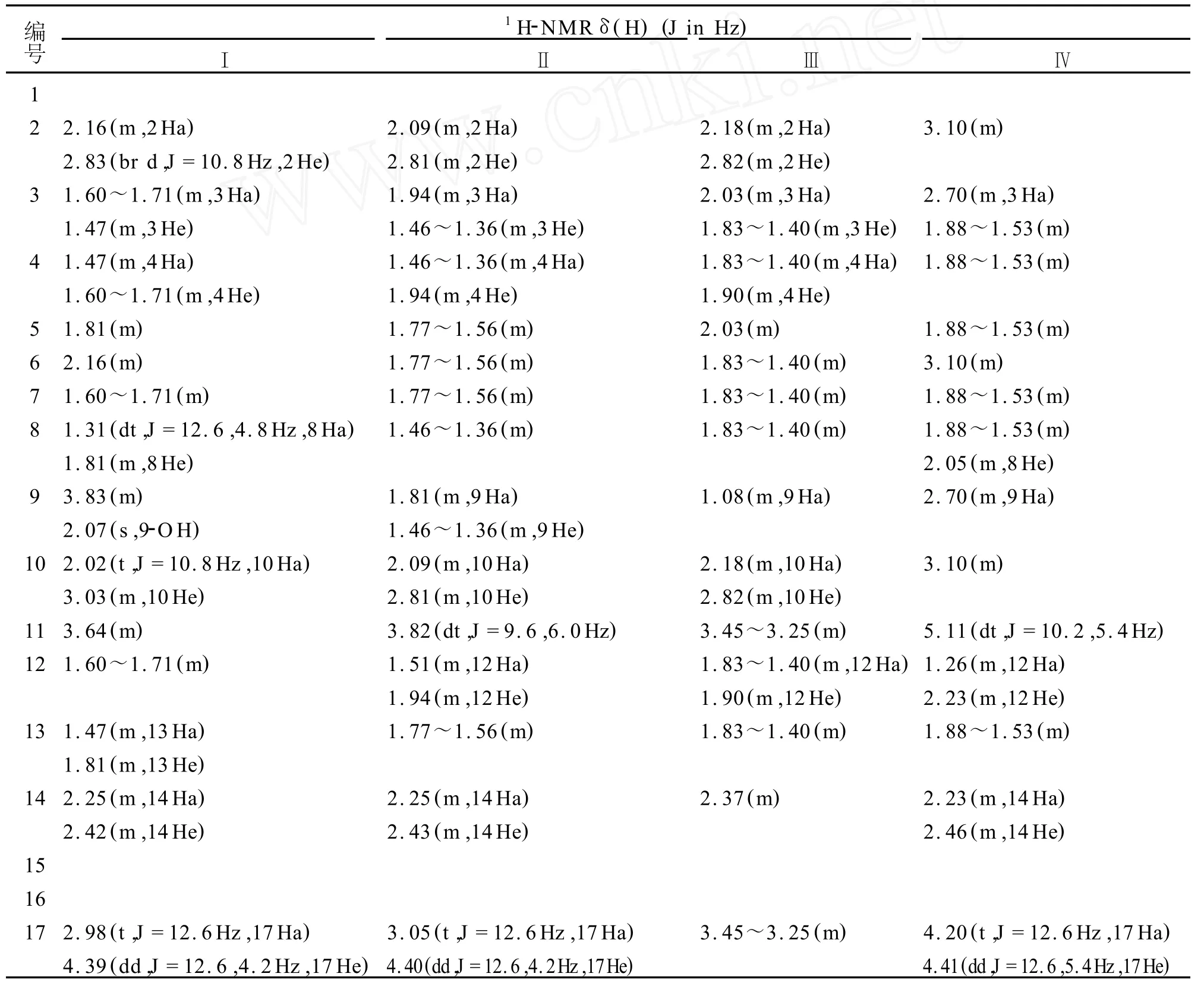
表1 化合物Ⅰ-Ⅳ的′H-NMR(600 MHz in CDCl3)数据Tab.11H-NMR(600 MHz in CDCl3)Data forⅠ,Ⅱ,Ⅲand Ⅳ

表2 化合物Ⅰ-Ⅳ的13C-NMR(150 MHz in CDCl3)数据T ab.213C-NMR(150 MHz in CDCl3)DataforⅠ,Ⅱ,Ⅲand Ⅳ
4 小结
通过对新疆苦豆子种子中生物碱类化学成分进行研究,结果从中分离得到4个化合物。根据化合物的理化性质及光谱数据,分别鉴定为9α-羟基苦参碱(Ⅰ)、苦参碱(Ⅱ)、槐定碱(Ⅲ)、氧化苦参碱(Ⅳ)。其中化合物Ⅰ为首次从本植物中分离得到。本研究为进一步对新疆苦豆子资源的开发利用提供了理论依据。
[1]祁燕蓉,何生虎,史光亮.苦豆子的研究进展[J].甘肃畜牧兽医,2008,38(6):36-38.
[2]江苏新医学院.中药大辞典[M].2版.上海:上海科技出版社,2006:1293-1294.
[3]董亮,赵长新,窦少华,等.苦豆子生物碱生产工艺优化[J].大连轻工业学院学报,2005,24(4):266.
[4]Negrete R,Cassels B K,Eckhardt G,et al.(+)-9α-Hydroxymatrine from Sophora macrocarpa[J].Phytochemistry,1983,22:2069-2072.
[5]张兰珍,李家实,皮特·豪佛顿,等.苦豆子种子生物碱成分研究[J].中国中药杂志,1997,22(12):740-743.
[6]邓银华,孙丽,章为,等.山豆根细胞毒活性成分研究[J].天然产物研究与开发,2006,18:408-410.
[7]张宏利,杨清娥,韩崇选,等.苦参杀鼠活性成分研究[J].兰州大学学报:自然科学版,2007,43(3):90-95.
Chemical Constituents from the Seeds ofSophora AlopecuroidesL.
GAO Hongying1,LI Guoyu1,WANG Hangyu1,WANGJinhui1,2
(1 School of Pharmacy,Shihezi University/Key Laboratory of Phytomedicine Resources&Modernization of TCM,Shihezi 832002,China;2 School of Traditional Chinese Materica Medica,Shenyang Pharmaceutical University,Shenyang 110016,China)
To study the chemical constitutes from the seeds ofSophora alopecuroidesL,compounds were separated by colomn chromatography on silica gel,aluminium oxide and Sephadex L H-20.The structures were elucidated by spectral analyses and physicochemical properties.Four compounds were obtained and were identified as 9α-hydroxymatrine(Ⅰ),Matrine(Ⅱ),Sophoridine(Ⅲ),Oxymatrie(Ⅳ).Compound Ⅰwas isolated from the seeds ofSophora alopecuroidesL.for the first time.
Sophora alopecuroidesL;Alkaloid;Structure identification.
R93 < class="emphasis_bold">文献标识码:A
A
2010-05-20
中国科学院西部之光课题(RCPY 200707)
高红英(1985-),女,硕士生,专业方向为天然药物化学及药理学研究。
王金辉(1972-),男,教授,从事天然药物化学及中药炮制研究;e-mail:wangjh1972@vip.sina.com。

