阿德福韦酯糖精共晶形成的热力学
张建军 祖 卉,* 高 缘
(1中国药科大学药剂教研室,南京210009;2中国药科大学中药制剂教研室,南京210009)
阿德福韦酯糖精共晶形成的热力学
张建军1祖 卉1,*高 缘2,*
(1中国药科大学药剂教研室,南京210009;2中国药科大学中药制剂教研室,南京210009)
测定不同温度下阿德福韦酯(AD)在系列浓度糖精(SAC)乙醇溶液中的溶解度及AD在恒温下系列浓度糖精水溶液中的溶解度,研究AD-SAC共晶形成的热力学,得到了共晶的溶度积(Ksp)、络合常数(K11)及反应自由能(ΔG0)等热力学参数,建立了不同温度下的AD-SAC-乙醇三相图.结果表明:在乙醇中,温度对Ksp和K11有极显著性影响(P<0.01),随着温度的降低,Ksp逐渐减小,K11增大,共晶的溶解为吸热过程,共晶的形成为吸热的自发过程,温度的下降有利于增加AD与SAC在乙醇中的络合效应.AD在SAC水溶液中的溶解度随SAC浓度的升高呈现三阶段特征,先线性增长至平台区后再倒数下降.
阿德福韦酯;糖精;共晶;溶解度;热力学
Abstract: The solubilities of adefovir dipivoxil(AD)in saccharin(SAC)ethanolic solutions at different temperatures and in SAC aqueous solutions at constant temperature were determined to investigate the thermodynamic characteristics of AD-SAC co-crystals.The solubility products(Ksp),complexation constants(K11),and Gibbs free energy(ΔG0)were calculated.Ternary phase diagrams of the AD-SAC-ethanol systems at various temperatures were established.We demonstrate that temperature has significant influence on theKspandK11in ethanolic solution.Kspdecreased andK11increased with a decrease in temperature.Dissolution of the co-crystals in ethanol is an endothermic process.Co-crystal formation is a spontaneous and endothermic process.A decrease in temperature favors complexation between the AD and SAC in ethanol.In aqueous solutions of SAC,the solubility of AD shows a threestage profile with a platform.
Key Words:Adefovir dipivoxil;Saccharin;Cocrystal;Solubility;Thermodynamics
1 引言
药物共晶是指活性药物成分(API)和共晶形成物(CCF)在氢键或其他非共价键的作用下结合而成的晶体.1药物共晶可以用于改进药物性质,包括提高溶解度和溶出速率、提高化学稳定性、改善生物利用度等.2,3
阿德福韦酯(9-{2-[双(新戊酰氧甲氧基)磷酯甲氧基]乙基}腺嘌呤)是阿德福韦的前体,在体内水解为阿德福韦而发挥抗病毒作用.4阿德福韦酯属多晶型药物,研究表明其为热不稳定性药物,易于水解,各种晶型在固体状态下均具有较低的稳定性.5为了改善其稳定性,我们前期已经成功制备了阿德福韦酯与糖精的化学计量比为1:1的阿德福韦酯糖精共晶,对其物理化学性质进行了研究,并与目前阿德福韦酯市售制剂(贺维力片剂)中所采用的晶型1进行了物理化学性质比较,结果表明,阿德福韦酯糖精共晶较晶型1(贺维力片剂中阿德福韦酯的晶型)的化学稳定性和溶出特性有极显著的提高.40°C下放置6个月后,晶型1的粉末结块,并几乎降解完全,而共晶的外观及含量均没有明显变化.在水和磷酸盐缓冲液(pH 6.8)的介质中,共晶的溶出度明显优于晶型1,25°C 45 min的溶出度分别由(62.0±5.1)%、(47.2±1.4)%增加至(97.7±2.6)%、(95.6±1.9)%.
从共晶的热力学研究可以得出API及CCF构成的体系在不同环境下最稳定的组成和状态,从本质上阐明不同固体形态之间的转变情况及各形态的稳定性,为共晶筛选提供参考,亦对药品储存条件下晶体的物理稳定性(晶型转变)以及有效期确定有指导意义.此外,可依据热力学研究结果对与药物形成共晶的组分进行选择.Rodriguez-Hornedo等6通过绘制卡马西平-烟酰胺共晶的溶解度相图,确定了常温结晶的共晶制备方法.Jayasankar等7对CBZ-4ABA共晶的溶解度相图及三元相图进行了研究,确立了影响共晶形成及稳定的因素及条件.此外共晶的三元相图也可用于新共晶的发现及制备溶剂的筛选.8,9
在晶体的制备及储存中,温度是重要的因素.但目前在共晶研究中少见对温度的考察,因此,本文通过不同温度下阿德福韦酯溶解度的测定,计算乙醇中共晶的溶度积、络合常数及反应自由能,并通过绘制阿德福韦酯-糖精-乙醇的三元相图,为共晶制备方式的确立提供理论依据.此外,还考察了形成共晶对药物水溶解度的影响,并建立数学模型对不同阶段来进行描述.
2 实验部分
2.1 试剂和仪器
所用试剂有阿德福韦酯,晶型1,纯度99.2%,浙江贝得药业有限公司;糖精,纯度98.0%,天津市光复精细化工研究所;乙醇,分析纯,国药试剂化学有限公司;甲醇,色谱纯,江苏汉邦科技有限公司;其余试剂均为分析纯.
所用仪器有85-2型恒温磁力搅拌器,上海司乐仪器厂;ZD-85恒温振荡器,常州国华仪器有限公司;Shimadzu高效液相仪(LC-10AD泵,SPD-10A检测器,Shimazu LC Solution色谱工作站),Shimadzu,Japan.
2.2 实验方法
2.2.1 不同温度下不同浓度SAC乙醇溶液中AD溶解度的测定
分别取5、20、35、55、75、90、110、130和150 mg SAC加入至5 mL乙醇中,搅拌溶解,各加入过量的AD,密封后置不同温度(-18-45°C)下恒温振荡72 h,混悬液经0.22 μm微孔滤膜过滤,取续滤液用甲醇适度稀释,溶液中AD和SAC的浓度采用高效液相色谱法(HPLC)法测定.每个实验重复3次.HPLC法的流动相为0.02 mol·L-1KH2PO4(pH 6.0)-甲醇(42:58,体积比),色谱柱为Shimadzu VP-ODS(4.6 mm×150 mm,5 μm),流速为1.0 mL·min-1,检测波长为260 nm.
2.2.2 乙醇中AD及SAC溶解度的测定
于1 mL乙醇中加入过量的AD或SAC,密封后置不同温度下恒温振荡.72 h后将混悬液用0.22 μm微孔滤膜过滤.每个试验重复3次.采用上述HPLC方法测定溶液中AD和SAC的浓度,计算AD及SAC的溶解度.
2.2.3 不同浓度SAC的水溶液中AD溶解度的测定
取200 mg SAC置100 mL量瓶中,加水溶解后定容,得到SAC储备液.分别取不同体积的SAC储备液用水稀释至所需浓度.将过量的AD加入至上述SAC溶液中,密封后置25°C恒温磁力搅拌4 h以达到溶解平衡.混悬液经10000 r·min-1离心5 min,上清液用流动相适度稀释后采用上述HPLC法测定AD浓度,计算AD溶解度.每个SAC浓度下的实验重复3次.
3 结果与讨论
3.1 温度对阿德福韦酯糖精在乙醇中的络合常数与溶度积的影响
建立了用HPLC法同时测定AD与SAC的性质,在该色谱条件下,AD与SAC分离度>10.AD与SAC分别在 161.92-242.88 μg·mL-1及 60.48-90.72 μg·mL-1范围内线性良好(r分别为0.9990和0.9995).该方法同时测定AD和SAC的准确度高,重复性好.
不同温度(-18-45°C)下AD在不同浓度的SAC乙醇溶液中的溶解度测定结果见图1.由图1可知,AD的溶解度随温度的升高而增大,随溶液中SAC浓度的升高而降低.SAC的加入使AD由于形成共晶而溶解度下降,表明共晶有类似盐的同离子效应.因此在制备共晶时,适当过量的SAC有利于产率的提高.
由于共晶的溶解及两种组分在溶液中可能发生的络合,在AD-SAC-乙醇三元体系中,存在如下平衡:

其中K11为络合常数,Ksp为溶度积.
体系中AD的浓度[AD]和SAC的浓度[SAC]的关系式如下:10
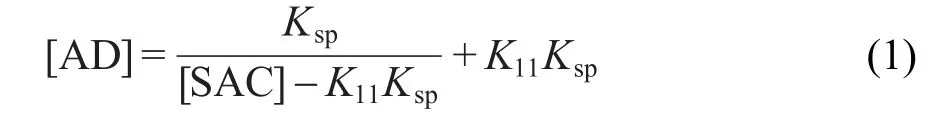
依据方程(1),将不同温度下乙醇溶液中AD溶解度与SAC浓度进行拟合,计算得到AD-SAC共晶的溶度积Ksp及络合常数K11,结果见表1和表2.将溶解度实测值与拟合值进行比较,结果见图2,表明采用公式(1)计算所得的拟合曲线与测定数据有很好的吻合性.从表2可看出,温度对溶度积Ksp有显著影响(P<0.01,P为方差分析用的概率),随着温度的降低,Ksp逐渐减小,说明温度越低,共晶越易析出,共晶的溶解为吸热过程.另外,AD与SAC在乙醇中存在络合效应,K11随温度升高而减小,表明温度越高,AD和SAC的络合作用越弱.
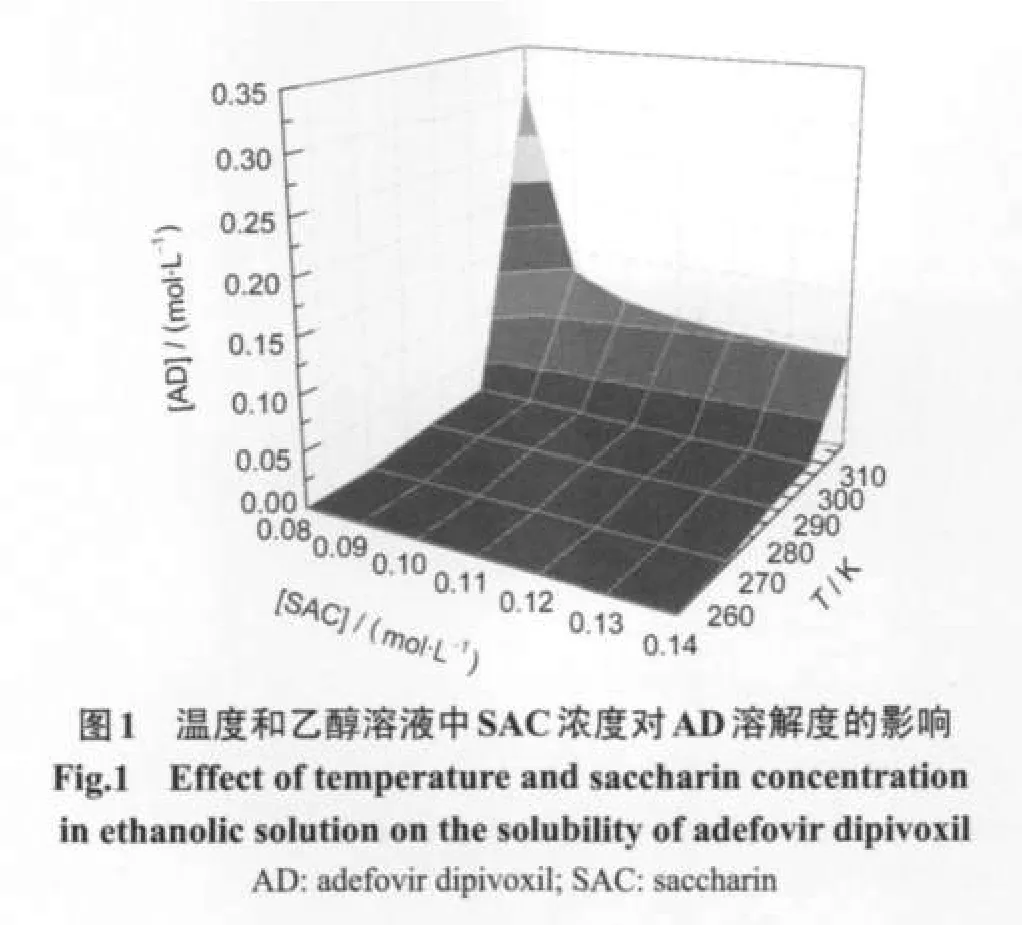

表1AD溶解度与SAC浓度的非线性拟合结果Table 1 Non-linear fitting analysis about the concentrations ofAD and SAC
溶度积是与共晶的溶解度正相关的参数.ADSAC的溶度积随温度的升高而减小,说明了共晶的溶解度亦随温度的升高而增大.而络合常数反映了溶剂中共晶的两组分之间作用力的大小.AD与SAC的络合常数随温度的升高而减小,说明在乙醇中,温度越高,AD与SAC的相互作用就越大.络合常数与溶度积的变化趋势相反,说明在溶度积较低时,也就是溶解度较低时,物质之间的络合作用较大.因为溶解度越低,溶质-溶剂的相互作用越小,而溶质-溶质的相互作用越大,则共晶越容易形成.
3.2 共晶形成的反应自由能(ΔG)的计算
共晶形成的ΔG反映了药物、共晶形成物以及共晶之间的能量大小,是评价反应体系中,各组分相对稳定性的最可靠的指标.当ΔG0为负时,共晶是最稳定的形态,即反应自发向共晶生成的方向移动,体系有利于共晶生成;当ΔG0为正时,药物或者共晶形成物较稳定,此时体系有利于单组分晶体的形成.
AD与SAC形成AD-SAC共晶物的反应为:
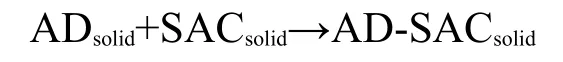
根据反应方程式,存在:11
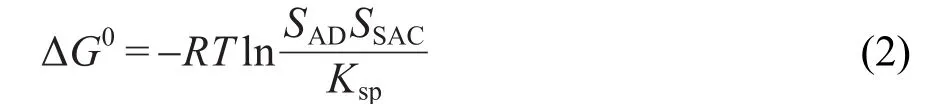
其中SAD和SSAC分别表示AD与SAC的溶解度.
由此可得在各温度下AD-SAC共晶形成反应的ΔG0,结果见表3.不同温度下反应的ΔG0均为负值,表明在实验温度下,反应向共晶生成的方向进行,共晶的形成在热力学上为自发过程,并且随着温度的变化,ΔG0无明显变化.

表2 不同温度下AD-SAC共晶的溶度积Ksp及络合常数K11Table 2 Solubility product constant(Ksp)and complexation constant(K11)ofAD-SAC cocrystal at various temperatures
共晶形成的反应自由能的计算对选择反应溶剂、控制反应温度有重要意义.根据公式(2),反应物与生成物的溶解度因溶剂的不同而有差异,它直接影响了反应自由能的大小.且自由能亦受到反应温度的影响.因此,需要选择合适的溶剂,并控制一定的反应温度,使得反应自由能为负,方可保证共晶产生的可能性.本文中共晶形成的反应自由能为负值,反应自发进行,说明在实验条件下,AD、SAC与乙醇组成的体系中,AD-SAC共晶是与AD及SAC相比最稳定的固体形态.也就是说,在此体系中,反应平衡将向着有利于生成共晶的方向移动.AD-SAC的制备工艺也证实了这一点,将AD投入SAC的乙醇溶液中,共晶可以自发地沉淀出来.
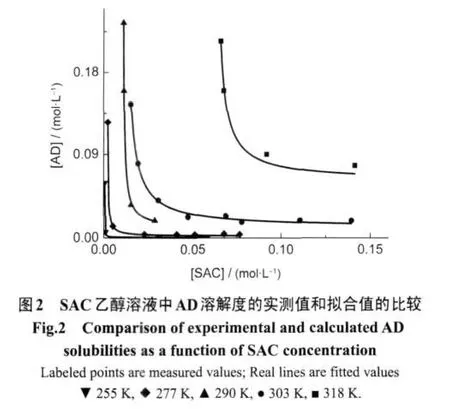

表3AD-SAC共晶形成Gibbs自由能Table 3 Gibbs free energy ofAD-SAC co-crystal formation
3.3 AD-SAC-乙醇三相图的绘制
相图提供了反应体系变化的最直观的信息,从相图中可得到体系可能出现的物质的种类、相态、以及它们随温度的变化情况.
根据AD及SAC在乙醇中的溶解度,AD在SAC乙醇溶液中的溶解度,绘制得到各温度下AD-SAC-乙醇的三元相图,见图3.
以318 K的三相图(E)为例,图3(E)中a、d点分别表示AD和SAC的饱和溶液;e点表示AD-SAC共晶;b点和c点是三相点,b点表示被共晶和AD饱和的溶液体系,c点表示被共晶和SAC饱和的溶液体系.bc段为AD及SAC在乙醇中的溶解度曲线.假设体系中加入少量的AD或SAC分别对SAC或AD的溶解度没有影响,则ab和cd段分别可利用AD和SAC在乙醇中的溶解度绘制.区域1、2、3分别表示固态共晶、固态AD、固态SAC与其饱和溶液的两相平衡区;区域4表示固态共晶、固态AD与其饱和溶液的三相平衡区;区域5表示固态共晶、固态SAC与其饱和溶液的三相平衡区;区域6是不饱和溶液的单相区.12

由图3可知,AD的溶解度随温度变化较SAC明显,温度降低,AD与SAC的溶解度更加接近,共晶区域也更加对称,从含有nAD:nSAC为1:1的乙醇溶液中蒸发溶剂得到的共晶纯度就更高.其次,在不同温度下,共晶的溶解度曲线均可与满足摩尔比组成的直线相交,说明从组成满足摩尔比的溶液中蒸发溶剂可得共晶物,而不会受到两种物质分别结晶的干扰.图3还表明,温度对相图中各区域的大小有显著影响,温度越低,AD、SAC及共晶物在乙醇中的溶解度越小,不饱和溶液的单相区越小,表明降温结晶有利于共晶物的生成,这与上文所述温度降低,Ksp减小,共晶物易于析出这一结论一致.
不同温度下的三元相图描述了共晶物的形成区域,表明对于AD、SAC与乙醇组成的体系,若采用降温析晶并辅以蒸发溶剂的制备方法,可有效地提高共晶的产率.
3.4 SAC对AD水中溶解度影响
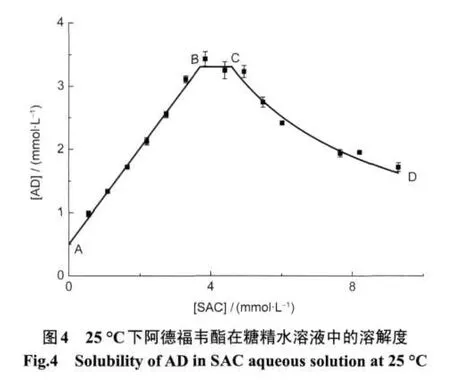
以水溶液中SAC的浓度为横坐标,测得的AD浓度为纵坐标作图得图4.
图4表明了共晶形成物SAC的加入对药物AD在水中溶解度的影响,整个曲线存在A、B、C和D四个特殊点及三个线段,它们分别表示如下:13
A点:AD的饱和水溶液,存在AD(aq)和AD(s),此时体系中AD的浓度即为自身的溶解度;AB段:SAC的浓度不断增加,在水中与AD结合为ADSAC,使AD渐渐进入溶液,存在AD(s,aq)、SAC(aq)和AD-SAC(aq);B点:溶液中AD及AD-SAC均处于恰好饱和的状态,存在AD(s,aq)和AD-SAC(aq);BC段:由于AD-SAC已饱和,故随SAC加入浓度的增加,AD-SAC析出,溶液外的AD继续进入溶液中,存在AD(s,aq)和AD-SAC(s,aq),此时体系中AD的浓度即为共晶的溶解度;C点:AD在溶液中已达到最大浓度,并且即使有多余的固体AD在溶液外,也将不再进入溶液中,存在AD(aq)和AD-SAC(s、aq);CD段:随着加入的SAC不断增多,AD-SAC逐渐析出,存在AD-SAC(s、aq).
将三个阶段水溶液中AD和SAC的浓度不同的数学模型进行拟合,根据其相关系数的大小,得到三个阶段的拟合模型方程如下:
AB段:[AD]=0.77×[SAC]+0.50 r=0.9970
BC段:[AD]=3.30
CD段:[AD][SAC]=15.07 r=0.9765在曲线的不同段,根据物质存在状态,体系中分别存在如下平衡:
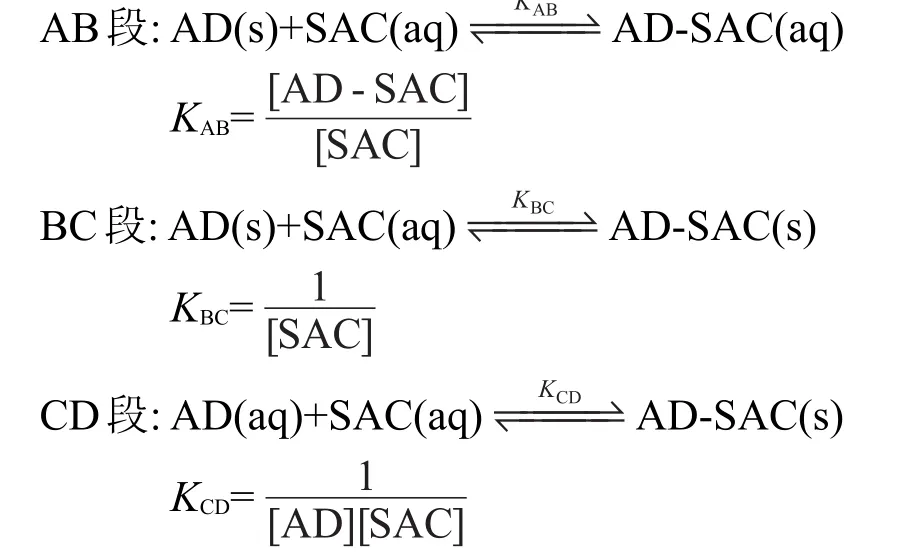
KAB、KBC和KCD分别表示AB、BC和CD段体系的平衡常数.其中KAB表示SAC对AD溶解度改善能力的大小;KBC只与共晶的溶解度有关,反映SAC的最大助溶效果;KCD是水中AD与SAC溶度积的倒数.
根据BC段拟合模型方程及平衡常数数学关系式,可计算出BC段的平衡常数KBC=0.3030 L·mmol-1.根据CD段拟合模型方程及平衡常数数学关系式,可计算出CD段的平衡常数KCD=0.066 L2·mmol-2.
AD与SAC在水中的络合常数

由于共晶AD-SAC的形成,溶解度在初始阶段显著增大.随着SAC浓度的升高,由于AD与SAC之间的络合效应以及共晶具有与盐类似的同离子效应,使得AD的溶解度呈现先线性增长后倒数下降的趋势.
4 结论
通过测定不同温度及共晶形成物SAC对阿德福韦酯溶解度的影响,得到了共晶的溶度积、络合常数及反应自由能等热力学参数,结合阿德福韦酯-糖精-乙醇的三元相图绘制,表明了AD与SAC在乙醇中存在络合效应,温度越高,AD和SAC的络合作用越弱.AD-SAC共晶热力学具有如下特征:(1)溶解为吸热过程;(2)共晶的形成在热力学上为自发过程;(3)有类似盐的同离子效应.热力学研究为AD-SAC共晶研究提供了理论依据,也为将来研究其他药物的共晶研究奠定了基础.
(1) Lara-Ochoa,F.;Espinosa-Perez,G.Supramol.Chem.2007,19,553.
(2) Gao,Y.;Zu,H.;Zhang,J.J.Prog.Chem.2010,22,829.[高 缘,祖 卉,张建军.化学进展,2010,22,829.]
(3) Rodriguez-Hornedo,N.;Nehm,S.;Jayasankar,A.Cocrystals:Design,Properties,and Formation Mechanisms.1st ed.;Informa Healthcare USA,Inc:New York,2007;pp 615-635.
(4) Patrick,M.N.Engl.J.Med.2003,348,808.
(5) Starrett,J.;Tortolani,D.;Russell,J.;Hitchcock,M.;Whiterock,V.;Martin,J.;Mansuri,M.J.Med.Chem.1994,37,1857.
(6) Rodriguez-Hornedo,N.;Nehm,S.;Seefeldt,K.;Pagan-Torres,Y.;Falkiewicz,C.Mol.Pharm.2005,3,362.
(7) Jayasankar,A.;Reddy,L.;Bethune,S.;Rodriguez-Hornedo,N.Cryst.Growth Des.2009,9,889.
(8) Chadwick,K.;Davey,R.;Sadiq,G.;Cross,W.;Pritchard,R.Cryst.Eng.Commun.2009,11,412.
(9) Ainouz,A.;Authelin,J.;Billot,P.;Lieberman,H.Int.J.Pharm.2009,374,82.
(10) Nehm,S.;Rodriguez-Spong,B.;Rodriguez-Hornedo,N.Cryst.Growth Des.2006,6,592.
(11) Schartman,R.Int.J.Pharm.2008,365,77.
(12) Chiarella,R.;Davey,R.;Peterson,M.Cryst.Growth Des.2007,7,1223.
(13) Martin,A.Physical Pharmacy.4th ed.;Lea&Febiger:Philadelphia,1993;pp 265-268.
Formation Thermodynamics of Adefovir Dipivoxil-Saccharin Co-Crystals
ZHANG Jian-Jun1ZU Hui1,*GAO Yuan2,*
(1Department of Pharmaceutics,China Pharmaceutical University,Nanjing 210009,P.R.China;2Department of Chinese Medicine Pharmaceutics,China Pharmaceutical University,Nanjing 210009,P.R.China)
O642
Received:September 25,2010;Revised:November 24,2010;Published on Web:February 17,2011.
∗Corresponding authors.GAO Yuan,Email:highmorepharm@gmail.com;Tel:+86-13951974969.ZU Hui,Email:zuhuinj@gmail.com;Tel:+86-13915967508.
The project was supported by the Technology Platform for New Formulation and New Drug Delivery System,Important National Science&Technology Specific Projects,China(2009ZX09310-004,2011ZX09201-101-02).
国家重大新药创制科技重大专项新制剂与新释药系统技术平台项目(2009ZX09310-004,2011ZX09201-101-02)资助

