发酵乳中ACE抑制肽生成的外部因素条件的研究
姜瞻梅,吴 刚,霍贵成,田 波
(东北农业大学乳品科学教育部重点实验室,东北农业大学食品学院,黑龙江哈尔滨150030)
发酵乳中ACE抑制肽生成的外部因素条件的研究
姜瞻梅,吴 刚,霍贵成,田 波
(东北农业大学乳品科学教育部重点实验室,东北农业大学食品学院,黑龙江哈尔滨150030)
探讨了促进发酵乳中ACE抑制肽生成的外部因素条件。研究结果表明,菌株发酵凝乳(pH 4.7~5.0)后,产生肽量迅速积累,ACE抑制活性大幅度增强,产生的肽量与ACE抑制活性具有正相关性。添加乳清蛋白和酪蛋白可提高发酵乳中的肽含量,添加酪蛋白组更为突出;添加乳清蛋白组肽粉ACE抑制活性减弱,而添加酪蛋白组肽粉ACE抑制活性增强。与发酵温度42℃相比,37℃发酵条件下有利于发酵乳ACE抑制肽生成;与4℃冷藏处理相比,37℃条件下保温培养对提高ACE抑制活性和肽含量更为显著(P<0.01),实验结果为发酵法生产ACE抑制肽提供了可靠的技术依据。
ACE抑制活性,ACE抑制肽,发酵乳,影响因素
ACE抑制肽是一类具有ACE抑制活性的多肽物质,对ACE的亲合度比血管紧张素Ⅰ或舒张激肽还要强,而且也较不易从ACE结合区释放,从而阻碍ACE催化血管紧张素Ⅰ水解成为血管紧张素Ⅱ,以及催化舒缓激肽水解成为失活片段的两种生化反应过程,起降血压作用[1-2]。近年来,国外有许多关于发酵法制备乳源ACE抑制肽的研究报道,最早Yamamoto等[3]研究得出瑞士乳杆菌发酵乳的ACE抑制活性和肽含量比其它乳酸菌菌株高。随后Nakamura等[4]以Lactobacillus.helveticus和 Saccharomyces.cerovisiae菌株作为乳发酵剂制成Calpis酸乳,并纯化出两个ACE抑制肽;相继许多研究者报道了制备具有不同ACE抑制活性的酸乳[5-7],同时也证实了酸乳的抗高血压活性。但是,对于影响发酵乳中ACE抑制肽生成的关键因素和机理方面研究较少,不系统。因此,本文详尽地研究影响发酵乳中ACE抑制肽生成外部因素,旨在为工业化生产具有强ACE抑制活性的酸乳制品提供技术支撑。
1 材料与方法
1.1 材料与仪器
乳酸菌菌株 由乳品科学教育部重点实验室提供;血管紧张素转化酶(ACE)、马尿酰组氨酰亮氨酸(HHL)、OPA(邻苯二甲醛) Sigma公司,美国;无抗脱脂乳粉 新西兰进口。
XW-80A型旋涡混合器 上海医科大学仪器厂;UV-2401PC型分光光度计 日本岛津株式会社;Delta320 pH计 梅特勒-托利多仪器(上海)有限公司;CS202型电热保温干燥箱 重庆实验设备厂。
1.2 实验方法
1.2.1 具有ACE抑制活性的发酵乳制备 将活化后的 瑞 士 乳 杆 菌 KLDS1.0485 和 干 酪 乳 杆 菌KLDS1.0486冻干粉,以1%的接菌量,转接至11%脱脂乳中,混匀后置37℃培养箱,培养至各菌株全部凝乳为止。将凝乳后的脱脂乳采用OPA法测定肽含量,同时采用高效液相色谱方法测定不同菌株发酵乳的ACE抑制活性。
1.2.2 发酵乳中ACE抑制活性的测定 本实验在Wu等[8]的测定方法基础上进行了修改,具体方法如下:将菌株发酵后的脱脂乳在6000×g离心20min,取上清液,加1mol/L NaOH调其pH为8.3,然后按照高效液相色谱法测定发酵乳ACE抑制活性。具体方法如下:取120μL马尿酰组氨酰亮氨酸(HHL)底物液,加入20μL抑制剂混合均匀,然后加入10μL ACE(血管紧张素转化酶)酶液充分混合,在37℃条件下保温60min后,再加入150μL的1mol/L HCl中止反应,得到反应液。该反应液用0.45μm滤膜过滤后在HPLC系统自动进样分析。同时用10μL pH8.3的硼酸缓冲液替代抑制剂溶液作为空白对照组。ACE抑制活性计算公式如下:
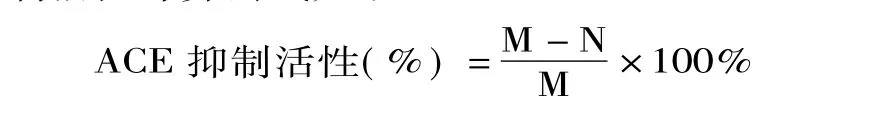
式中:M为空白对照组中马尿酸的峰面积(mAU·s);N为添加抑制剂组中马尿酸的峰面积(mAU·s)。1.2.3 发酵乳中肽含量的测定 参照Church等[9]的方法,100mL邻苯二甲醛(OPA)试剂溶液中含有50mL 100mmol/L四硼酸钠溶液、5mL 20%(wt/wt)SDS溶液、80mg OPA(溶于2mL甲醇)、200μL β-巯基乙醇。将发酵后的脱脂乳搅匀后取1mL,加入2mL 0.75mol/L三氯乙酸溶液,混匀。6000×g离心5min后,取上清液备用。取100μL双蒸水,加入200μL 0.75mol/L三氯乙酸溶液、6mL OPA试剂后混匀,作为空白对照。取100μL样品离心后的上清液,加入2mL OPA试剂,混匀后于340nm波长下检测其吸光值。用胰胨作为标准品,配制梯度稀释溶液。取100μL标准样品,加入2mL OPA试剂,混匀后于340nm波长下检测其吸光值。绘制氨基酸或肽浓度与吸光度的标准曲线,计算样品中的肽含量。
2 结果与分析
2.1 单一菌株发酵特性
瑞士乳杆菌 KLDS1.0485和干酪乳杆菌KLDS1.0486在0~32h发酵过程中的pH与其ACE抑制活性或肽含量的变化关系见图1和图2。

图1 瑞士乳杆菌KLDS1.0485发酵过程中pH与ACE抑制活性或肽含量的关系
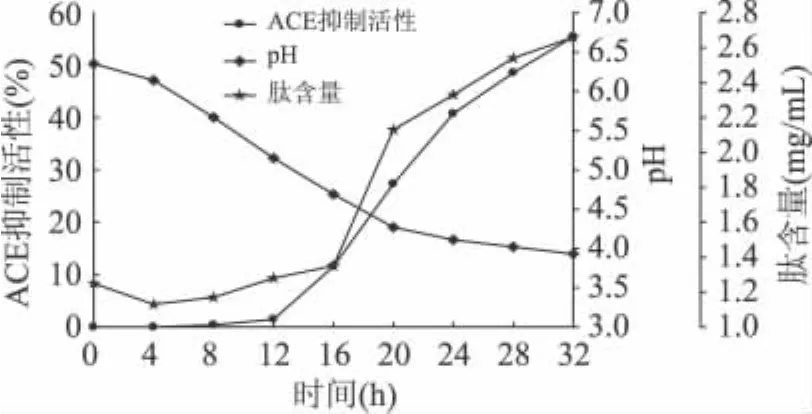
图2 干酪乳杆菌KLDS1.0486发酵过程中pH与ACE抑制活性或肽含量的关系
对图1和图2结果分析可知,在发酵初期,菌株产酸量小,也就是脱脂乳未凝乳前,发酵乳中的ACE抑制活性很弱,肽含量较低,并且保持较低水平几乎不变或改变较小。但是当发酵乳的pH降至4.7~5.0时,开始凝乳以后,发酵乳中产生的肽量迅速积累,ACE抑制活性大幅度提高。这充分说明发酵乳凝乳后,可促进肽迅速生成,ACE抑制活性快速增强,另一方面也表明了乳酸菌菌株凝乳后有利于发酵乳中ACE抑制肽的产生。同时研究分析发现,单一菌株发酵脱脂乳后,发酵乳中肽含量增加,ACE抑制活性也随着增强,这可证实发酵乳中的肽量与其ACE抑制活性具有一定的正相关性。
2.2 功能性添加物对发酵乳ACE抑制活性的影响
在脱脂乳培养基的基础上,添加不同比例的酪蛋白和乳清蛋白,以组合菌株 KLDS1.0485和KLDS1.0486按照1∶1比例发酵,发酵完成后离心取乳清液冷冻干燥,干燥后称取一定量的肽粉配成相同浓度的溶液,测定其ACE抑制活性。另外直接测定发酵后不同乳清蛋白和酪蛋白的发酵乳中肽含量。添加不同比例酪蛋白和乳清蛋白的组合菌株KLDS1.0485和KLDS1.0486发酵乳的ACE抑制活性和肽含量测定结果见图3。
从图3结果分析可知,培养基中随着添加乳清蛋白比例增加,肽量逐渐增大,而得到的肽粉的ACE抑制活性逐渐减弱;这可能由于发酵菌株对乳清蛋白的利用率不高,发酵乳清液含有较多乳清蛋白,造成肽粉中的肽含量相对较少,以致ACE抑制活性降低。而培养基中随着添加酪蛋白比例增加,发酵乳中产生的肽量比未添加酪蛋白组增加大约1倍(从4.91mg/mL增至8.51mg/mL),得到肽粉的ACE抑制活性逐渐增强,这表明发酵乳中肽类主要来源是乳清蛋白和酪蛋白,尤其是后者。Leclerc等[10]研究发现,添加酪蛋白组的发酵乳比未添加对照组相比,有较强水解活性和ACE抑制活性,这与本实验研究结果相一致。

图3 功能性添加物对发酵乳ACE抑制活性的影响
2.3 发酵温度条件对发酵乳ACE抑制活性的影响
在培养温度为 37℃ 和 42℃条件下由菌株KLDS1.0485和菌株KLDS1.0486共同发酵凝乳后,培养相同时间取出,得到不同培养温度条件下发酵乳的ACE抑制活性和肽含量见表1。

表1 发酵温度对发酵乳ACE抑制活性的影响(¯X±SE)
从表1的T检验结果证实,培养温度为37℃与42℃相比,37℃条件下能极显著地提高发酵乳的ACE抑制活性和肽含量(P<0.01),这说明37℃条件下有利于组合菌株KLDS1.0485+KLDS1.0486发酵乳中的ACE抑制肽的生成。
2.4 贮存条件对发酵乳ACE抑制活性的影响
采用组合菌株KLDS1.0485+KLDS1.0486发酵脱脂乳制得发酵乳,将其分别在4℃冷藏72h和在37℃保温72h后,测定发酵乳中肽含量和发酵乳清中ACE抑制活性,结果如表2。

表2 贮存温度对发酵乳ACE抑制活性的影响(¯X±SE)
表2分析结果表明,与对照组相比,4℃冷藏处理和37℃条件下保温发酵都可提高发酵乳的ACE抑制活性和肽含量(P<0.01),但与4℃冷藏处理相比,37℃条件下保温发酵培养对提高ACE抑制活性和肽含量更为显著(P<0.01)。
3 结论
单一菌株发酵特性证实,凝乳(pH 4.7~5.0)后ACE抑制活性快速增强和肽量迅速积累,肽含量与ACE抑制活性具有正相关性。明确添加乳清蛋白和酪蛋白对发酵乳ACE抑制活性的影响。37℃发酵条件下有利于发酵乳ACE抑制肽生成;与4℃冷藏处理相比,37℃条件下保温发酵培养对提高ACE抑制活性和肽含量更为显著(P<0.01)。
[1]Pihlanto-Leppala A,Rokka T,Korhonen H.Angiotensin IConverting Enzyme Inhibitory Peptides Derived from Bovine Milk Proteins[J].International Dairy Journal,1998,8:325-331.
[2]Nakamura Y,masuda O,Takano T.Decrease of tissue angiotensin-I-converting enzyme activity upon feeding sour milk in spontaneous hypertensive rats[J].Biosci Biotech Biochen,1996,60(3):488-489.
[3]Yamamoto N,Akino A,Takano T.Antihypertensive Effect of the Peptides Derived from Casein by an Extracellular Proteinase from Lactobacillus helveticus CP790[J].J Dairy Science,1994,77:917-922.
[4]Nakamura Y,Yamamoto N,Sakai K,et al.Purification and Characterization of Angiotensin I-Converting Enzyme Ihibitors from Sour Milk[J].J Dairy Science,1995,78:777-783.
[5]YamamotoN,MaenoM,TakanoT.Purification and characterization of an antihypertensive peptide from a ypghurtlike product fermented by Lactobacillus helveticus CPN4[J].J Dairy Science,1999,82:1388-1393.
[6]Minervini F,Algron F,Rizzello C G,et al.AngiotensinI-converting enzyme-inhibitory and antibacterial peptides from Lactobacillus helveticus PR4 proteinase-Hydrolyzed caseins of milk from six species[J].Applied and Environmental Microbiology,2003,69(9):5297-5305.
[7]Geerlings A,Villar I C,Hidalgo Zarco F,et al.Identification and Characterization of Novel Angiotensin-Converting Enzyme Inhibitors Obtained from Goat Milk[J].J Dairy Science,2006,89:3326-3335.
[8]Wu J P,Aluko R E,Muir A D.Imprived method for direct high-performance liquid chromatography assay of angiotensinconverting enzyme- catalyzed reactions[J].Journal of Chromatography A,2002,950:125-130.
[9]ChurchF C,SwaisgoodH E,PorterD H,etal.Spectrophotometric assay using o - phthaldialdehyde for determination of proteolysis in milk and isolated mil proteins[J].J Dairy Science,1983,66:1219-1227.
[10]Leclerc P L,G authier S F,Bachelard H,etal.Antihypertensive activity of casein-entriched milk fermented by Lactobacillus helveticus[J].International Dairy Journal,2002,12:995-1004.
Study on external conditions of angiotensin converting enzyme inhibitory peptide derived from fermented milk
JIANG Zhan-mei,WU Gang,HUO Gui-cheng,TIAN Bo
(Key Lab of Dairy Science(Northeast Agricultural University),Ministry of Education,Food Science&Technology of Northeast Agricultural University,Harbin 150030,China)
External factor condition of antihypertensive peptide derived from fermented milk were studied.During the fermentation experiment of single latic acid bacteria,when the pH range from 4.7 to 5.0 in the fermented milk,peptide concentration increased quickly and ACE inhibitory activity was made stronger.And peptdie and ACE inhibitory activity were with positive correlation.Peptide contents increased in fermented milk with fortified casein and whey,especially fast for the latter.ACE inhibitory activity decreased in the added whey fermented milk,but increased in the added casein fermented milk.Effects of fermentation temperature and preservation temperature were studied.Compared with fermentation at 42℃,there were more antihypertensive peptide production at 37℃.At the same time,compared with preservation at 4℃,there were more ACE activities and higher peptide contents in fermented milk at 37℃(P<0.01).That was provided with technique basis for production of antihypertensive peptide by fermentation.Key words:ACE inhibitory activity;ACE inhibitory peptide;fermented milk;critical factors
TS252.54
A
1002-0306(2011)04-0106-03
2009-12-02
姜瞻梅(1976-),女,博士,副教授,研究方向:乳品加工与畜产品。
2009年黑龙江省教育厅科学技术研究项目(11541020)。

