直肠菌群对两种抗性淀粉的体外发酵研究
庞秋芳,彭喜春,欧仕益,吴希阳
(暨南大学食品科学与工程系,广东广州510632)
直肠菌群对两种抗性淀粉的体外发酵研究
庞秋芳,彭喜春*,欧仕益,吴希阳
(暨南大学食品科学与工程系,广东广州510632)
分别以两种抗性淀粉为唯一碳源,对直肠菌群进行体外发酵。通过研究发现,发酵过程中两种培养基的pH呈逐渐下降的趋势;双歧杆菌属、乳杆菌属的数量呈上升趋势;肠球菌属和肠杆菌属的数量也能保持比较稳定的数量,而拟杆菌的数量在发酵中后期开始减少,但总厌氧菌数比较稳定,因此发酵过程中肯定有不同菌属的生长演替;两种碳源均能被肠道菌群利用产生短链脂肪酸,其中以丙酸的量最大。乳酸在发酵过程中被积累并能快速被一些直肠菌群利用而消耗。
抗性淀粉,体外发酵,肠道菌群,短链脂肪酸
结肠内存在一个非常复杂的微生态系统,含有400多种不同的细菌种类,而肠内菌群微生态的平衡稳定对人体健康有着非常重要的作用。膳食纤维被认为对维持肠道菌群平衡起着重要的作用,而抗性淀粉是膳食纤维中的一种。抗性淀粉[1](resistant starch,RS)是指不能在健康人体小肠中消化吸收的淀粉及其降解物的总称。RS作为一种新型的膳食纤维资源,其自身直接产生的作用较少,这些功效主要通过影响其他物质的吸收代谢,以及在结肠内发酵产生的次生产物而得到发挥。如RS能够改变结肠微生物群落,促进肠道有益微生物繁殖,降低肠道pH、减少腐败物和致癌物的产生、生成B族维生素、促进肠道蠕动、提高人体免疫力等[2]。由于RS可以“逃逸”小肠消化而到结肠内代谢,因此RS对肠道的健康意义,特别是在当今高脂、高蛋白的饮食模式下,显得格外重要。本研究分别采用马铃薯抗性淀粉和红薯抗性淀粉两种可溶性膳食纤维作为唯一碳源,进行体外发酵,观察在不同发酵时间段,RS与人体肠道各菌群生长数量及所产生短链脂肪酸之间的关系,以期发现RS在肠道中更为具体的作用,为以后进一步研究抗性淀粉的结肠发酵作用和健康作用机制提供实验依据。
1 材料与方法
1.1 材料与仪器
BBL培养基(双歧杆菌选择性培养)、MRS培养基(乳杆菌选择性培养)、MAC培养基(肠杆菌选择性培养、KEA培养基(肠球菌选择性培养) 青岛海博生物技术有限公司;血琼脂平板 广州环凯微生物科技有限公司;BDS培养基(拟杆菌选择性培养)
按以下配方配制(1L):牛肉粉5.0g,蛋白胨10.0g,酵母提取物5.0g,Na2HPO44.0g,可溶性淀粉0.5g,葡萄糖 1.5g,L-半胱氨酸 0.2g,胆汁盐 2.5g,亮绿0.0025g,琼脂粉15g;不同培养基的具体用途如表1所示;发酵基础培养基[4]、马铃薯抗性淀粉(potatoresistant starch,PRS)、红薯抗性淀粉(sweet potato resistant starch,SPRS) 自制;乙酸、丙酸、丁酸、异丁酸、乳酸 色谱纯,广州市齐云生物技术有限公司。

表1 不同培养基的选择培养目标
7.0 L厌氧罐 日本三菱;THZ-98A型恒温振荡培养箱 上海一恒科学仪器有限公司;3524-2型CO2培养箱 SHELLAB公司;7890A型气相色谱仪安捷伦。
1.2 实验方法
1.2.1 富集培养基的制备 将上述配好的发酵基础培养基(维生素类溶液除外)pH调为6.8,并分装于总容量为55mL的具刻度离心管中,每管发酵基础培养基量为46.5mL。分别称取0.55g不同碳源(PRS、SPRS、葡萄糖),加入到每46.5mL的发酵基础培养基中,灭菌。按配方[4]将相应维生素类溶液过滤除菌后,分别加入到已灭菌的含有不同碳源的培养基中,充分混匀,即得到总发酵液量为48mL的富集培养基。于4℃放置约12h,使底物(主要是使PRS和SPRS)充分水合。接种前将管置于 37℃ 水浴约30min。
1.2.2 样品采集及准备 本研究的样本来源于3个(2男1女)健康成人的粪便。要求:两个月内未服用抗生素,且无肠道病史。采集每位实验者的新鲜自然粪便50g置于密闭的无菌便盒中,备用。
将50g新鲜粪便用冷蛋白胨水(pH 7.3)500mL稀释,即按1∶10的比例稀释。加几粒无菌玻璃珠涡旋15s使粪粒充分分散开来。稀释的粪便液用4层无菌纱布过滤,并将过滤得到的粪便悬浮液密封于无菌器皿中。
1.2.3 直肠菌群的富集培养 将7mL粪便悬浮液加入到48mL发酵液中,即接种量为13%(发酵液中分别以PRS、SPRS及葡萄糖作为唯一碳源,另外以不加任何碳源的发酵液作为空白对照),旋紧管盖,并于37℃厌氧培养。
1.2.4 发酵液的分段收集及检测 在0、4、8、12、24h分别测上述培养液的pH,并在相应的时间段取不同碳源的发酵液0.1mL,加入到装有0.9mL PBS缓冲液(pH 7.4)的EP管中,混匀。然后,以一定的稀释度将其分别接种于用于选择性培养双歧杆菌、乳杆菌、拟杆菌、肠球菌、肠杆菌和总厌氧菌的BBL、MRS、BDS、KEA、MAC和血琼脂平板选择性培养基上,培养一定时间后细胞计数。平板接种后剩余发酵液分装于各无菌管中,每15mL发酵液中加入0.5mL 20g/L CuSO4中止反应,并放于-20℃用于 SCFAs等的测定。
1.2.5 短链脂肪酸的测定[4]取上述存于-20℃的发酵液,待其解冻后,取2.0mL于一无菌管中,分别加入0.4mL 50%H2SO4和2.0mL乙醚,混匀,于定轨摇床振荡混匀45min,再在室温条件下3000r/min离心5min。取离心后的上清液于灭菌的EP管中,并加入已充分干燥的无水氯化钙以去除残留的水分,之后小心迅速地移取上清液于样品管,用于GC测定。
短链脂肪酸的测定采用外标法,用乙酸、丙酸、正丁酸、异丁酸和乳酸作标准曲线。检测器为氢火焰检测器(FID);气相色谱测定条件:载气为N2,分流比为10∶1;流速2.0mL/min;用DB-FFAP色谱柱;升温程序:120℃维持5min,以15℃/min升到250℃保持1min;燃烧炉温度为280℃,待测样品进样量为2μL。
2 结果与讨论
2.1 不同碳源发酵中pH的变化
由图1可知,以PRS和SPRS为碳源的发酵液pH的变化趋势大致相同,在发酵过程中pH不断下降。其中,以PRS为碳源的发酵,其pH由0h的7.34发酵24h后降为4.74,以SPRS为碳源的发酵pH也由0h的7.33降到了24h的4.87。与阳性对照组葡萄糖比较,葡萄糖下降趋势更快,并且发酵终pH由0h的8.55降为3.75。而无碳源的阴性对照组,pH下降趋势较平缓,由0h的7.83降为24h的7.23。
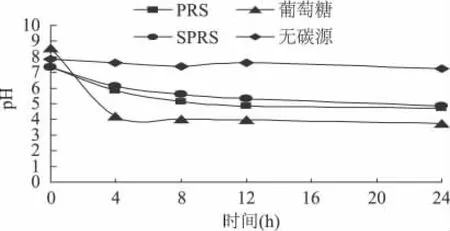
图1 不同碳源发酵过程中pH的变化
由上述结果可看出,葡萄糖是最先能被肠道菌群利用的碳源,PRS和SPRS则次之,但也能在结肠中发酵,从而导致不同的pH变化,其代谢产物并能较好地维持肠道酸性环境。
2.2 发酵中不同菌群的变化
2.2.1 双歧杆菌群和乳杆菌的生长变化 由图2和图3可看出,在以PRS和SPRS为碳源发酵过程中,双歧杆菌和乳杆菌的数量均有明显增加;而以葡萄糖为碳源发酵4h后,双歧杆菌和乳杆菌数量就开始明显减少,可见葡萄糖对它们的生长促进作用不明显。可得出,PRS及SPRS作碳源对双歧杆菌和乳杆菌的生长有益,并能促进它们增殖。
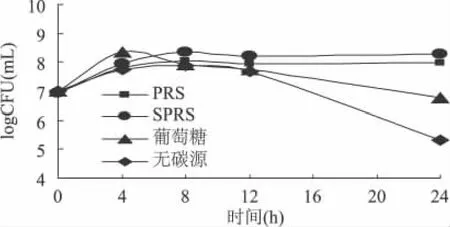
图2 不同碳源发酵过程中双歧杆菌生长情况
2.2.2 拟杆菌群、肠球菌及肠杆菌的生长变化 从图4~图6能很明显地看出,添加葡萄糖的对照组拟杆菌、肠球菌及肠杆菌三种菌群均在发酵4、8、10h后数量开始急速下降;而以PRS和SPRS为碳源的12h后三种菌群的数量才开始缓慢减少。其原因可能是葡萄糖在8h前被快速利用,发酵8h后产生大量SCFAs,pH迅速降为4.03(由图1可知),从而抑制了这三种菌群的生长,当然也有可能是由于碳源的缺乏导致。PRS和SPRS为碳源时,pH在8h前快速下降,10h后下降趋势减缓,由于酸性的积累,致使拟杆菌、肠球菌及肠杆菌三种菌群10h后缓慢减少。但总体来看,PRS和SPRS为碳源发酵时,相对于我们前面对不溶性膳食纤维的研究而言(另文发表),拟杆菌生长在24h后的数量稍有减少,而肠球菌及肠杆菌的数量变化并不显著;无糖对照组菌量的显著变化的主要原因可能是由于碳源的缺乏导致。

图3 不同碳源发酵过程中乳杆菌生长情况

图4 不同碳源发酵过程中拟杆菌生长情况
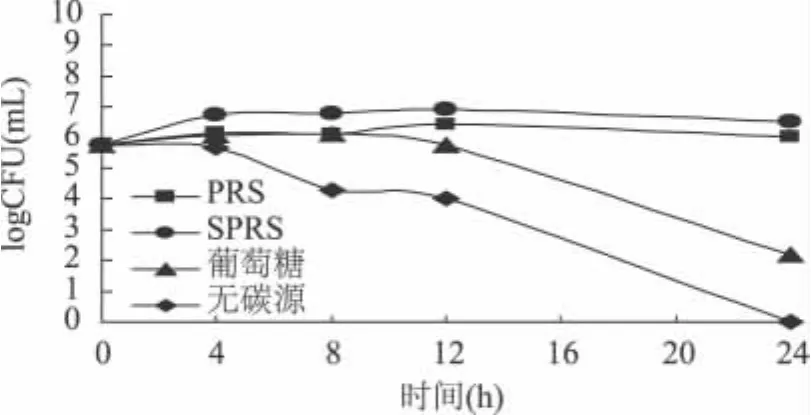
图5 不同碳源发酵过程中肠球菌生长情况

图6 不同碳源发酵过程中肠杆菌的生长情况
2.2.3 总厌氧菌群生长变化 由图7可看出,以PRS和SPRS为碳源的两组,其数量级由0h的7.7分别升到发酵24h后的8.67和8.40,略微有所增加,但总体来说,在整个发酵过程中总厌氧菌保持着相对稳定的状态,原因可能是肠道中各菌群对营养成分的竞争作用,从而导致各菌群的此消彼长,最终维持总菌群数的平衡[5]。而对照组的葡萄糖与无碳源组总厌氧菌数量8h后迅速减少。

图7 不同碳源发酵过程中总厌氧菌的生长情况
2.3 发酵中短链脂肪酸的变化
2.3.1 短链脂肪酸在发酵中的变化 由图8~图9可看出,以PRS为底物发酵时,其产生的乙酸、丙酸、丁酸、异丁酸变化趋势大致相同;以SPRS为底物发酵,其产生的四种短链脂肪酸(除乳酸)变化也趋于一致,并且两种底物都随着发酵时间的持续,短链脂肪酸(SCFA)的量总体呈上升趋势,从而使肠道pH下降,由此与发酵中pH变化(图1)趋势相吻合。比较图8、图9可发现,不论是以PRS还是以SPRS作发酵底物,发酵产生的丙酸量最多,丁酸最少。以PRS和SPRS为底物发酵时,4~8h乳酸量达到最大,之后开始下降,与图2、图3双歧杆菌和乳杆菌数量相对应。原因可能是部分直肠菌群(如双歧杆菌和乳杆菌等)利用PRS、SPRS产生的乳酸可能起到中间产物的作用,为其它肠道菌群的生长提供能量,如硫酸盐还原菌[5],并随着其它菌群的大量繁殖而减少。

图8 马铃薯抗性淀粉发酵过程中SCFAs的变化

图9 红薯抗性淀粉发酵过程中SCFAs的变化
3 结论
人体结肠内存在大量的相互制约、平衡生长的微生物,其中常见的有益菌群为乳酸菌和双歧杆菌,通过其菌体本身、分泌物和代谢产物对肠道健康起着重要的作用,如:抵抗致病菌的侵袭、增强肠道免疫力、营养结肠、预防结肠癌等;其它肠道常驻菌有肠杆菌、肠球菌、拟杆菌等,它们一般为条件致病菌。许多因素可影响肠道内的微生物,如宿主的年龄、易感性、营养需求、免疫状况、肠道pH、胃肠转运时间、菌群之间的相互作用以及肠内可酵解底物的量和种类。在这些因素中,细菌生长所需底物的量和类型是最具有影响的因素[6]。本研究首次将抗性淀粉、短链脂肪酸以及直肠菌群三者的相互关系联系起来,而不仅是研究抗性淀粉与短链脂肪酸之间的关系。从本实验的结果可以看出,不同直肠菌群在两种RS为碳源发酵时,肠球菌、肠杆菌数量变化不大,而拟杆菌数量减少,双歧杆菌及乳杆菌数量显著增加,但总厌氧菌等的数量都能维持比较稳定的水平,说明RS发酵过程中,肯定有不同菌属生长的演替,同时也说明RS在一定程度上能维持肠道菌群的平衡。有研究报道显示,适量给予RS可以较好地改善肠道动力,增加肠道容积,促进肠道有益菌的定植[7],本实验也证实了RS具有益生的功效(可促进有益菌如双歧杆菌、乳杆菌的增殖),这与现有的一些文献报道结果是一致的[2-3,6];由SCFAs的产生引起的pH显著降低并未导致总厌氧菌的数量快速下降,因此可能并不是抑制肠道菌群中致病菌生长的主要原因,这与现有的报道也不尽相同[8],但是它与我们前期对不溶性膳食纤维的研究结果一致(另文发表)。
RS在大肠中被结肠微生物(厌氧菌)发酵或部分发酵后,产生挥发性SCFAs,降低肠道及粪便pH,在主要的3种SCFAs中,以丁酸对结肠细胞的营养作用最强,对人体结肠健康方面起着尤为重要的作用[9-11]。SCFAs的种类和数量和pH、微生物菌群及发酵底物有很大关系[12]。本实验证明,RS都能被不同的直肠菌群利用并产生SCFAs,而且该两种RS被直肠菌群发酵利用时,丙酸的产量明显大于乙酸,这与早期的许多文献[2,13-14]的报道认为乙酸产量最大的结果不一致,至于丙酸的产生与肠道菌群的特殊相关性有待于进一步的研究;乳酸可能是直肠菌群发酵利用RS产生的中间代谢物,能为肠道其它菌群提供能源,这与文献报道的结果是一致的[5,13,15]。在我们的研究中,丁酸的产量较低,也并没有如其它文献报道的比其它膳食纤维发酵所产生的更多[16-17]。
[1]尚晓娅,高群玉,杨连生.抗性淀粉对糖脂以及肠道代谢影响的研究进展[J].食品工业科技,2005,26(4):179-180.
[2]王瑶,邬应龙,岳双明.抗性淀粉对动物肠道代谢的影响[J].饲料工业,2007,28(24):49-50.
[3]Bourquin LD,Titgenmeyer EC,Fahey GC.Fermentation of various dietary fiber sources by human fecal bacteria[J].Nutr Res,1996,16(7):1119-1131.
[4]Schneider SM,Fernand GP,Rodolphe A,et al.Effects of total enteral nutrition supplemented with a multi-fibre mix on faecal short-chain fatty acids and microbiota[J].Clin Nutr,2006,25:82-90.
[5]Vernazza CL,Gibson GR,Rastall RA.In vitro fermentation of chitosan derivatives by mixed cultures of human faecal bacteria[J].Carbohydr Polym,2005,60:539-545.
[6]何梅,洪洁,杨月欣.抗性淀粉对大鼠肠道菌群的影响[J].卫生研究,2005,34(1):87.
[7]Le Blay GM,Michel CD,Blottiere HM,et al.Raw potato starch and short—chain fructo—oligosaccharides affect the composition and metabolic activity of rat intesfinal microbiota differently depending on the caecocolonic segment involved[J].J Appl Microbiol,2003,94:312-320.
[8]郭兴华.益生菌基础与应用[M].北京:北京科学技术出版社,2002:28-30.
[9]Young GP,Le Leu RK.Resistant starch and colorectal neoplasia[J].J AOAC Int,2004,87(3):775-786.
[10]Baue MM,Florian S,Muller SK,et al.Dietary resistant starch type 3 prevents tumor induction by 1,2-dimethylhydrazine and alters proliferation,apoptosis and dedifferentiation in rat colon[J].Carcinog,2006,27(9):1849-1859.
[11]Le Leu RK,Brown IL,Hu Y,et al.Suppression of azoxymethane-induced colon cancer development in rats by dietary resistant starch[J].Cancer Biol& Ther,2007,6(10):1621-1626.
[12]王娅芳,孙晓红.不同膳食成分对人体胃肠道短链脂肪酸的影响[J].预防医学情报杂志,2005,21(4):425.
[13]陈燕,曹郁生,刘晓华.短链脂肪酸与肠道菌群[J].江西科学,2006,24(1):38-41.
[14]Miquel N,Ph D,Daniel MP,et al.Long-term intake of resistant starch improves colonic mucosal integrity and reduces gut apoptosis and blood immune cells[J].Nutr,2007,23:861-870.
[15]于卓腾,杭苏琴,姚文,等.肠道产丁酸细菌及其丁酸产生机制的研究进展[J].世界华人消化杂志,2006,25(14):2533.
[16]Liu Ruiping,Xu Guifa.Effects of resistant starch on colonic preneoplastic aberrant crypt foci in rats[J].Food Chem Toxicol,2008,46:2672.
[17]姚蕊,张守文.抗性淀粉的研究发展现状与前景[J].粮食与食品工业,2006,13(1):31.
Study on fermentation of two resistant starch by colon microflora in vitro
PANG Qiu-fang,PENG Xi-chun*,OU Shi-yi,WU Xi-yang
(Department of Food Science and Engineering,Jinan University,Guangzhou 510632,China)
Potato resistant starch and sweet potato resistant starch were taken respectively as only carbon source to ferment colonic microflora in vitro.The results showed that during the fermentation process in vitro,the pH value of the two culture was gradually decline.In two media with different carbon source,the colonies counts of Bifidobacterium,Lactobacillus showed an upward trend,the number of Enterococcus and Enterobacter remained relatively stable at different fermentation periods,the number of Bacteroides began to reduce in the late of fermentation,and the number of total anaerobic bacterium remained stable.Therefore,the growth succession of different species must be sure in the process of fermentation.The colon microbial could utilize the two carbon sources to produce SCFAs,of which the largest amount was propionate.During the fermentation process lactic acid was accumulated and promptly consumed by colonic microflora.
resistant starch;fermentation in vitro;colonic microflora;short chain fatty acids
TS201.3
A
1002-0306(2011)04-0148-04
2009-12-21 *通讯联系人
庞秋芳(1982-),女,硕士生,研究方向:食品安全。
暨南大学青年基金(51208029)。

