以微流体技术构建纹状体神经元流道图案的形态学研究
罗亚黎, 高 侃, 徐群渊
首都医科大学北京神经科学研究所,北京市神经再生修复研究重点实验室,教育部神经变性病学重点实验室,北京100069
以微流体技术构建纹状体神经元流道图案的形态学研究
罗亚黎, 高 侃, 徐群渊
首都医科大学北京神经科学研究所,北京市神经再生修复研究重点实验室,教育部神经变性病学重点实验室,北京100069
在以微流体技术加工的聚乙烯亚胺 (polyethyleneimine,PEI)及层粘连蛋白 (laminin,LN)混合物材料上,培养纹状体神经元图案式黏附、生长,为制备神经芯片打好基础。以微流体印刷方法在硅片上微加工四种不同的黏附底物:LN、带正电荷的多聚赖氨酸 (poly-L-lysine,PLL)、PEI和PEI+LN混合物。体外分离培养新生乳鼠纹状体神经元,评价神经元在不同图案化黏附底物上的黏附存活、突起生长状态及形成流道图案的差异;在PEI+LN混合物图案中观察不同线间距对构建神经元流道图案的效果。结果表明,在PEI、PLL及PEI+LN图案表面生长的神经元数量明显大于LN组;神经元在PEI+LN混合底物上与单纯PEI、LN、PLL相比更能形成完整的流道图案,在流道间距处于150 μm及200 μm时更为清晰。研究证实,通过微流体微加工后,由PEI与LN混合形成的粘附底物经优化流道图案规格后,能有效地构建神经元流道图案,有利于制备神经芯片。
微流体技术;聚乙烯亚胺;细胞培养
引 言
神经芯片研究,即是在体外图案化培养神经细胞,以研究、控制特定神经细胞的连接和功能行为,在细胞生物学基础研究以及组织工程学、细胞传感、药物筛选和创伤治疗等应用领域都有重要学术意义和应用价值[1,2]。神经芯片研究的关键是要在体外建立能和微电子设备相匹配并具有功能的图案化神经元网络,其首先要解决的问题是神经元须按特定的位置黏附和生长在基底材料上。在这方面,近年来发展的软刻技术为此提供了良好的技术平台。所谓软刻技术,即是通过化学固定方法把利于细胞附着的偶联多肽、大分子聚合物等通过高分子聚合物 〔如聚二甲基硅氧烷 (poly-dimethylsiloxine,PDMS)〕按光刻微加工图案印刷到基底材料上[3],使神经细胞按照图案提供的特定空间分布生长并形成突触联系。同时,通过PDMS软印章和基底形成的微流体通道,以滋养在其表面生长的神经细胞,使其实现微流体图案化。
常选择用于印刷的生物大分子主要有层粘连蛋白 (laminin,LN),它是细胞外基质蛋白(extracellular matrix,ECM)中的糖蛋白,对各种细胞的粘附、生长和分化都起重要作用;在中枢神经系统发育中则有调节神经元迁移和轴突定向生长的作用。但是,涉及LN的神经细胞粘附作用机制中需要血清蛋白的某些成分参与[4],而构建高纯度的图案化神经元却要求无血清的培养环境 (否则细胞易聚集成团而脱落),单纯使用存在一定难度。除LN外,带有正电荷的物质,如多聚赖氨酸 (poly-l-lysine,PLL),因其表面带有大量呈正电效应的氨基基团,也可以用作吸引带有负电荷物质的细胞黏附剂。使用PLL的缺点在于,其多肽骨架在长时间培养过程中容易水解,造成培养神经元从基底材料表面脱落。近年来研究发现,一种带有正电荷的新型多聚体聚乙烯亚胺 (polyethy-leneimine,PEI),作为生物材料促进某些细胞黏附的能力要比PLL更强[5,6];同时,PEI经过电化学氧化方法在铂金或硅表面形成的超薄晶体膜,还具有绝缘和对pH值敏感的特性[7],从而有利于将来在微电子器件上应用来满足输入或输出信号的要求,实现神经元与电子器件的通讯联系,起到生物传感器的作用。本研究的前期试验已经利用微接触印刷软刻技术对神经元进行了图案化培养,发现带正电荷的PEI大分子比LN等蛋白构成的图案更为完整稳定[8,9],但似乎仍存在神经元突起延伸过短,生长状况尚不满意的缺点。可以设想,如果将LN和PEI混合作为一种界面材料,同时将微接触印刷软刻技术改为微流体印刷技术,应该能增强神经细胞粘附并促进突起生长。为此,本实验拟采用微流体印刷技术对PLL、LN、PEI及PEI和LN的混合液四种不同底物进行微加工,使纹状体神经元在底物上进行图案化培养;观察、比较它们对神经元粘附、突起生长的影响,并观察构建神经元流道图案的效果。通过研究,希望能为将来在体外制作高效信号传递的功能化神经芯片找到一种更佳的界面材料,为深入研究中枢神经系统功能和疾病发生机制提供更好的平台。
材料与方法
材料
动物:新生24 h内的SD大鼠 (购自首都医科大学实验动物中心)。
主要试剂:培养基 (Neurobasal-A,Gibco),B27添加剂 (Gibco),L-谷氨酰胺(0.5 mmol/L)。软刻中作为印章使用的聚二甲基硅氧烷 (PDMS,Sylgard 184,DownCorning,Midland,MI);作为印刷“墨水”使用的大分子蛋白,包括层粘连蛋白laminin(LN:L2020-1MG,Sigma;使用浓度为20 mg/L)、多聚赖氨酸 (PLL, P4832,Sigma;分子质量150~300 ku;使用浓度为0.05 mmol/L)和聚乙烯亚胺 (PEI,P3143,Sigma;分子质量750 ku;使用浓度为0.01%),以及PEI和LN的混合物 (使用浓度比为 PEI∶LN=1∶1)。所用抗体为 Anti-MAP2抗体 (Sigma,M1406),Anti-GABA(r-aminobutyric acid) 抗体 (Sigma,N2052)。
图案设计、主模版及PDMS印章的制备
主模版采用光刻方法制备,使用硅作为基片。首先使用L-Edit设计绘制图案 〔流道图案的参数规格根据神经细胞胞体和突起的大小宽度,以及与松下公司8×8微电极阵列(multielectrode array)MEA-105、210型号的规格相匹配进行设计〕(图1A),将设计好的图案委托中国科学院微电子研究所加工,得到掩模铬板后执行光刻,曝光后得到含光刻胶图案的主模版 (图1B,C)。选用正性光刻胶作为微流体印刷模版的光刻胶,光刻胶图案的浮凸深度依赖于光刻胶的涂覆厚度 (本试验在前课题组实验基础上[10],将光刻胶的涂覆厚度加深至15 μm,以减小流道毛细阻力,利于液体流动)。按照说明书[11]配置PDMS预聚体,浇注于主模版上,放入烘箱90℃下高温固化2 h,经“氧等离子”处理后保存在去离子水中。

图1 图案设计、主模版及PDMS印章制备 (A)采用L-Edit软件设计的微流体的原始图案 (流道图案线宽:10 μm,线间距:50、100、150、200、300 μm);(B)光镜下微流体主模板图案 (线间距:100 μm);(C)微加工的荧光二抗,山羊抗兔-488的图案Fig.1 Patterns design,template and PDMS stamp fabrication (A)Patterns of microfluidics printing template designed by L-Edit(lines width:10 μm;space between lines:50,100,150,200,300 μm).(B)Patterns'microscopic photographs of templates(space between lines:100 μm).(C)Immunofluorescent image of micropatterns with second antibody,goat-antirabbit 488
玻璃基片的表面修饰及印刷
印刷基片选用直径0.8 cm、厚度0.17 mm的玻璃片。玻璃片用新鲜配置的热Piranha溶液 〔即浓硫酸/双氧水溶液 (H2SO4∶H2O2=3∶1)〕处理以暴露表面带负电荷的羟基集团。之后,用去离子水清洗3次,每次5 min;然后用微流体印刷技术将PEI、LN、PLL及PEI+LN四种分子底物印刷在处理过的玻璃基片表面。采用Leica图像分析系统对不同粘附底物表面的神经元流道图案单位面积 (mm2)内的细胞数量及突起长度进行分析。印刷过程如下:先切开PDMS微流体印章的两端,以便于加液及上下大气贯通,促进液体流注,修剪成型后,浸入75%乙醇中消毒20 min,超净台内干燥,将印章倒扣于基片表面,施以一定的压力,以便能与PDMS印章贴紧。将基片倾斜45°,从剪开的上方经注液口滴加微量液体,并用微量移液器反复轻轻吹吸,利用外加压力使得液体流入微流道。把基片立于试管架上,进一步利用重力使液体顺利通过。静置25~30 min,待液体干燥后,轻轻揭开印章,即形成图案。放置于24孔板孔内,在光镜下检查玻璃基片图案印刷质量,种植细胞前用PBS清洗两遍。如图2所示。
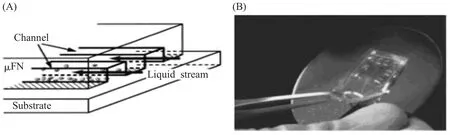
图2 微流体印刷 (A)微流体印刷示意图;(B)PDMS印章修剪和使用Fig.2 The microfluidic printing (A)Schematic diagram of microfluidic printing;(B)Pruning and using of PDMS seal
细胞培养、免疫荧光化学染色及形态学观察和测量
纹状体神经元取材于新生24 h内的SD大鼠,冰冻麻醉20 min后,断头处死;低温下无菌操作,取出脑部并剔除脑膜和血管,在解剖显微镜下分离出纹状体;在37℃下用0.25%胰酶消化约15 min,后加入含血清的培养基终止消化,离心 (1000 r/min)2~3 min,吸弃上清后加入培养基Neurabasal-A,轻轻吹打60次,用300目 (53 μm)过筛后再次离心(1000 r/min)4 min,弃上清液,重悬于Neurabasal-A培养基中。用血球计数板计数并按不同细胞密度稀释后接种,4~6 h后半量换液;之后,每3~4 d半量换液。培养7 d后取出玻璃基片,4%多聚甲醛固定细胞,0.01 mol/L PBS漂洗2次,5 min/次;入0.1%PBST中打孔10 min;5%山羊血清封闭抗原,37℃下45 min,以抑制非特异性染色背景产生;吸弃血清,加一抗工作液〔应用神经元标志物——微管相关蛋白2(microtubule-associated protein 2,MAP2)(1∶500)(小鼠来源)及抑制性中间神经元标志物——r-氨基丁酸(r-Aminobutyric acid,GABA)(1∶1000)(兔来源)免疫荧光双标染色以鉴别纹状体神经元〕,4℃过夜;0.01 mol/L PBS漂洗3次,5 min/次;入荧光标记的二抗工作液 (594标记的山羊抗小鼠荧光二抗和488标记的山羊抗兔荧光二抗)(1∶500),37℃孵育1 h,避光;0.01 mol/L PBS漂洗3次,5 min/次;Hochest复染细胞核,37℃孵育10 min,避光;0.01 mol/L PBS漂洗2次,5 min/次。
利用Leica Qwin显微镜和图像处理分析系统,观察纹状体神经元在四种不同分子图案表面的黏附、存活及突起生长状态及图案形成情况。在20倍物镜下随机选取12个单位面积 (mm2),计数每组单位面积中GABA阳性神经元的数量,并测量其突起的长度,将突起长度之和除以每组神经元数,所得数据采用SPSS13.0软件进行单因素方差分析。
结 果
不同黏附底物对图案化培养纹状体神经元黏附、存活和突起生长情况的影响
采用微流体印刷技术在玻璃表面微加工四种不同粘附材料:PEI、LN、PLL及PEI+LN的混合物,在流道间距均为150 μm规格下接种培养纹状体神经元,培养早期细胞形成图案的趋势不甚明显,随着培养时间延长,经过几次换液、吹打,逐渐变得清晰,培养48 h后,可在PLL、PEI及PEI+LN组观察到神经元已经基本循玻璃基片的图案排列生长,形成图案。神经细胞的胞体多黏附于流道线上,细胞已经伸出细小的突起,突起沿图案的流道生长。在PLL组,神经细胞多成团分布在流道上。在LN组,神经细胞多呈大片积聚状态分布,未形成明显的图案。培养7 d时,可见PLL组图案上细胞粘附力有所下降;随着培养时间的延长,有些细胞脱落使图案的流道中断,部分细胞偏离流道 (图3A)。PEI组的流道图案较为完整,细胞胞体变大但突起较短,细胞在注液口呈集落状生长,部分细胞之间能够构成联系 (图3B)。PEI+LN组细胞在注液口处分布均匀,神经元似乎能更好地沿流道伸展,很少偏离流道;细胞胞体变大,突起延长,与邻近细胞之间构成联系 (图3C)。在LN组,细胞聚集的现象明显,而且随着换液次数增多,出现细胞成片脱落现象,完全不能形成流道图案 (图3D)。通过免疫荧光化学染色方法鉴定可见,黏附在流道图案上MAP2阳性的成熟神经元多为GABA阳性的r-氨基丁酸能神经元,这些神经细胞胞体较圆,多为多极和双极突起,很少见到单极突起。培养7 d后,对生长在不同流道印刷材料表面的GABA阳性神经元的数量和突起长度进行定量分析,结果显示:在PEI(169/mm2)、PLL(150/mm2)及PEI+LN(161/mm2)三组表面生长的神经元的数量明显大于LN(80/mm2)组,而PEI+LN组 (40.64 μm)的神经元突起长度又大于 PEI组 (24.89 μm)和 PLL组(35.56 μm),P<0.05(图 4)。

图3 在PLL、PEI、PEI+LN及LN微流道图案的带负电荷的玻片上培养GABA抗体及MAP2抗体标记7天后的纹状体神经元的免疫荧光细胞化学染色图案 (A)在PLL流道图案上的纹状体神经元,流道间距为150 μm,Hochest染核×200;(B)在PEI流道图案上的纹状体神经元,流道间距为150 μm,Hochest染核×200;(C)在LN+PEI流道图案上的纹状体神经元,流道间距为150 μm,Hochest染核×200;(D)在LN流道图案上的纹状体神经元,Hochest染核×200。箭头表示流道内液体流动方向,bar=200 μmFig.3 Immunofluorescent image showing cultured striatal neurons for 7 days,labelled by antibodies of anti-GABA and anti-MAP2on PLL,PEI,PEI+LN and LN micropatterned flows on negatively charged glass coverslips (A)The striatal neurons on PLL micropatterned flows,the space between the flow lines was 150 μm,the nuclei of neurons were stained with Hochest×200;(B)The striatal neurons on PEI micropatterned flows,the space between the flow lines was 150 μm,the nuclei of neurons were stained with Hochest ×200;(C)The striatal neurons on PEI+LN micropatterned flows,the space between the flow lines was 150 μm,the nuclei of neurons were stained with Hochest×200;(D)The striatal neurons on LN micropatterned flows,the nuclei of neurons were stained with Hochest×200.Arrows indicating the direction of flow channel position,bar=200 μm

图4 在LN、PEI、PLL及PEI+LN流道图案上单位面积(mm2)内培养7天后神经元的数量及神经元的平均突起长度(μm)粘附效果的分析统计图 n=12,P<0.05Fig.4 The diagram showing adhesive effects tested by analysis of the number of neurons on the area(mm2)and average length of neuritis(μm)of neurons on LN,PEI,PLL and PEI+LN flow patterns respectively,after 7 day in the culture n=12,P<0.05
纹状体神经元在不同规格PEI+LN流道图案上培养的表现
依据以上实验结果,在确定PEI+LN能够形成最清晰、完整的神经元流道图案的基础上,进一步观察不同规格黏附底物流道图案对细胞存活、生长的影响,用PEI+LN黏附底物比较50 μm、100 μm、200 μm、300 μm四种不同线间距图案细胞培养结果。发现在培养早期(24 h到3 d之内),细胞在四种规格的流道图案上分布并无明显差异;随着培养时间延长,在50 μm最小规格的图案上,神经元多会越过流道生长或聚集成团进而脱落,未能形成清晰的流道图案。在间距200 μm的图案上,神经元分布较为分散,胞体大多位于图案的流道上,基本未偏离;可见由神经突起组成完整清晰的流道图案。在100 μm间距的图案上,上述两种情况皆有出现。在300 μm间距的图案上细胞散在分布,几乎不按流道图案生长。各种情况如图5所示。

图5 在不同PEI+LN微流道图案的带负电荷的玻片上培养GABA抗体及MAP2抗体标记7天后的纹状体神经元的免疫荧光细胞化学染色图案 线间距分别为50 μm(A)、100 μm(B),200 μm(C)及300 μm(D),Hochest染核×400。箭头表示流道内液体流动方向,bar=50 μmFig.5 Immunofluorescent image showing cultured striatal neurons for 7 days,labelled by antibodies of anti-GABA and anti-MAP2on different PEI+LN micropatterned flows on negatively charged glass coverslips Spaces between the flow lines are 50 μm(A),100 μm(B),200 μm(C)and 300 μm(D),the nuclei of neurons were stained with Hochest ×400.Arrows indicating the direction of flow channel position,bar=50 μm
讨 论
本研究采用的微流体印刷技术是一种在基片表面进行微细加工的新技术。它直接从印章与基片之间的凹槽注入“墨水”来加工图案,不需要对修饰在表面的分子进行干燥,这样可以保持蛋白或酶类的稳定性。另外,本微流体技术所需样品只需数微升即可,故可用于珍贵样本检测[12,13]。借助在微流道中产生和维持不同溶液平行流动的能力,微流体技术可固定细胞并模拟细胞周围微环境,还可用于多通道的药物检测[14,15]。它可在微米甚至纳米尺度 (30 nm~500 μm)基片上研究神经细胞的形貌信息以及空间结构对细胞生长的影响[16,17],因此微流体技术是研究材料细胞相互作用、制备神经芯片的有效手段。
本研究在材料上培养的细胞是纹状体神经元,纹状体是端脑基底神经节中的重要结构,主要由中等大小、树突有大量棘刺的神经元组成,几乎所有皮质都向纹状体发出纤维,经过整合后投射到丘脑和脑干等部位,参与神经系统多种生理功能的调节。也是临床上多种神经元变性疾病的发病部位。本试验试图用纹状体神经元建立神经元流道图案,使其能够在材料上实现定位排列,这对于进一步使其在体外与皮质或黒质神经元共培养,并结合微电子设备形成人工环路来研究纹状体神经元的功能和相关疾病机制,无疑具有开辟新路的重要意义。
本实验利用微流体技术加工了PEI、PLL、LN和PEI+LN四种界面材料,在相同培养密度下,观察比较了神经元在不同界面上构建微流道图案的情况。从最终的实验结果看,在无血清条件下,由于PLL会在后续实验中与细胞培养基接触而降解,故最终未能构建成功完整的流道图案。LN则可通过与整合素 (integrin)受体的结合,激活细胞内的骨架蛋白和胞内信号转导通路,从而促进细胞的黏附和成活[18]。此过程中,血清中的某些因子在一些环节上可能参与调节。所以,如用无血清培养基培养神经元,可能会削弱LN通过血清促进细胞黏附的作用;而且,培养中混于神经元一起的血管内皮细胞和胶质细胞也会因失去血清支持而死亡,靠这些细胞支持的神经元数量也会随之减少,这些都可能是造成在单纯LN上未能形成细胞图案的原因。相比之下,PEI分子链上拥有大量的氨基基团,是一种带正电荷的多聚体。由于细胞表面带有负电荷,细胞与材料之间的静电吸附作用遂可加速细胞沉降在材料表面,形成相对牢靠的贴附。贴附以后,神经元自身还会分泌一些细胞外基质蛋白,使其锚定得更加牢固[19,20]。因而,本研究中在PEI上粘附的细胞很多,但细胞突起较短 (与前期实验结果相似),以致部分流道中断,影响总体情况。而在PEI+LN材料上,除了显示PEI对神经细胞有很强的吸附作用外,LN分子链上的IKVAV和 LQVQLSIR五肽序列能被细胞骨架蛋白integrin识别,影响突起上生长锥的生长速度和方向,所以能够调控细胞迁移、突起生长及突触的形成和分化[21,22]。因此,本研究使用PEI+LN材料培养细胞能够形成非常完整的神经细胞流道图案。在该材料上生长的GABA阳性表达纤维也较丰富,这些都是神经细胞轴突和树突发育的重要证据。
通过本实验还能见到,细胞图案化培养的完整性不仅与黏附底物的特性密切相关,微结构上的异质性也会起一定作用,即并不是流道间距越宽,细胞图案化生长的效果就越明显。这可能与PDMS软印章微结构的纵横比例有关。曾有文献指出,如果印章微结构的线条间距/凹槽深度比超过20,PDMS会因在印章和基底材料上所施加压力过大而塌陷,从而出现图案失真的现象,这不利于细胞按流道图案生长[23]。相反,间距过小会使细胞容易聚集成团而难以形成图案化生长。上述因素可能是神经元在150 μm和200 μm流道间距规格的PEI+LN图案上能够清晰构建流道图案的原因。此外,PEI分子链上拥有大量的氨基氮原子使之具有很强的产生电子的特性,以至于它对金属离子能产生很强的螯合作用[24]。因此,选用PEI+LN作为微流体印刷的材料,不仅能够使细胞形成更为稳定完整的图案,而且更有利于将来实现神经元与电子器件的通讯联系。
因此从本研究看,可以通过选择合适的生物大分子混合物、通过一定规格的图案设计两方面因素,来人工调控神经元在特定材料上的粘附和轴突生长,以利于神经芯片的制备。可以说,本实验对神经芯片的实现提供了极好的技术平台,这对当前神经科学在我国的进步应有创新价值。
致谢 本课题得到中国科学院半导体所郭凯博士和清华大学材料工程系魏岳腾博士鼎力相助,在此一并致以诚挚谢意。
1. LiN, Tourovskaia A, Folch A. Biologyon a chip:Microfabrication for studying the behavior of cultured cells.Crit Rev Biomed Eng,2003,31(5-6):423~488
2.Rhee SW,Taylor AM,Tu CH,Cribbs DH,Cotman CW,Jeon NL.Patterned cell culture inside microfluidic devices.Lab Chip,2005,5(1):102~107
3. Falconnet D,Csucs G,Grandin HM,Textor M.Surface engineering approaches to micropattern surfaces for cell-based assays.Biomaterials,2006,27(16):3044~3063
4.Sgarbi N,Pisignano D,Di Benedetto F,Gigli G,Cingolani R,Rinaldi R.Self-assembled extracellular matrix protein networksbymicrocontactprinting. Biomaterials, 2004,25(7-8):1349~1353
5. Blau A,Weinl C,Mack J,Kienle S,Jung G,Ziegler C.Promotion ofneuralcelladhesion by electrochemically generated and functionalized polymerfilms. JNeurosci Methods,2001,112(1):65~73
6. Bledi Y,Domb AJ,Linial M.Culturing neuronal cells on surfaces coated by a novel polyethyleneimine-based polymer.Brain Res Protoc,2000,5(3):282~289
7. Herlem G,Lakard B.Ab initio study of the electronic and structuralproperties ofthe crystalline polyethyleneimine polymer.J Chem Phys,2004,120(19):9376~9382
8. Liu BF,Ma J,Xu QY,Cui FZ.Regulation of charged groups and laminin patterns for selective neuronal adhesion.Colloids Surf B Biointerf,2006,53(2):175~178
9.高 侃,刘丙方,徐群渊.以软刻技术微图案化培养纹状体神经元的形态学研究.生物化学及生物物理进展,2009,36(6):787~792 Gao K,Liu BF,Xu QY.A morphologic study on creation of neural network of cultured striatal neuronsin vitrousing soft lithography techniques.Prog Biochem Biophys,2009,36(6):787~792
10.刘丙方.利用微接触印刷技术体外构建神经网络的相关研究.北京:首都医科大学博士论文,2007 Liu BF.A related study on fabrication of neural network with microcontact printingin vitro.Bjing:Capital Medical University,2007
11.Xia YN,Whitesides GM.Soft lithography.Ann Rev Mater Sci,1998,28:153~184
12. Vilkner T, Janasek D, Manz A. Micro total analysis systems.Recent developments.Anal Chem,2004,76(12):3373~3385
13.Lion N,Rohner TC,Dayon L,Arnaud IL,Damoc E,Youhnovski N,Wu ZY,Roussel C,Josserand J,Jensen H,Rossier JS,Przybylski M,Girault HH.Microfluidic systems in proteomics.Electrophoresis,2003,24(21):3533~3562
14.Takayama S,McDonald JC,Ostuni E,Liang MN,Kenis PJA,Ismagilov RF,Whitesides GM.Patterning cells and theirenvironments using multiple laminarfluid flows in capillary networks.Proc Natl Acad Sci USA,1999,96(10):5545~5548
15.Santillo MF,Arcibal IG,Ewing AG.Flow characterization of a microfluidic device to selectively and reliably apply reagents to a cellular network. Lab Chip,2007, 7(9):1212~1215
16. ParkTH, ShulerML. Integration ofcellculture and microfabrication technology. BiotechnolProgress, 2003,19(2):243~253
17.Shin H.Fabrication methods of an engineered microenvironment for analysis of cell-biomaterial interactions. Biomaterials,2007,28(2):126~133
18.Sgarbi N,Pisignano D,Di Benedetto F,Gigli G,Cingolani R,Rinaldi R.Self-assembled extracellular matrix protein networks by microcontactprinting. Biomaterials, 2004,25(7-8):1349~1353
19.Ma J,Liu BF,Xu QY,Cui FZ.AFM study of hippocampal cells cultured on silicon wafers with nano-scale surface topograph. Colloids SurfB Biointerf, 2005, 44(2-3):152~157
20.Tsuruma A,Tanaka M,Fukushima N,Shimomura M.Morphological changes of neurons on self-organized honeycomb patterned films.Kobunsh Ronbunsh,2004,61(12):628~633
21.Graf J,Ogle RC,Robey FA,Sasaki M,Martin GR,Yamada Y,Kleinman HK.A pentapeptide from the laminin B1 chain mediates celladhesion andbindsthe 67000 laminin receptor.Biochemistry,1987,26(22):6896~6900
22.Sanes JR,Hunter DD,Green TL,Merlie JR.S-laminin.Cold Spring Harb Symp Quant Biol,1990,55:419~430
23.Delamarche E,Schmid H,Biebuyck HA,Michel B.Stability of molded polydimethylsiloxane microstructures.Adv Mater,1997,9(9):741~746
24.Bisset W,Jacobs H,Koshti N,Stark P,Gopalan A.Synthesis and metal ion complexation properties of a novel polyethyleneimine N-methylhydroxamicacid watersoluble polymer.React Funct Polym,2003,55(2):109~119
A Morphological Study on Creation of Neural Flow Patterns with Cultured Striatal Neuronsin VitroUsing A Microfluidic Technique
LUO Yali,GAO Kan,XU Qunyuan
Beijing Institute for Neuroscience,Beijing Center of Neural Regeneration and Repairing,Key Laboratory for Neurodegenerative Diseases of The Ministry of Education,Capital Medical University,Beijing 100069,China
This work was supported by grants from The"973"Program(2007CB947704)and The National Natural Science Foundation of China(81070977)
Oct 8,2010 Accepted:Dec 10,2010
XU Qunyuan,Tel:+86(10)83911464,E-mail:xuqy@ccmu.edu.cn
To make a designed neurochip practical,the adhesion and neurite growth of patterned striatal neurons were investigated by a microfluidic technique on the surface of mixture of polyethyleneimine(PEI)and laminin(LN)in vitro.Four different substrates,including LN,poly-L-lysine(PLL),PEI and mixture of PEI with LN(PEI+LN),characterized with strong positive surface charges were micropatterned on the silicon slide using a microfluidic technique.The striatal neurons from the forebrain of postnatal SD rats were culturedin vitroon these materials,respectively.The survival,adhesion and neurite growth of the cultured neurons,as well as their flow patterns on different substrates were evaluated,especially by immunofluorescent staining.Different effects of the neural flow patterns on different designs of the pattern(different spaces between the flow lines)fabricated on PEI+LN material were also compared using same method.The quantity of neuronal growth on the patterns of PEI,PLL and PEI+LN was apparently larger than that on LN.Moreover,the coated pattern of neurons on the PEI+LN was more integrated than on the others,and its morphology was more completely when the cells grew on the pattern with flow line spaces ranged between 150 and 200 μm.The substrate of PEI and LN mixture is in favor of creation of neural flow patterns,by using the microfluidic technology,when a suitable design of the pattern is selected.The observation in present study may help creation of some practical neurochips in the future times.
Microfluidic technique;Polyethyleneimine;Cell culture
2010-10-08;接受日期:2010-12-10
“973”计划项目(2007CB947704),国家自然科学基金项目(81070977)
徐群渊,电话:(010)83911464,E-mail:xuqy@ccmu.edu.cn
R392.12,R319