味连基因组DNA提取方法研究
余弦,王书林,林海霞,孙翠萍,王砚
DNA分子标记技术已广泛运用于中药的鉴定,高质量的DNA模板是进行PCR的重要前提,则DNA的提取是关键步骤。现在对中药DNA的提取主要利用新鲜植株进行提取,但从干燥药材中提取DNA的研究较少,因为中药材在其干燥、加工、贮藏等过程会造成DNA不同程度的降解。因此,如何从中药材中提取高质量的DNA模板是我们必须解决的问题。本课题在改良的CTAB法基础上对味连新鲜植株与干燥药材基因组总DNA提取方法进行了研究。
1 材料与方法
1.1 实验材料及预处理
干燥药材均打成细粉。一部分味连植株新鲜叶片(1、5、9、13、17、21 号)用 dd H2O 清洗后经液氮急速冷冻,再转入-80℃超低温冰箱保存;另一部分新鲜叶片(2、6、10、14、18、22 号)经 dd H2O 清洗后,擦干,剪成碎片,置于装有干燥变色硅胶的密封袋里,充分摇匀,使之迅速干燥,放于干燥器中保存。实验材料采集地点及编号见表1。
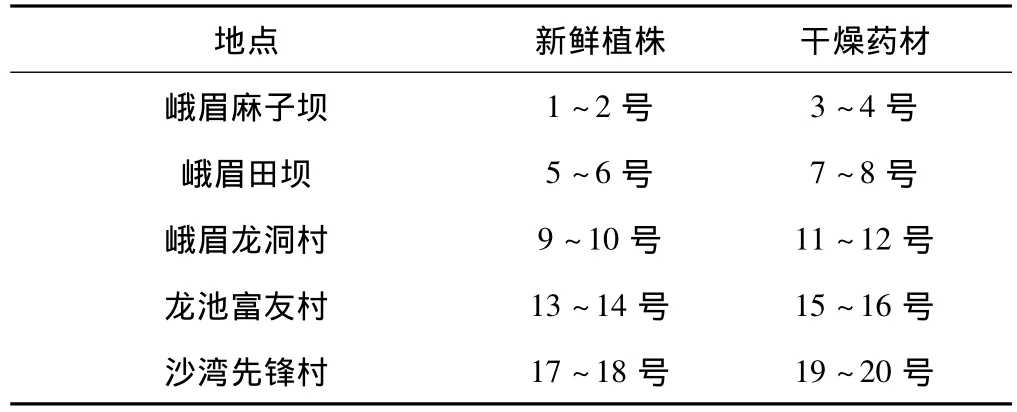
表1 实验材料采集地点及编号
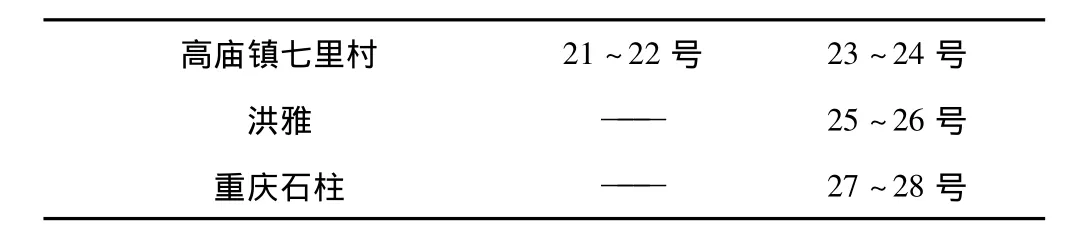
高庙镇七里村 21~22号 23~24号洪雅 —— 25~26号重庆石柱 —— 27~28号
1.2 仪器
1.5 mL、2 mL离心管、研钵、Eppendorf精密移液器、Eppendorf centrifu ge 5417R高速冷冻离心机、电泳装置、核酸-蛋白凝胶图像分析管理系统、岛津紫外分光光度仪、Innova U101超低温冰箱、UPT超纯水器、磁力搅拌器、高精度低温恒温槽、pH计、通风橱等。
1.3 试剂
2×CTAB 提取缓冲液[2%CTAB,100 mmol·L-1Tris-HCl(pH8.0),20 mmol·L-1EDTA,1.4 mol·L-1NaCl,2%巯基乙醇]、TE 缓冲液[10 mmol·L-1Tris-HCl(pH8.0),1 mmol·L-1EDTA(pH8.0)]、5×TBE 缓冲液(pH8.3)[445 mmol·L-1Tris 碱,445 mmol·L-1硼酸盐,1 mmol·L-1EDTA(pH8.0)]、6×凝胶上样缓冲液(0.25%溴酚蓝,0.25%二甲苯青FF,30%甘油)、1.5%琼脂糖凝胶(琼脂糖1.5 g加至100 mL 0.5×TBE缓冲液中,加热溶解备用)、Mass RulerTMDNA Ladder Mix、溴化乙锭、氯仿、异戊醇、醋酸钠、无水乙醇、70%乙醇、dd H2O、液氮等。
1.4 方法
1.4.1 基因组总DNA的提取[1~3]
在2 mL离心管中加入65℃预热的500 μL CTAB提取缓冲液;味连叶片用液氮研磨成细粉后(约1 g)加入离心管中,或味连干燥药材细粉(约1 g)直接加入离心管中,小心混匀,于65℃水浴2 h,其间小心倒转离心管数次;冷却至室温后,加入500 μL氯仿-异戊醇(24:1)抽提,静置20 min分相,于10000 g 4℃离心10 min后取上清液;加入1/10体积3M NaAc(pH5.2)和2倍体积-20℃无水乙醇,-20℃过夜;用毛细管加热制成带“U”形钩状玻棒,将沉淀捞出;沉淀用1.5 mL 70%乙醇洗两次,4000 g短暂离心,倾去乙醇,沉淀室温晾干,溶于200 μL TE(pH8.0)缓冲液中,保存于-20℃。
1.4.2 紫外分光光度计检测
取DNA溶液稀释50倍,以TE溶液为空白溶液,用紫外分光光度法测定DNA在260 nm及280 nm处的吸光值,然后根据OD260/OD280比值判断DNA纯度,并根据DNA 260 nm检测其浓度。根据公式计算DNA样品的浓度:双链DNA溶液浓度(μg/μL)=OD260×稀释倍数×50/1000。
1.4.3 琼脂糖凝胶电泳检测
DNA样品中加入1/5体积的6×凝胶上样缓冲液,混匀后取8 μL样品在1.5%的琼脂糖凝胶(含0.5μL·mL-1的EB溶液染色)中进行电泳分离,同时要设立合适相对分子质量的DNA marker(Mass RulerTMDNA Ladder Mix),以5 V/cm胶的电压电泳3 h。在凝胶成像系统下检测DNA的纯度及降解情况。
2 结果与分析
2.1 提取结果
在加入-20℃无水乙醇以后便出现白色絮状DNA沉淀,-20℃静置过夜后有利于沉淀。新鲜植株提取的DNA溶液无色透明,而干燥药材粉末提取的DNA溶液呈淡黄色,可能是由于药材中的小檗碱等成分溶出造成。
2.2 紫外分光光度计检测结果
如DNA样品的OD260/OD280比值大于1.8,说明仍存在RNA;OD260/OD280比值小于1.6,说明样品中存在蛋白质或酚。对味连提取的基因组总DNA进行紫外分光光度计检测结果见表2,表3。
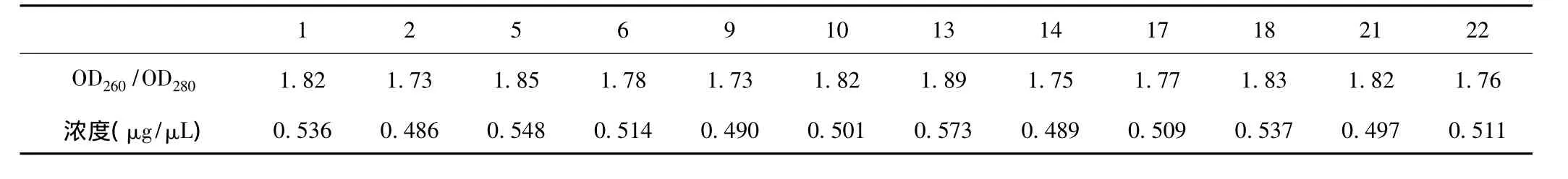
表2 味连新鲜叶片DNA紫外分光光度计检测结果

表3 味连干燥药材DNA紫外分光光度计检测结果
由表2、表3可见,测得各样品溶液OD260/OD280的比值在1.6~1.8之间,说明 DNA纯度较高;根据DNA在260nm处测得的吸光值所计算出的DNA浓度也较高。
2.3 琼脂糖凝胶电泳检测结果
琼脂糖凝胶电泳后在100 bp处均呈现一条条带,说明从味连新鲜植株及干燥药材中均提出了DNA。比较图1A、B中条带的亮度及清晰度,可见从新鲜植株中提取的DNA条带亮度比从干燥药材中提取的亮,表示从新鲜植株中提取的DNA浓度较高;且个别干燥药材DNA(3、4、7号)的条带有晕染,揭示DNA有一定程度的降解。
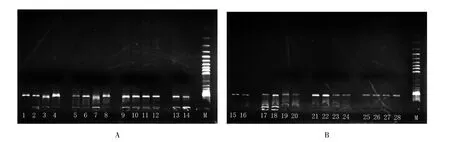
图1 味连基因组DNA琼脂糖凝胶电泳结果
3 讨论
此方法能从味连新鲜植株与干燥药材中提取DNA,这就扩大了中药DNA的提取来源。从新鲜植株中提取的DNA浓度与纯度比干燥药材中提取的要高;从干燥药材中提取的DNA有一定程度的降解。但从味连干燥药材中提取的DNA能否满足PCR及后续扩增条件,有待于下一步研究。
[1] 黄璐琦.分子生药学[M].北京:北京大学医学出版社,2006.
[2] 李晓波,冯波,张朝辉,等.植物药材总DNA提取[J].中草药,2002,33(7):652.
[3] 曹琳,刘忠权,郝明干,等.不同种类中药材的DNA提取方法[J].中国现代应用药学,2004,21(6):465.

