阴虚火旺型OLP 差异表达miRNAs 靶基因信号通路调控分析
颜家渝,黄映红,曾洁萍
口腔扁平苔藓(Oral Lichen Panus,OLP)是常见的非感染性口腔粘膜病变,具有发病率高、病程迁延难愈、有癌变倾向等特点。OLP主要发生人群是40岁以上的成年人,但是年轻人和儿童也会发生,约占患者总数的2% ~3%,OLP在成人中的患病率约为0.51%[1]。OLP病程迁延,易反复发作,部分反复发作的病人可发展为口腔鳞癌。由于日渐增多的OLP癌变病例的危险报告被提出,因此WHO已将OLP定义为癌前状态疾病[2]。OLP发病机制的探讨一直是口腔医学的研究热点之一。有研究表明,OLP存在着多基因表达调控的改变,可能与其发生和转归密切相关[3~4]。据文献综合表明[5~8],阴虚火旺是 OLP 最常见的中医临床证候。此型通常伴口腔粘膜充血,糜烂,易发生癌变[9],故本研究重点为阴虚火旺型的OLP。
miRNA是一种极短的,在体内自然存在的约含21~22个碱基的RNA分子,是由Dicer酶加工具有发夹结构的约70~90个碱基大小的单链RNA前体而来,miRNA通过和靶基因mRNA互补序列配对引导沉默复合体(RISC)降解mRNA或抑制蛋白的翻译。miRNA在细胞生长和凋亡、血细胞分化、同源异形盒基因调节、神经元的极性、胰岛素分泌、大脑形态形成、心脏发生、胚胎后期发育等过程中发挥重要作用。因此,为进一步探明OLP患者的特异性基因表达调控,本研究运用基因芯片技术筛选OLP相关的miRNAs,探索口腔扁平苔藓的中医证候研究方法,探讨阴虚火旺型口腔扁平苔藓的基因表达特征及靶基因信号通路调控。
1 材料与方法
1.1 主要试剂和材料
白细胞保存液(孝感奥华医疗科技有限公司)、EDTA(江西省容和实业有限责任公司)、红细胞裂解液(C3702,江苏海门市碧云天生物技术研究所)、mir-Vana RNA Isolation Kit(美国 Ambion公司)、miRNAs芯片SANGER11.0版本(美国Affymetrix公司)等。
超净工作台SW-CJ-1F(苏州市安泰空气技术有限公司)、Heraeus冷冻离心机(Me gafu ge1.0R,德国)、eppendorf加样枪(1403853,德国)、SANYO 超低温冰箱(MDF-382E,日本)等。
1.2 临床病例样本采集
1.2.1 临床病例收集
2008年9月至2010年8月在成都中医药大学附属医院口腔粘膜病专病门诊,并经临床及病理学检查确诊的OLP患者20例,按中医辨证分型[10],筛选阴虚火旺型口腔扁平苔藓病例3例,其中男2例,女性1例。对照组3例健康者,其中男性2例,女性1例。各组均排除感染性、心血管、自身免疫、过敏性、肿瘤、精神性疾病等。
1.2 .2 样本采集
晨空腹常规静脉采血2 mL,加入EDTA抗凝,4℃保存待用。在超净工作台上分别吸取6 mL红细胞裂解液到6个15 mL离心管,离心管编号1~6号。将回复到室温的抗凝全血摇匀后,吸取2 mL分别加到6个离心管中,颠倒6~8次,并倒置轻弹管壁混匀。室温放置5分钟并轻弹数次帮助裂解红细胞,摇匀,3000 rpm离心5分钟,弃上清液,留下管底白细胞团和大约10 μL的残留上清液。6个离心管均加入红细胞裂解液重复离心1次,吸净上清,加入mirVana RNA Isolation Kit 1 mL,吹匀并移入12个冻存管,对应离心管分别编号 1-1、1-2、2-1、2-2、3-1、3-2、4-1、4-2、5-1、5-2、6-1、6-2,-80℃保存。
1.3 miRNAs微阵列分析
芯片采用美国Affymetrix公司生产的miRNA芯片SANGER11.0版本,每片含1769条探针,其中人类miRNA700个。
1.3.1 芯片制作与扫描
提取TotleRNA,采用凝胶电泳和紫外分光光度计质量检测,探针标记与杂交,洗片后晾干后扫描。
1.3.2 统计学方法
采用SAM软件,P值小于0.05视为表达有差异。
2 结果
2.1 样品RNA的质量判定
TotleRNA质量检测及分离纯化的小分子RNA均符合miRNA芯片要求。探针标记与杂交、洗片过程质控合格,扫描数据可分析。
2.2 差异表达的miRNAs
寻找到5个OLP患者和正常人有表达差异的miRNA(表1)。
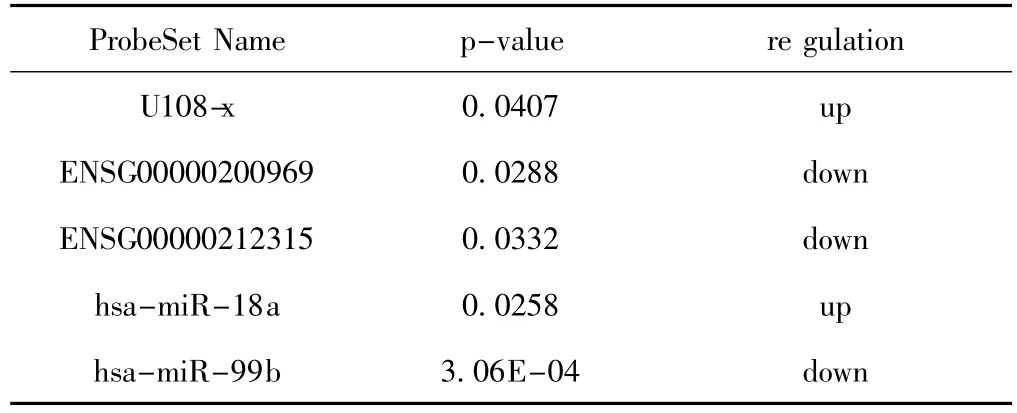
表1 差异表达的miRNAs列表
2.3 hsa-miR-18a miRNA基因相关的12个有统计学意义靶基因通路(表2)
2.4 hsa-miR-99b miRNA基因相关的2个有统计学意义靶基因通路(表3)
3 讨论
OLP病因及发病机制至今尚不明确,一般认为与精神、内分泌、免疫、感染等全身因素有关。OLP发病机制的探讨一直是口腔医学的研究热点。有研究表明,OLP存在着多基因表达调控的改变,可能与其发生及疾病的转归密切相关[11]。范媛[12]等利用基因芯片筛选出OLP相关的差异表达基因213条,主要涉及免疫相关基因,代谢相关基因,以及DNA结合、转录和转录因子、细胞信号转导等相关基因。许彦枝[13]等则应用含有332050个位点的人类基因组芯片进行杂交,筛选出114条差异表达基因,并总结了ERBB3、SYN2、GIT1、CD72等几条基因在OLP发生发展过程中的重要作用。同时,许彦枝[14]等也研究了OLP的表达通路,结论为应用基因表达谱芯片可初步筛选出OLP差异表达基因和通路,OLP发生、发展过程中存在着多个不同基因及多条功能通路表达调控的改变。但目前尚无对基因表达调控的重要环节miRNA的分析。探讨OLP与miRNA的相关性,将为OLP的分子机制学研究开拓全新的思路。

表2 hsa-miR-18a miRNA对应12个靶基因通路列表(p-value<0.01)

表3 hsa-miR-99b miRNA对应2个靶基因通路列表(p-value<0.05)
miRNA是一类新近发现的,在基因表达调控网络中起重要作用的小分子。在高等真核生物中广泛表达的miRNA是经过Dicer加工之后的一类非编码的小RNA分子。在哺乳动物中,miRNA通常在翻译水平上调节基因表达,miRNA的数量与每个位点上翻译沉默的水平是协同相关的[15],由于互补序列的存在,miRNA能够与特异的mRNA3'非翻译区结合,导致mRNA的降解或翻译抑制,从而起到对基因表达负调节作用或基因沉默[16]。虽然miRNA基因在人类的基因组中只占很小一部分,但它是机体发育和细胞稳态维持的关键调节因子。每个miRNA可有多个靶基因,多个miRNA也可调控同一靶基因[17],这一特点体现了miRNA调控网络的经济性和精密性。
经Kegg及Biocarta数据库分析,hsa-miR-18a相关的有统计学意义的信号通路共12条,包括CD40L信号通路、TNFR2信号通路、NF-KB信号通路、p53信号通路等。hsa-miR-18a的上调,使相应信号通路效应物的活性抑制或浓度改变。其中TNFR2信号通路的抑制,可能与OLP病变部位细胞凋亡减弱有关。而p53信号通路抑制,导致抑癌基因p53表达下调,与细胞恶性增殖密切相关,GirodS 与 Rajaram G[18~19]认为p53基因突变可能与口腔黏膜癌变的早期阶段有关。
本实验数据分析指出hsa-miR-99b相应有统计学意义信号通路包括细胞粘多糖(肝素)合成和细胞粘多糖降解通路两条。有研究表明,CD淋巴细胞通过产生肝素酶穿过黏膜下层基板区,形成淋巴细胞浸润带,介导扁平苔藓的炎症反应[20]。故根据本研究结果可推测hsa-miR-99b的表达下调可与OLP病变部位粘多糖成分肝素的合成分解紊乱有关。
[1] 陈谦明.口腔黏膜病学(第三版)[M].北京:人民卫生出版社,2008.
[2] WHO World Health Or ganization Collaborating Centre for Oral Precancerous Lesions.Definition of leukoplakia and related lesions;an aid to study precancer[J].Oral Sur g Oral Med Oral Pathol 1978,46:518.
[3] Safadi RA,Al Jaber SZ,Hammad HM,Hamasha AA.Oral lichen planus shows hi gher expressions of tumor suppressor gene products of p53 and p21 compared to oral mucositis[J].An immunohistochemical study.Arch Oral Biol.2010 Jun,55(6):454.
[4] Bascones C,Gonzalez-Moles MA,Esparza G,et al.Apoptosis and cell cycle arrest in oral lichen planus Hypothesis on their possible influence on its mali gnant transformation[J].Arch Oral Biol.2005 Oct;50(10):873.
[5] 杨年,缪滋光,钟菊莲.辨证论治口腔扁平苔藓86例[J].甘肃中医,2008,21(3):36.
[6] 黄健,王前元.中西医结合治疗口腔扁平苔藓临床研究[J].辽宁中医杂志,2005,32(80):813.
[7] 黄秋琴.辨证治疗口腔扁平苔藓218例临床观察[J].湖南中医杂志,2005,21(3):6.
[8] 黄志强,唐月虹.辨证分型治疗口腔扁平苔藓75例[J].江苏中医,2000,21(3):26.
[9] 陈作良,熊金兰.孟加拉红染色对口腔扁平苔癣癌变监测的临床应用[J].实用口腔医学杂志,1993,9(1):5.
[10]熊大经.实用中医耳鼻咽喉口齿科学[M].上海:上海科学技术出版社,2001:442.
[11] Gresham D,Dunham MJ,Botstein D.Comparing whole genomes using DNA microarray[J].Nat Rev Genet,2008,9(4):291.
[12]范媛,詹瑧,刘杰.口腔扁平苔藓基因表达谱中差异表达基因的初步探讨[J].华西口腔医学杂志,2007,25(4):378.
[13]许彦枝,杨凤英,刘健.基因芯片筛选口腔扁平苔藓差异表达基因的研究[J].河北医科大学学报,2010,31(5):538.
[14]许彦枝,杨凤英.口腔黏膜扁平苔藓差异基因筛选及其通路分析[J].中华临床医师杂志,2010,1:47.
[15] Doench J.G.Petersen C.P,and Sharp P.A.siRNAs can function as miRNAs[J].Genes Dev,2003,17:438.
[16] David PB.MicroRNAs:Genomics,bio genesis,mechanisms and function[J].Cell,2004,116:281.
[17] Lewis BP,Shih I,Jones-Rhoades MW,et al.Prediction of mammalian microRNA tar get[J].Cell,2003,115:787.
[18] GirodS,Krue gerG,Pape.HD.P53 and Ki67 expression in preneoplastic and neoplastic lesions of the oral mucosa[J].Inr J Oral Max-illofac Surg,1993,22(5):2858.
[19] Rajaram G,Christopher MW,Teresa AL,et al.Mutated and Wide-type p53 experssion and HPV inte gration in proliferative verrucous leukoplakia and oral squamous cell carcinoma[J].Oral Surg Oral Med Oral Pathol,1997,83(4):471.
[20]柏景坪,林梅.口腔扁平苔藓的药物治疗研究进展[J].国外医学口腔医学分册,2004,31(4):306.

