城市生活废水用于产油微藻培养
吕素娟,张维,彭小伟,陈晓琳,刘天中
1 中国海洋大学食品科学与工程学院,青岛 266003
2 中国科学院青岛生物能源与过程研究所 生物燃料重点实验室,青岛 266101
城市生活废水用于产油微藻培养
吕素娟1,2,张维2,彭小伟2,陈晓琳2,刘天中2
1 中国海洋大学食品科学与工程学院,青岛 266003
2 中国科学院青岛生物能源与过程研究所 生物燃料重点实验室,青岛 266101
将废水与产油微藻培养结合起来,可以实现废水的无害化处理,还可为微藻的培养提供营养组分和大量水源。利用高产油栅藻,以城市生活废水为水源,在气泡柱式光反应器中,考察了添加不同营养组分对栅藻细胞的生长、生物质产量、总脂含量以及氮磷去除情况的影响。结果表明:生活废水非常适合于产油微藻的培养。利用生活废水进行微藻培养中,仅需补充添加无机氮、无机磷、柠檬酸铁铵以及微量元素。但这些营养组分的加入量对藻细胞的生长、生物量和油脂积累有重要影响。在优化的废水培养基中微藻细胞浓度可达8.0 g/L左右,远高于标准BG11培养基5.0 g/L的水平。微藻细胞对于无机氮与磷有着高的吸收能力,在废水中加入185.25 mg/L以下无机氮,16.1 mg/L以下无机磷的条件下培养3~4 d后,培养液水体中未检测到有氮磷残留。由此表明利用城市生活废水培养含油微藻可以在获得微藻油脂产品的同时实现水体的氮磷无害化处理。
栅藻培养,城市生活废水,气泡柱式光反应器,微藻生物量,氮/磷去除
Abstract:Municipal wastewater is usually problematic for the environment. The process of oleaginous microalgal culture requires large amounts of nutrients and water. Therefore, we studied the feasibility of oleaginous microalgal culture of Scenedesmus dimorphus in bubbled column photobioreactor with municipal wastewater added with different nutrients. S. dimorphus could adapt municipal nutrient-rich wastewater by adding some nutrients as nitrogen, phosphorus, ferric ammonium citrate and trace elements,and the amounts of such nutrients have significant effects on cell growth, biomass yield and lipid accumulation. At optimum compositions of wastewater medium, the algal cell concentration could reach 8.0 g/L, higher than that of 5.0 g/L in standard BG11.Furthermore, S. dimorphus had strong capacity to absorb inorganic nitrogen and phosphorus from its culture water. There was almost no total nitrogen and phosphorus residues in culture medium after three or four days culturing when the adding mounts of nitrate and phosphate in wastewater medium were no more than 185.2 mg/L and 16.1 mg/L respectively under the experimental conditions. As a conclusion, it was feasible to cultivate oleaginous microalgae with municipal nutrient-rich wastewater, not only producing feedstock for algal biodiesel, but also removing inorganic nitrogen and phosphorus from wastewater.
Keywords:Scenedesmus dimorphus cultivation, municipal wastewater, bubbled column photobioreacter, algal biomass,nitrogen/phosphorus removal
随着全球化石能源短缺和环境不断恶化,生物柴油作为一种可持续的绿色能源形式,受到世界范围内的广泛关注。目前全球各国都在大力发展生物柴油产业,但其最大的“瓶颈”在于大规模低成本可持续性油脂原料的供应。微藻是一种浮游的光自养微生物类群,广泛存在于海洋、湖泊、河流等水体环境中,其中有很多藻种在特定环境条件下,可以积累大量的油脂产物,用于生物柴油生产。同时由于其光合效率高、生长速度快、产油量高、吸收CO2作为碳源利用、不与民争粮和不与粮争地等优势,因而具有比传统油料作物更高的发展潜力[1-6]。一些学者甚至认为微藻培养是解决能源与环境问题的终极出路之一。
虽然微藻产油潜力巨大,但迄今为止尚未获得商业化生产能源产品的途径,而主要应用于高附加值产品经济微藻和饵料藻的生产。微藻培养主要采用的是液体悬浮式的培养,水源、营养盐等消耗大,培养成本过高使得微藻能源产品的生产成本过高。因此发展微藻生物能源技术,除了通过培养技术突破大幅度提高微藻产率外,解决廉价的水资源和营养盐成本也是降低微藻培养成本的重要措施之一。人类社会生产和生活产生大量富含氮磷的废水,这些废水的无害化处理已成为环境保护的重要问题。微藻作为一种自然环境的净化者,很早就被提出并应用于废水中的无机氮磷以及金属元素等污染物质的去除。因此在微藻生物能源技术中,利用废水来培养产油微藻,既可以利用微藻对这些大量的富氮磷废水实现高效无害化处理,还可为能源微藻生产油脂提供丰富廉价的营养与水资源,一举两得。
栅藻Scenedesmus sp.是一种高环境污染耐受性的微藻品种,常见于许多富营养的污水环境中,由于其高效的氮、磷利用率以及生长快速等特点,因此经常被用于微藻的废水培养[7-9]。Kim等曾在2007年,利用添加猪舍发酵废水的培养基在摇瓶中培养栅藻,生长速率、干重分别达到对照培养基培养的3倍和2.6倍[10]。Chinnasamy等在2010年从地毯厂污水中分离藻种,利用地毯厂污水和市政废水在950 L跑道池中进行培养评价,每年每公顷具有生产 9.2~17.8 t的潜力,总脂含量为 6.82%[11]。Li等利用二级污水对栅藻在摇瓶中培养,达到干重0.11 g/L,总脂含量为 31~33%,油脂产率最高为0.008 g/(L·d)[12]。
从以往的研究看,人们往往希望通过利用高污染的工业废水进行微藻培养,虽然意义巨大,但是由于其复杂的组成以及较高浓度污染物,抑制了微藻生长从而降低其生产潜力,故难以形成持续化的大规模供应。相比而言,城市生活废水供应量巨大,从2000到2006年,我国城镇人口增加了25.7%,生活废水排放量也从 2000年的 220.9亿 m3增加到2006年的296.6亿m3,增长了34.3%[13-14],而且由于已有的生活废水管网体系的存在,更加易于形成规模化的供应,同时其污染程度相对较低,更适合于微藻生长。因此本研究利用一株高产油栅藻Scenedesmus dimorphus,通过高光效的气泡柱式光生物反应器,研究其城市生活废水培养的可行性,考察在废水中添加不同的营养基质下藻细胞的生长、生物质产量、油脂积累以及营养物质的消耗状况,以期为利用城市生活废水培养产油微藻工艺的建立奠定基础。
1 材料与方法
1.1 实验用水
本实验所用城市生活废水取自山东青岛市崂山区张村河河南桥处污水排放口,取水时间为春季下午16:00左右。废水经过孔径为45 µm筛绢过滤,去除固形物;经高压蒸汽灭菌后备用。测定灭菌后水的化学需氧量 (COD)、总氮 (TN)、总磷 (TP)、铵态氮 (NH4-N)、pH等,结果见表1。
1.2 藻种与培养
本实验所用藻种为美国亚利桑那州立大学 Hu Qiang教授惠赠的产油栅藻S. dimorphus。
标准 BG11 培养基[15]组成 (单位 mg/L):NaNO3,1 500;MgSO4·7H2O,75;CaCl2·2H2O,36;柠檬酸,6;Na2EDTA,1;柠檬酸铁铵,6;Na2CO3,20;KH2PO4·H2O,40;微量元素 (A5): ZnSO4·7H2O,0.222;CuSO4·7H2O,0.079;MnCl4·4H2O,1.81;Na2MoO4·2H2O,39;Co(NO3)2·6H2O,0.049;H3BO3,2.86。
以标准BG11培养基培养处于对数生长期的栅藻为种子液,接种于300 mL气泡柱式光反应器 (参数:外径2.9 cm、内径2.7 cm、柱高56.0 cm) 中,初始吸光度OD730为0.2±0.05,折合干重约 (0.1±0.01) g/L,于温度为 (25±1) ℃,光强为 100 µmol/(m2·s) 条件下,连续通气培养 (CO2含量为2%,空气流速为60 L/h,由底部通入) 12 d。每2天取样测定OD730以监测微藻细胞生长情况。培养结束后测定取样测定藻细胞干重、总脂含量以及培养液中 TN、TP消耗量。每组实验设2个平行对照。
1.3 分析方法
1.3.1 细胞生长与干重测定
全光谱扫描中,在730 nm波长下栅藻无光吸收峰,因此可通过测定 OD730来定性监测与比较栅藻细胞培养液密度。
5~10 mL (V) 藻液经预称重 (W1) 的醋酸纤维膜 (Φ0.45 µm),过滤、洗涤,于105 ℃下烘至恒重(W2),培养液细胞浓度 (干重,DW(g/L)) 的计算式如下:

1.3.2 细胞总脂含量测定
细胞总脂含量测定采用重量法测定,以氯仿-甲醇共溶剂提取[16]。称取冻干藻粉50 mg (准确到0.1 mg) (Wc),加入7.5 mL甲醇/氯仿 (2∶1=V∶V)混合溶液,于37 ℃下振荡提取24 h后,离心收集上层有机相;藻残渣用7.5 mL混合溶剂重复提取一次。集合有机相,加入5 mL氯仿、9 mL水,使氯仿∶甲醇∶水=2∶2∶1.8 (V∶V∶V),离心收集下层氯仿相,转移至预称重的小管中,氮气保护下烘至恒重,得到总脂 (Total lipid,TLP) Wtl。藻细胞总脂含量为:

1.3.3 总氮、总磷的测定
栅藻培养液于8 000 r/min离心3 min 后,收集上清液用于总氮、总磷含量测定。总氮采用碱性过硫酸钾消解紫外分光光度法 (GB 11894-89,水质总氮的测定),总磷采用过硫酸钾氧化-钼锑抗分光光度法测定 (GB 11893-89,水质总磷的测定)。
1.3.4 数据分析方法
数据采用统计软件SPSS10.0进行单因素方差分析 (one-way ANOVA),采用LSD和Tukey HSD法进行统计检验 (P<0.05)。

表1 实验所用生活废水水质Table 1 Water quality of domestic wastewater used in the experiments
2 结果与分析
2.1 栅藻在不同水源培养基中的生长
为了考察天然废水是否可以用于微藻培养,以OD730为细胞密度的指标,监测了栅藻在标准BG11、纯废水以及添加 BG11培养基全部营养成分的废水中生长情况,结果如图 1所示。在纯废水中,在前6天细胞可以获得一定的生长增殖,但6 d之后即停止生长,最终12 d后OD730值仅可达3.0。相对而言,在标准BG11与废水BG11培养液中,前8天细胞一直处于快速生长,之后进入稳定期,最终12 d后的OD730值分别达到8.37和10.5。收集了12 d培养后的藻细胞,测定其细胞干重,结果表明标准 BG11与废水BG11培养条件下的单位体积培养液中细胞干重分别可达 (5.07±0.09) g/L和 (8.12±0.08) g/L,而纯废水培养下仅能达到 (1.94±0.26) g/L。由于纯废水中总氮与总磷仅为 (17.8±0.1) mg/L 和 (1.05±0.01) mg/L,远远低于标准 BG11中的氮磷浓度,因此,氮磷等营养元素的缺乏应该是导致废水中微藻生长缓慢与生物量低的主要原因,向废水中添加充足的营养元素有可能获得好的培养效果。
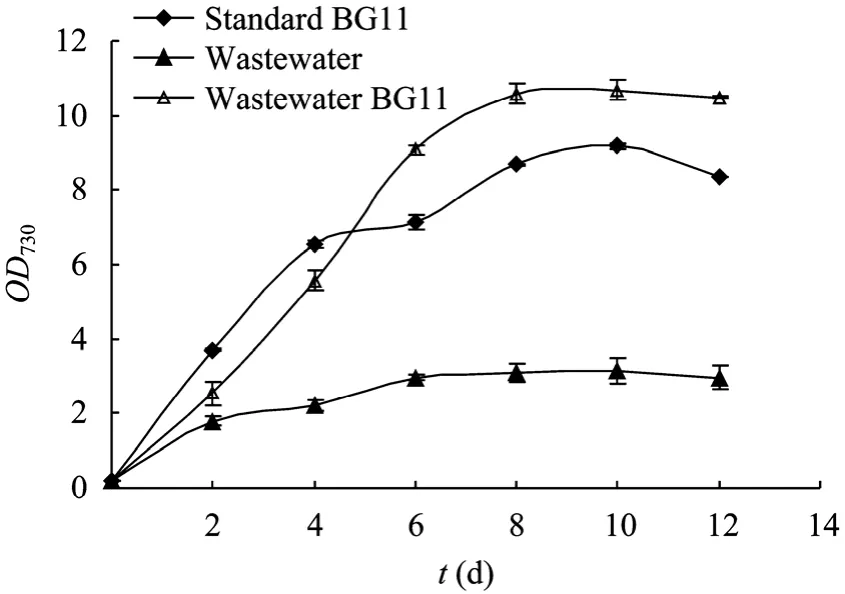
图1 不同水源的培养基对栅藻生长的影响Fig. 1 Growth of S. dimorphus in culture medium with different water resources.
2.2 废水中添加不同营养成分对栅藻培养的影响
2.2.1 实验设计
不同于标准 BG11是用自来水配制,废水中除了氮磷外,本身还存在多种多样的营养物质。为了降低培养基成本,我们以标准 BG11培养基各种营养母液和微量营养元素为基础,考察废水培养时哪些营养成分为微藻生长所必需,哪些非必需。实验设置了如表2中所示的1~8组营养元素组合条件,添加量按1.2节中标准BG11培养基。考虑到自然水体中的钙元素含量 (13.8~31.7 mg/L)[17],远高于BG11培养基中钙含量 (7.87 mg/L);同时柱式光反应器中培养微藻是连续通入 2% CO2的空气,不会存在碳源的不足,因此,1~8组中均不加入CaCl2·2H2O 与 Na2CO3成分。
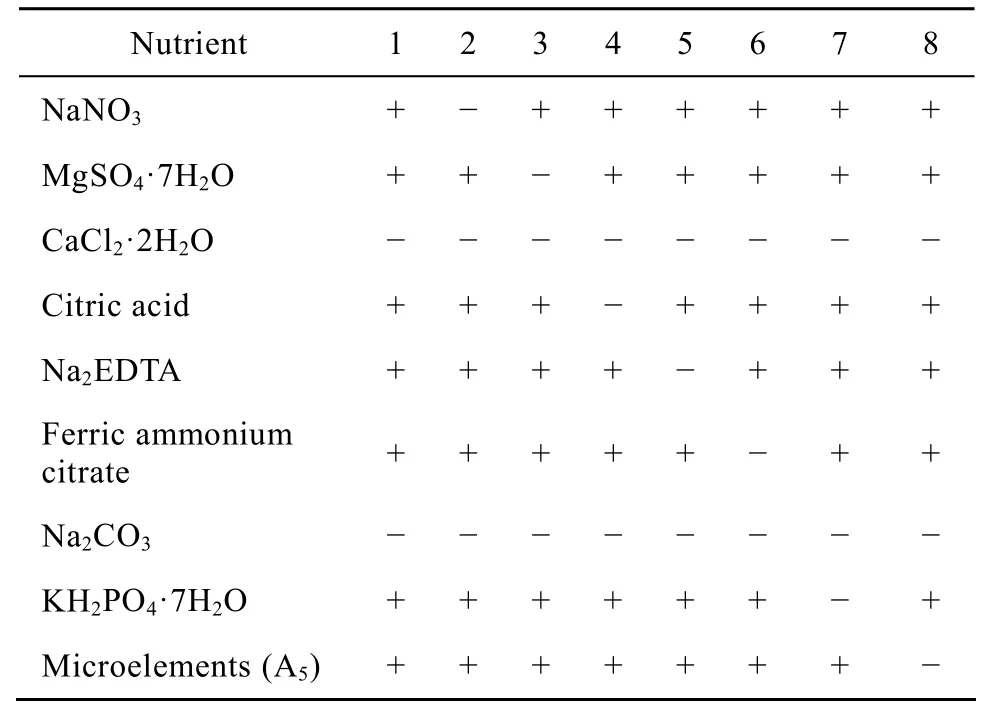
表2 废水培养基营养元素筛选的实验安排Table 2 Experimental arrangements for the determination of nutrients in wastewater medium
2.2.2 废水中不同成分对栅藻生长和油脂积累的影响
如图2所示,从第3、4、5、6、8组条件的OD730生长曲线看,在无镁离子、柠檬酸、EDTA、铁铵与微量元素添加的条件下,栅藻的生长同第 1组条件即全营养素添加的条件相比,无明显的差异;而从第2与第7组的生长曲线来看,在无额外的无机氮与无机磷补加条件下,相比于其他组条件,栅藻的生长明显受到限制,而且在第4天后就明显停止生长。因此若单纯从 OD730生长来分析,利用废水培养栅藻,镁离子、柠檬酸、EDTA、铁铵与微量元素不必添加,而无机氮与无机磷则必须补充。
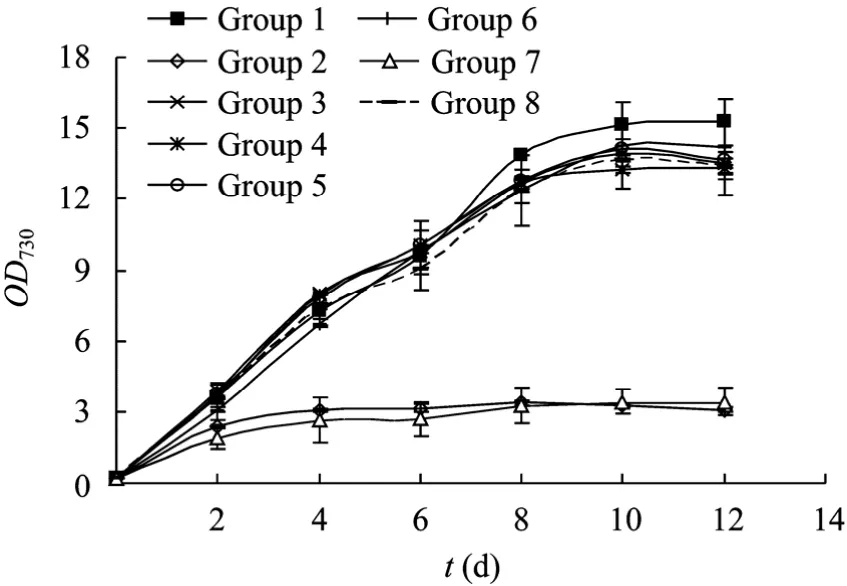
图2 废水添加不同营养素对栅藻生长的影响Fig. 2 Effects of different nutrients added in wastewater on the growth of S. dimorphus.
上述培养实验12 d后收集培养液,测定不同培养基组成下的细胞干重浓度,结果如图3所示。可以看出,第 1组全营养素添加条件下,培养 12 d后细胞干重可达 (8.77±0.03) g/L;相比而言,第3、4、5组条件下,细胞干重差异不大,分别可达(8.41±0.27) g/L、(8.42±0.23) g/L、(8.36±0.18) g/L;第 8组缺乏微量元素的情况下,细胞干重为(7.70±0.65) g/L,较上述3个条件低,表明微量元素对藻细胞的生产质产量也有较重要影响。第6组铁铵缺乏条件下,细胞干重相对较低,只有(5.40±1.30) g/L;第2与7组的无机氮与磷缺乏条件下,生物量积累最低,分别仅可达 (1.59±0.03) g/L、(2.75±0.34) g/L。将上述结果进行数据分析,以F值判断各因素对干重的影响水平,无机氮与无机磷对细胞干重的影响较大,且无机氮>无机磷,二者置信度在 95%以上 (即 P<0.05),这与上述直观分析相一致。
图3还给出不同培养基组成培养12 d后收集的藻细胞总脂含量的变化。从图中可以看出,与生物质产量受不同营养元素添加的影响不同,总脂含量在无额外磷条件下 (第7组) 最高,达到56.2%,其次为无额外氮 (第2组) 的培养条件为47.5%,与废水全 BG11条件的 29.9%对比,说明在废水培养栅藻时,氮、磷限制促进油脂积累,这与文献报道的斜生栅藻在氮缺乏、磷缺乏的条件下总脂积累高于氮、磷充足的培养条件下总脂含量相一致[9]。无额外添加柠檬酸铁铵 (第 7组) 条件下的总脂含量最低,为 23.5%,说明柠檬酸铁铵的不足限制了细胞油脂的积累。将上述结果进行数据分析,所有因素对细胞总脂含量的影响置信度均在95%以上,在本实验条件下的影响程度分别为:无机磷>柠檬酸铁铵>(无机氮、镁盐、Na2EDTA)>柠檬酸>微量元素,这与上述直观分析相一致。
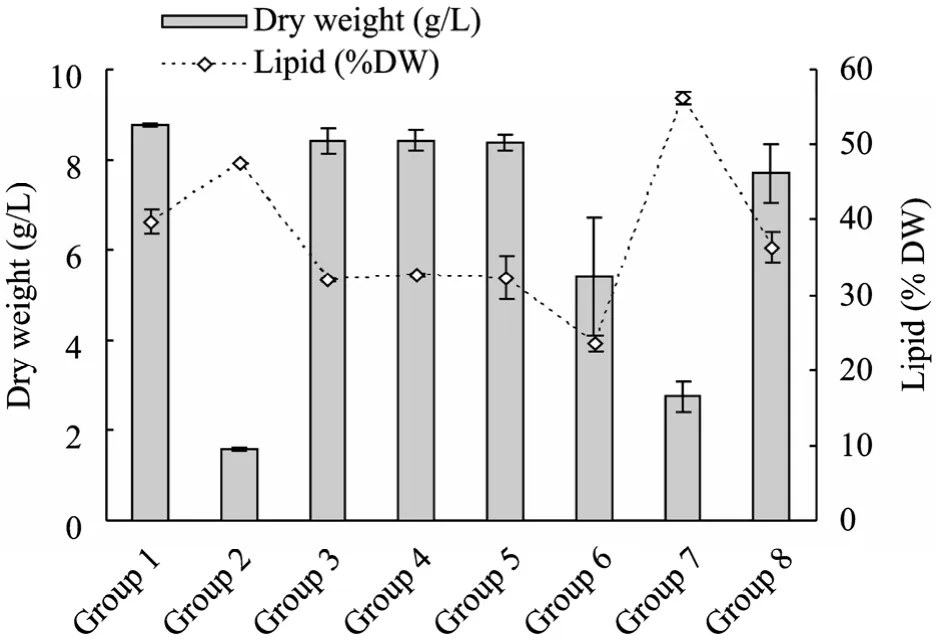
图3 不同条件下培养12 d后栅藻的生物质产量和总脂含量Fig. 3 Biomass production and total lipid content in different conditions after 12 days of cultivation.
综上所述,从不同废水培养基的微藻培养细胞干重以及总脂含量分析,无机氮、无机磷、柠檬酸铁铵以及微量元素是影响废水培养微藻生物量与油脂积累的重要营养组分,利用本实验选用的城市生活废水培养栅藻,无机氮、无机磷、柠檬酸铁铵以及微量元素是必须添加的营养组分。为了进一步确定无机氮、无机磷、柠檬酸铁铵等在废水培养基中的添加量对细胞生物产生和油脂积累的影响,从而确定合理的营养盐加入量。以上述生物质产量最高的第 1组营养素组合为基础,设计单因素浓度梯度实验,考察不同营养素浓度对栅藻生长的影响。
2.3 不同无机氮、无机磷、铁铵盐添加浓度下栅藻的生长
2.3.1 无机氮单因素实验
以 BG11的氮浓度为基准,考察了向生活废水分别添加 0.25、0.5、0.75、1、1.5和 2倍无机氮,即 61.75、123.5、185.25、247、370.5、494 mg/L 浓度条件下,栅藻废水培养12 d后的藻细胞浓度 (干重)、总脂含量、培养基TN的消耗情况,结果如图4和图5所示。
“在翻译过程中,有时译者想把源语所承载的各种文化信息转译到译入语中,因此“直译”是他们的第一选择。直译带有浓厚的源语文化痕迹”(赵德全,2009)。[14]
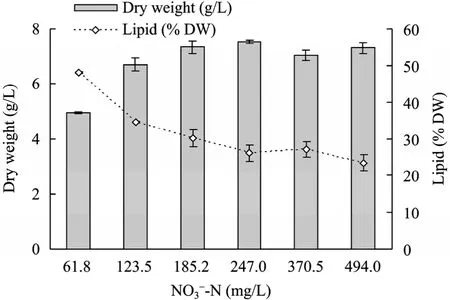
图4 不同氮浓度的废水BG11培养12 d后的藻细胞浓度与总脂含量Fig. 4 Biomass and total lipid content cultured in wastewater BG11 with different nitrogen gradients after 12 days of cultivation.
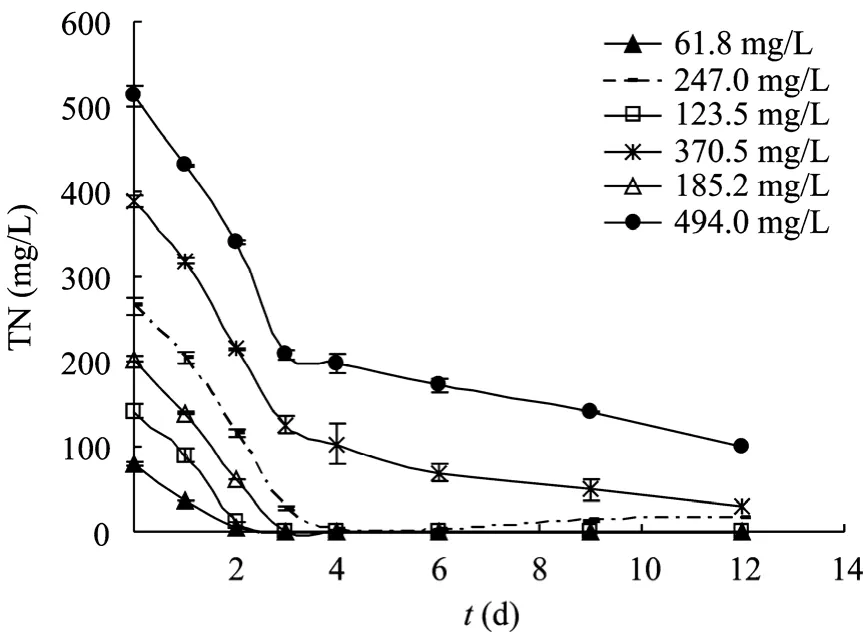
图5 不同氮浓度的废水BG11培养栅藻时的TN变化曲线Fig. 5 TN consumption in wastewater BG11 with different nitrogen gradients.
在 1倍氮条件下 12 d的废水培养可以获得(7.5±0.05) g/L 的生物量和 (26.1±2.2)%的油脂含量,2倍氮条件下生物量与总脂含量分别为(7.3±0.2) g/L、(23.4±2.2)%,表明继续增加氮浓度,并不能提高最终的藻细胞浓度,反而对细胞内的油脂积累产生抑制作用。降低废水培养基中的初始氮添加量,则利于细胞内油脂的积累,但细胞生长受到一定限制,最终细胞浓度偏低,生物量积累产生明显的抑制趋势,如在0.25倍BG11氮浓度的培养基中,总脂含量可达 (48.2±0.2)%,但生物量仅有(5.00±0.03) g/L。
另外,从图5所示不同氮浓度的废水培养基中TN的消耗过程曲线来看,接种后的前4天TN消耗最快。在这个时期,栅藻细胞快速的从培养液中摄取氮源供其快速生长。其中在0.25、0.5和0.75倍氮条件下,几乎100%的TN被细胞吸附,在培养4 d后的培养液中甚至完全检测不到氮的存在,同时0.75倍氮条件下,12 d培养获得的生物量与油脂含量分别为 (7.3±0.2) g/L、(30.1±2.4)%,相比于1倍与 1.5倍氮条件,生物量并没有明显减少,同时油脂含量大大提高。
2.3.2 无机磷单因素实验
以 BG11的磷浓度为基准,考察了向生活废水分别添加 0.25、0.5、0.75、1、1.5和2倍无机磷,即 2.01、4.03、6.04、8.05、12.08、16.1 mg/L 浓度条件下,培养12 d后培养基中藻细胞浓度 (干重)、细胞内总脂含量和TP消耗情况,结果如图6和图7所示。
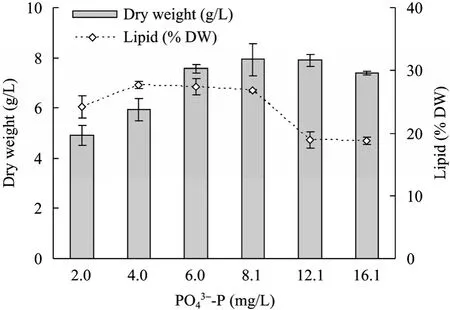
图6 不同磷浓度的废水BG11培养12 d后的藻细胞浓度与总脂含量Fig. 6 Biomass and total lipid content cultured in wastewater BG11 with different phosphorus gradients after 12 days of cultivation.
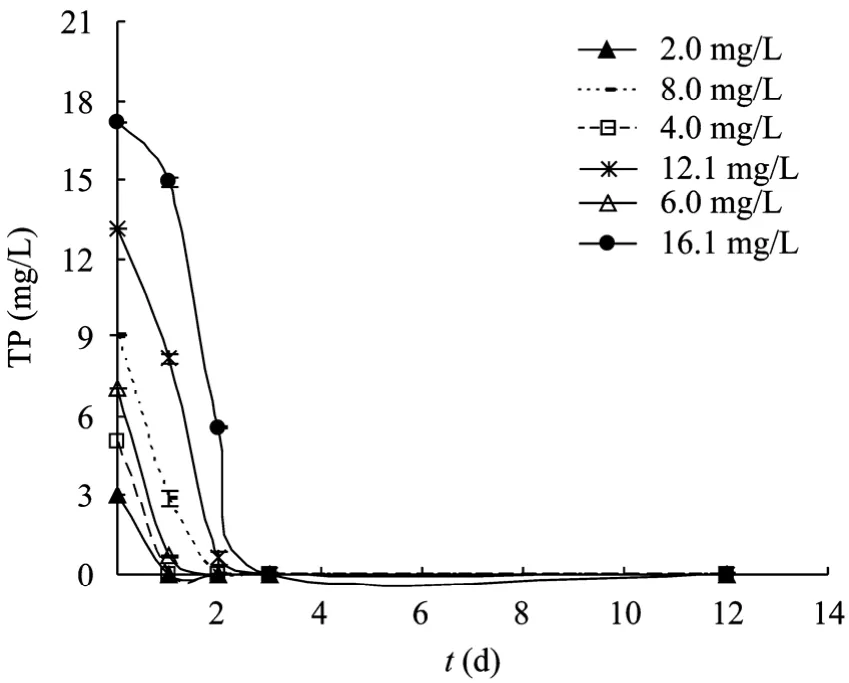
图7 不同磷浓度的废水BG11培养栅藻时的TP变化曲线Fig. 7 TP consumption in wastewater BG11 with different phosphorus gradients.
在 1倍磷条件下 12 d的废水培养可以获得(7.9±0.62) g/L的生物量和 (26.8±0.19)%的总脂含量,在 2倍磷的条件下,生物量与总脂含量分别为(7.4±0.24) g/L、(18.8±0.58)%。表明过高的磷浓度,并不能提高最终的藻细胞浓度,反而降低了细胞内的总脂含量。当培养基中的总磷浓度小于等于1倍磷时,细胞内的总脂含量变化不大,但低磷时由于细胞合成磷的不足会影响藻细胞的生长,生物量降低。
从图7给出的不同总磷浓度的培养基中TP的变化来看,栅藻细胞对磷的吸收比对氮的吸收更快。培养3 d后,各个条件的培养基中都完全不能检测到磷的存在,100%的磷都被藻细胞所摄取。
2.3.3 无机柠檬酸铁铵单因素实验
以 BG11的柠檬酸铁铵浓度为基准,考察了向生活废水分别添加 0.25、0.5、0.75、1、1.5和2倍柠檬酸铁铵,即1.5、3、4.5、6、9、12 mg/L浓度条件下,栅藻废水培养12 d后培养基中的藻细胞浓度 (干重) 和总脂含量,结果如图8所示。

图8 不同柠檬酸铁铵浓度的废水BG11培养12 d后的藻细胞浓度与总脂含量Fig. 8 Biomass and total lipid content cultured in wastewater BG11 with different ferric ammonium citrate gradients after 12 days of cultivation.
3 结论
本研究利用青岛张村河排污口的生活废水作为水源,以栅藻S. dimorphus为产油模式藻探讨了在气泡柱式光生物反应器培养的可行性。结果表明,该栅藻能够很好地适应城市生活废水。生活废水中只需要添加适量的无机氮与磷,柠檬酸铁铵和微量元素,即可较好地用于微藻的培养与油脂生产。氮、磷限制以及柠檬酸铁铵对细胞总脂含量具有诱导作用。在废水中添加247 mg/L无机氮、8.05 mg/L无机磷、4.5 mg/L柠檬酸铁铵和足量微量元素的条件下,培养12 d微藻生物量和含油量可达8 g/L,38%左右的水平。同时,对培养中水体TN与TP残留的检测结果发现,微藻对无机氮与磷均有着高效的吸收机制,在合适的加入量下培养3~4 d后的水体,已经完全检测不到氮与磷的存在。因此,城市生活废水用于含油微藻的培养前景广阔,仅通过部分营养元素的添加,即可获得高密度与高含油的微藻生物质,而且使用后水体中无机氮与无机磷甚至低于原生活废水水体,在产生巨大的经济和社会效益的同时,还减轻了后续水处理中无机氮与无机磷难以去除的困难,可以缓解城市发展对环境保护的压力,对于我国城镇化发展具有重要意义。
REFERENCES
[1] Chisti Y. Biodiesel from microalgae. Biotechnol Adv,2007, 25(3): 294−306.
[2] Schenk PM, Thomas-Hall SR, Stephens E, et al. Second generation biofuels: high-efficiency microalgae for biodiesel production. Bioenergy Res, 2008, 1(1): 20−43.
[3] Miao XL, Wu QY. Biodiesel production from heterotrophic microalgal oil. Bioresour Technol, 2006,97(6): 841−846.
[4] Weyer KM, Bush DR, Darzins A, et al. Theoretical maximum algal oil production. Bioenergy Res, 2010, 3(2):204−213.
[5] Hu Q, Sommerfeld M, Jarvis E, et al. Microalgal triacylglycerols as feedstocks for biofuel production:perspectives and advances. Plant J, 2008, 54(4): 621−639.
[6] Mata TM, Martins AA, Caetano NS. Microalgae for biodiesel production and other applications: a review.Renew Sustain Energy Rev, 2010, 14(1): 217−232.
[7] Zhang ED, Wang B, Wang QH, et al. Ammonia−nitrogen and orthophosphate removal by immobilized Scenedesmus sp. isolated from municipal wastewater for potential use in tertiary treatment. Bioresour Technol, 2008, 99(9):3787−3793.
[8] Martínez ME, Sánchez S, Jiménez JM, et al. Nitrogen and phosphorus removal from urban wastewater by the microalga Scenedesmus obliquus. Bioresour Technol,2000, 73(3): 263−272.
[9] Mandal S, Mallick N. Microalga Scenedesmus obliquus as a potential source for biodiesel production. Appl Microbiol Biotechnol, 2009, 84(2): 281−291.
[10] Kim MK, Park JW, Park CS, et al. Enhanced production of Scenedesmus spp. (green microalgae) using a new medium containing fermented swine wastewater. Bioresour Technol, 2007, 98(11): 2220−2228.
[11] Chinnasamy S, Bhatnagar A, Hunt RW, et al. Microalgae cultivation in a wastewater dominated by carpet mill effluents for biofuel applications. Bioresour Technol,2010, 101(9): 3097−3105.
[12] Li X, Hu HY, Yang J. Lipid accumulation and nutrient removal properties of a newly isolated freshwater microalga, Scenedesmus sp. LX1, growing in secondary effluent. New Biotechnol, 2010, 27(1): 59−63.
[13] Zhang J, Xia XF, Jia CR, et al. Analysis of scenario and factors on China’s urban wastewater emission. Resour Dev Market, 2009, 25(5): 397−399.
张军, 夏训峰, 贾春蓉, 等. 中国城镇生活废水排放量影响因素及情景分析. 资源开发与市场, 2009, 25(5):397−399.
[14] Wu MC. The current situation and prospects of biodiesel development in China. J Huazhong Agr Univ: Social Sci Ed, 2010, 88(4): 5−8.
吴谋成. 我国生物柴油发展的现状与展望. 华中农业大学学报: 社会科学版, 2010, 88(4): 5−8.
[15] Stainier RY, Kunisawa R, Mandel M, et al. Purification and properties of unicellular blue-green algae (order Chroococcales). Bacteriol Rev, 1971, 35(2): 171−205.
[16] Bligh EG, Dyer WJ. A rapid method for total lipid extraction and purification. Can J Biochem Physiol, 1959,37(8): 911−917.
[17] Qiu BS, Liu JY, Liu ZL, et al. Distribution and ecology of the edible cyanobacterium Ge-Xian-Mi (Nostoc) in rice fields of Hefeng County in China. J App Phycol, 2002,14(5): 423−429.
Cultivating an oleaginous microalgae with municipal wastewater
Sujuan Lü1,2, Wei Zhang2, Xiaowei Peng2, Xiaolin Chen2, and Tianzhong Liu2
1 School of Food Science and Engineering, Ocean University of China, Qingdao 266003, China
2 Key Laboratory of Biofuel, Qingdao Institute of Bioenergy and Bioprocess Technology, Chinese Academy of Sciences, Qingdao 266101, China
Received: October 8, 2010; Accepted: December 28, 2010
Supported by: Key Scientific and Technological Projects of Shandong Province (No. 2008GG20007002), Solar Energy Strategy of Chinese Academy of Sciences (No. KGCX2-YW-374-4).
Corresponding author: Wei Zhang. Tel: +86-532-80662737; E-mail: zhangwei@qibebt.ac.cn Tianzhong Liu. Tel: +86-532-80662735; E-mail: liutz@qibebt.ac.cn
山东省科技攻关项目 (No. 2008GG20007002),中国科学院太阳能计划 (No. KGCX2-YW-374-4) 资助。

