富锂锂锰氧化物的制备及其在溶液中的抽Li+/吸Li+性能
马立文 陈白珍 石西昌 冯大伟
(中南大学冶金科学与工程学院,长沙 410083)
富锂锂锰氧化物的制备及其在溶液中的抽Li+/吸Li+性能
马立文 陈白珍 石西昌*冯大伟
(中南大学冶金科学与工程学院,长沙 410083)
采用柠檬酸配合法合成了系列尖晶石富锂锂锰氧化物Li2O·nMnO2(n=1.75,2.0,2.25,2.5,3.0)。通过X射线衍射(XRD)和酸浸实验发现,350℃合成的Li2O·2.25MnO2具有纯相尖晶石锂锰氧化物结构,且在弱酸性介质中具有较高的锂溶出率和较低的锰溶损率。Li2O·2.25MnO2在酸浸之后转型为锂离子筛。XRD和扫描电子显微镜(SEM)分析发现锂离子筛能够保持尖晶石锂锰氧化物的结构和形貌。吸附实验表明,该锂离子筛在碱性含锂溶液中对Li+具有吸附性能,且吸附容量随着溶液温度和pH值的升高而增大,最高能达到40.14 mg·g-1。通过傅立叶红外光谱(FTIR)研究了锂离子筛的吸附机理,并用Langmuir模型描述了其在LiCl+LiOH溶液中的吸附行为。
锂锰氧化物;锂离子筛;结构;稳定性;吸附
随着国民经济和国防建设的发展,人类对锂及其化合物的需求不断扩大。由于陆上锂资源逐渐匮乏,利用无机锂吸附剂(锂离子筛)从海水和盐湖卤水等低浓度液态锂资源中提取锂已成为世界各国锂资源开发利用的研究热点[1-2]。
尖晶石型锂锰氧化物LiMn2O4经过酸浸处理,其结构中8a位置的Li+被抽出,可以形成对Li+具有特异吸附性能的λ-MnO2(锂离子筛)[3]。在酸浸抽Li+过程中,LiMn2O4中的Mn3+会发生歧化反应,生成Mn4+和 Mn2+。 Mn4+保留在 λ-MnO2中,而 Mn2+溶解于溶液[4-5]。Mn2+的溶解逐步导致尖晶石结构被破坏,从而限制锂离子筛的应用。为了克服这一缺点,研究者对LiMn2O4进行元素掺杂[6-7]或合成富锂锂锰氧化物Li1.33Mn1.67O4和 Li1.6Mn1.6O4[8-9]。某些掺杂元素能够稳定尖晶石结构,但是总体效果不够理想。而富锂锂锰氧化物中的Mn皆为+4价,因此在酸浸过程中能够避免Mn的溶损,提高尖晶石结构的稳定性。只含Mn4+的富锂锂锰氧化物可以统一用通式Li2O·nMnO2表示[10],当n=2和n=2.5时,其对应的富锂锂锰氧化物就 是 Li1.6Mn1.6O4和 Li1.33Mn1.67O4。 由 Li-Mn-O 相 图[10](图1)可知,Li2O·nMnO2的所有化合物存在于Li2O和λ-MnO2的连线之间。因此,通过调整n的值,理论上将可以得到所有只含Mn4+的富锂锂锰氧化物。
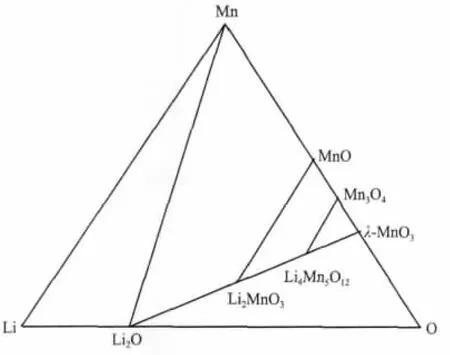
图1 Li-Mn-O体系相图Fig.Li-Mn-O phase diagram
但是,由于Li-Mn-O能形成多种化合物,而且这些化合物在不同条件下又可以相互转化[11],要制得某种具有严格化学配比的单相尖晶石锂锰氧化物是较困难的。而这类只含Mn4+的富锂尖晶石锂锰氧化物则几乎不能通过一般的固相合成法得到。文献报道的 Li1.33Mn1.67O4和 Li1.6Mn1.6O4均是通过水热法作为中间步骤,再经过热处理制得。为此,有必要开发一种相对简单的合成富锂锂锰氧化物的方法。
本工作采用乙酸锂和乙酸锰为原料,柠檬酸为配合剂,合成了系列富锂锂锰氧化物Li2O·nMnO2(n=1.75,2.0,2.25,2.5,3.0), 并对其在简单的水溶液体系中的抽Li+和吸Li+性能进行了初步研究。其中,Li2O·2.25MnO2在弱酸性介质中具有较高的锂溶出率和较低的锰溶损率,其对应的锂离子筛具有较为稳定的结构和形貌,对Li+也具有良好的吸附性能。
1 实验部分
1.1 Li2O·nMnO2材料的合成
分别将化学计量配比的乙酸锂(Li(CH3COO)·4H2O)和乙酸锰(Mn(CH3COO)2·4H2O)溶解于去离子水中形成系列透明溶液。按照物质的量的配比n柠檬酸/(nLi+nMn)=1将此透明溶液在不断搅拌下逐滴加入到柠檬酸溶液中,在80℃下反应2 h。随后将得到的混合物在150℃下烘12 h并研磨,得到系列干燥的淡黄色粉末。将这些淡黄色粉末按照10℃·min-1的升温速度升至400℃后保温12 h,随后自然降温, 研磨后即得到产物 Li2O·nMnO2(n=1.75,2.0,2.25,2.5,3.0)。 此外, 按照相同热处理制度分别在350、450 和 550 ℃下合成 Li2O·2.25MnO2样品,以考察温度对产物的影响。
1.2 Li2O·nMnO2材料的静态酸浸
分别称取约 0.1 g Li2O·nMnO2(n=1.75,2.0,2.25,2.5,3.0) 放入 100 mL 0.5 mol·L-1的 HCl溶液中,在不同时间取上清液用原子吸收分光光度计(TAS-999F,北京)测定其中的Li+和Mn2+离子浓度,考察其溶出情况。Li和Mn的溶出率用公式(1)计算。类似地, 对 350、450 和 550 ℃下合成 Li2O·2.25MnO2的样品进行酸浸,测定其Li和Mn的溶出率。

其中RK为元素K(Li或Mn)的溶出率,mK为K在溶液中的质量,为K在固体样品中的质量。
1.3 Li2O·2.25MnO2材料对 Li+的吸附
酸浸处理后,350 ℃下合成的 Li2O·2.25MnO2转型为锂离子筛,记为S-2.25。在25℃下,分别将0.1 g S-2.25 浸 泡 于 一 系 列 50 mL 的 (HCl+LiCl+LiOH)混合溶液中进行吸锂实验。溶液Li+浓度固定为 0.05 mol·L-1,pH 值介于 2~13 之间。 吸附 24 h 达到平衡后用原子吸收分光光度计测定溶液中的Li+含量。锂离子筛的Li+吸附容量用公式(2)进行计算。

式中Qe为Li+吸附容量;C0和Ce分别为溶液中初始和平衡后的Li+浓度,V是溶液的体积;m是锂离子筛的质量。此外,改变含锂溶液的温度和初始Li+浓度,对锂离子筛S-2.25的Li+吸附性能进行研究。
1.4 材料的表征
将 得 到 的 Li2O·nMnO2(n=1.75,2.0,2.25,2.5,3.0) 和不同温度获得的 Li2O·2.25MnO2用 X 射线衍射仪(D/max-2550,日本)进行XRD检测,分析其物相。 辐射源为 Cu Kα (经 Kα2剥离处理,λ=0.15406 nm),石墨单色器,靶电压为40 kV,靶电流为40 mA,扫描范围为10°~80°。 采用 EDTA 配位滴定法[12]测定Li2O·nMnO2系列样品的Mn平均化合价。此外,采用X射线衍射仪和场发射扫描电镜(Sirion200,荷兰),在加速电压为20 kV条件下,对Li2O·2.25MnO2和锂离子筛S-2.25进行SEM检测。最后采用傅立叶红外光谱仪(Nicolet 6700,美国),对350℃下合成的 Li2O·2.25MnO2、S-2.25以及 S-2.25在不同溶液中吸附后的样品进行检测,分析其结构变化。
2 结果与讨论
2.1 Li2O·nMnO2的结构和性能
2.1.1 Li2O·nMnO2的结构
对采用柠檬酸配合法在400℃下合成的Li2O·nMnO2(n=1.75,2.0,2.25,2.5,3.0)进行 XRD 分析,结果如图2所示。图2中菱形图案标示的是尖晶石锂锰氧化物的特征峰。由图2可知,Li2O·nMnO2全部以尖晶石锂锰氧化物为主相。当n=2.25、2.5和3.0时,Li2O·nMnO2为纯相。而当n=1.75和2.0时,产物中出现了Li2MnO3杂相,且含量随着富锂量增大而增多。Li2MnO3是合成富锂锂锰氧化物时经常出现的杂相[13],属于单斜晶系。这说明,采用柠檬酸配合法能够合成富锂锂锰氧化物,但是当加入的锂过多,则不能完全纳入尖晶石晶格,会形成独立稳定的杂相Li2MnO3。Li2MnO3在酸性介质中几乎没有Li+脱出[14],对产物的抽Li+吸Li+性能将产生负面影响。因此,柠檬酸配合法能够合成的最大含锂量的富锂氧化物是 Li2O·2.25MnO2。

图2 400℃合成的Li2O·nMnO2(n=1.75,2.0,2.25,2.5,3.0)样品的XRD图Fig.2 XRD patterns of Li2O·nMnO2(n=1.75,2.0,2.25,2.5,3.0)prepared at 400℃
2.1.2 Li2O·nMnO2的Mn平均价态分析
采用EDTA滴定法测定富锂锂锰氧化物中Mn的平均价态,其结果如图3所示。从图3中可以看出,各Li2O·nMnO2中 Mn的平均化合价均高于LiMn2O4中的Mn平均化合价3.5,达到3.8以上,并随着富锂程度的增加而升高。这说明富锂锂锰氧化物中Mn3+含量大大降低,这有助于降低材料在酸浸过程中Mn的溶损,提高材料的稳定性。对于n=1.75和n=2.0的样品,虽然其Mn平均化合价非常接近+4,但由于这2个样品中含有Li2MnO3杂相,高的Mn平均化合价有一部分来自结构更稳定的Li2MnO3的贡献。对于纯相化合物Li2O·nMnO2(n=2.25,2.5,3.0),Li2O·2.25MnO2显示出最高的 Mn 平均化合价,达到3.93。证明该纯相材料中含有最低含量的Mn3+,结构最稳定。

图 3 400℃合成的 Li2O·nMnO2(n=1.75,2.0,2.25,2.5,3.0)样品的 Mn 平均化合价Fig.3 Average valence state of manganese of Li2O·nMnO2(n=1.75,2.0,2.25,2.5,3.0)prepared at 400℃
2.1.3 Li2O·nMnO2的酸浸实验
将约 0.1 g Li2O·nMnO2(n=1.75,2.0,2.25,2.5,3.0)放入 100 mL 0.5 mol·L-1的 HCl溶液中,24 h 后测定各Li和Mn的溶出率,结果如图4所示。从图4中可以看出,Li和Mn的溶出率均随着富锂程度的降低(n值增大)而增加。在酸浸过程中,Li的溶出率大,有利于增加后续的吸锂容量;而Mn的溶出率大,则不利于结构的稳定。当n≥2.25时,Li2O·nMnO2的Li溶出率基本不变,接近95%;而Mn的溶出率从5%增加到10%。当n=1.75和2.0时,Li2O·nMnO2的Mn溶出率低于4%,但Li溶出率也明显降低,低于85%。这说明,由于惰性杂相Li2MnO3的影响,Li2O·nMnO2(n=1.75,2.0)的 Li和 Mn 的溶出率均降低,而对于纯相材料Li2O·nMnO2(n=2.25,2.5,3.0),Li2O·2.25MnO2具有较高的 Li溶出率,同时Mn溶出率最低,综合性能最好。
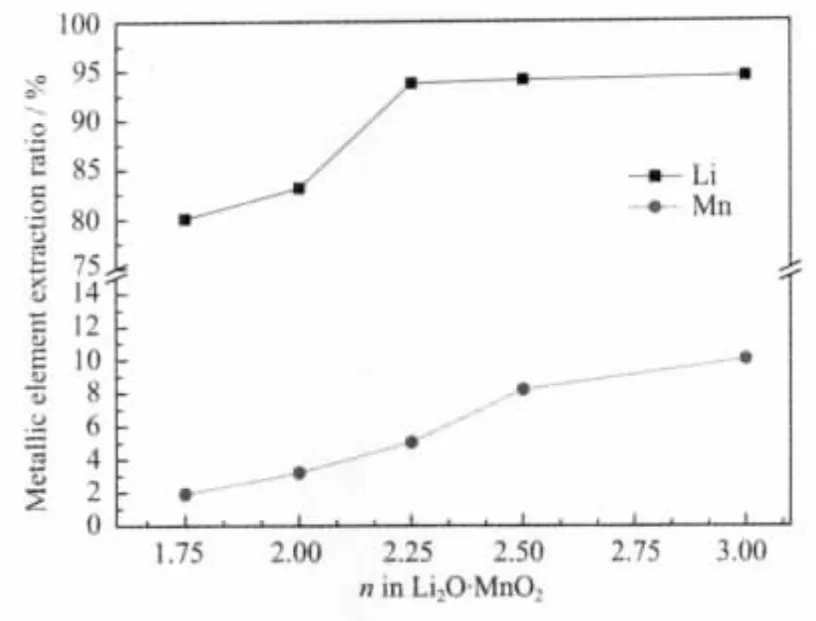
图4 400℃合成的Li2O·nMnO2(n=1.75,2.0,2.25,2.5,3.0)样品的Li和Mn的溶出率Fig.4 Li and Mn extraction ratios of Li2O·nMnO2(n=1.75,2.0,2.25,2.5,3.0)prepared at 400℃
2.2 不同温度下合成的Li2O·2.25MnO2
2.2.1 不同温度下合成的Li2O·2.25MnO2的结构
分别对 350、450和 550℃下合成的 Li2O·2.25MnO2进行XRD检测,结果如图5所示。从图5中可以看出,350、450和 550℃下合成的 Li2O·2.25MnO2均得到了尖晶石锂锰氧化物纯相,但随着合成温度的升高,XRD衍射峰逐渐变得更加尖锐。这说明,升高温度,产物的结晶度增加[15]。结晶度的增加将对材料Li和Mn的溶出率产生影响。

图5 不同温度下合成的Li2O·2.25MnO2样品的XRD图Fig.5 XRD patterns of Li2O·2.25MnO2prepared at different temperatures
2.2.2 不同温度下合成的Li2O·2.25MnO2的酸浸
分别对 350、450和 550℃下合成的 Li2O·2.25MnO2进行酸浸实验,检测其Li和Mn的溶出率,结果如图6所示。从图6可以看出,随着合成温度的增加,Li2O·2.25MnO2样品的Li溶出率逐渐从95%减小到85%;而Mn溶出率变化不大,均维持在5%左右。温度对Li和Mn的溶出率有不同的影响,是因为这两种离子溶出机理不同。锂离子溶出主要是离子交换溶出,而锰离子溶出主要是溶解溶出。离子交换溶出会受晶体结构的影响,而溶解溶出主要受Mn3+含量的影响。随着合成温度的升高,Li2O·2.25MnO2的结晶度不断增大,导致Li+难以从晶格中脱出;而在一定温度范围内,富锂锂锰氧化物中Mn3+的含量变化不大,故Mn溶出率变化不大。为尽可能地提高 Li溶出率和降低Mn溶损率,Li2O·2.25MnO2的合成温度宜选用350℃。

图6 不同温度下合成的Li2O·2.25MnO2样品的Li和Mn溶出率Fig.6 Li and Mn extraction ratios of Li2O·2.25MnO2prepared at different temperatures
2.3 锂离子筛S-2.25的结构和形貌
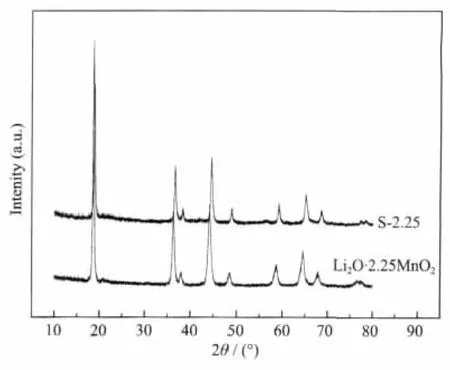
图7 Li2O·2.25MnO2和S-2.25的XRD对比图Fig.7 XRD patterns of Li2O·2.25MnO2and S-2.25
350℃合成的Li2O·2.25MnO2进行酸浸后得到锂离子筛S-2.25。对Li2O·2.25MnO2和S-2.25进行XRD分析,结果如图7。从图7可以看出,Li2O·2.25MnO2和S-2.25的结构基本相同,但是S-2.25的各衍射峰的位置相对于Li2O·2.25MnO2轻微向高角度偏移。这说明酸浸过程中Li2O·2.25MnO2材料中的Li+被HCl中的H+置换出来,晶格收缩。锂离子筛S-2.25完整地保持了Li2O·2.25MnO2的尖晶石骨架。用扫描电镜对比分析Li2O·2.25MnO2和S-2.25的形貌 , 如 图 8(a)和 (b)。 由 图 8(a)和 (b)可 知 ,Li2O·2.25MnO2和S-2.25的形貌相似,没有形成明显的颗粒,而是呈现不规则的聚集状态。这说明Li2O·2.25MnO2酸浸过程中其骨架具有良好的稳定性,形貌基本不变。

图8 Li2O·2.25MnO2和S-2.25的SEM照片Fig.8 SEM images of Li2O·2.25MnO2and S-2.25
2.4 锂离子筛S-2.25的Li+吸附性能
2.4.1 不同pH值溶液中S-2.25对Li+的吸附
分别将0.1 g锂离子筛S-2.25浸泡于不同pH值的含锂溶液中,吸附24 h达到平衡后测定其对Li+的吸附容量,如图9所示。从图9中可以看到,在pH值小于11之前,随着溶液pH值的升高,锂离子筛S-2.25对Li+的吸附容量缓慢增加;当pH大于11,S-2.25的Li+吸附容量急剧升高。当溶液pH=13时,Li+吸附容量最大,达到 38.33 mg·g-1。 高 pH 值有利于锂离子筛对Li+的吸附,这一规律与文献报道[16]的一致。其原因是,当锂离子筛中只含Mn4+的时候,它在吸附过程中符合H+-Li+离子交换机理[17]。溶液pH值越高,OH-浓度越大,越容易促使锂离子筛上的H+与溶液中的Li+进行交换。

图9 锂离子筛S-2.25在不同pH值溶液中的Li+吸附容量Fig.9 Li+adsorption capacities for lithium ion-sieve S-2.25 in solution with different pH values
2.4.2 S-2.25在不同温度下对Li+的吸附
将约0.1 g锂离子筛S-2.25浸泡于pH=13的LiOH溶液中,在不同温度下吸附24 h后,测定其Li+吸附容量,结果如图10所示。从图10可以看出,随着温度的升高,锂离子筛S-2.25对Li+的吸附容量逐渐增大;当温度达到25℃以上,吸附容量变化不大,均在 38 mg·g-1以上,最高可达 40.14 mg·g-1这说明锂离子筛S-2.25在25℃时对Li+的吸附能力已基本达到饱和。

图10 不同温度下锂离子筛S-2.25在LiOH溶液中的Li+吸附容量Fig.10 Li+adsorption capacity for lithium ion-sieve S-2.25inLiOHsolutionatdifferenttemperatures
2.5 锂离子筛S-2.25的Li+吸附机理
2.5.1 锂离子筛S-2.25的红外光谱分析
为了探讨锂离子筛S-2.25在不同pH值溶液中的吸附机理,对Li2O·2.25MnO2、S-2.25以及S-2.25在LiCl溶液和在LiOH溶液中吸附后的样品 (标记为2.25-LiCl和2.25-LiOH)进行红外光谱分析,如图11 所示。 从图 11 中可以看出,Li2O·2.25MnO2、S-2.25、2.25-LiCl和 2.25-LiOH 中均在 3440、1630 cm-1以及750~400 cm-1之间出现吸收峰,这些吸收峰分别对应该4个样品共有的尖晶石锰氧化物中的吸附水的伸缩振动、弯曲振动以及Mn-O键的伸缩振动[18]。 对于 Li2O·2.25MnO2,还在 1499 和 1442 cm-1处存在2个吸收峰,这也是由吸附水的弯曲振动所引起。对于S-2.25,1499和1442 cm-1处吸附水的弯曲振动峰消失了,取而代之的是一个910 cm-1的H+耦合振动。这说明在Li2O·2.25MnO2转型为锂离子筛S-2.25的酸浸处理过程中,Li+的溶出会导致 Li2O·2.25MnO2结构的变化;而这个过程中除了存在Li+和Mn2+的溶出,还存在H+的吸附。这可以验证酸浸过程中的Li+-H+离子交换机理。对于2.25-LiCl,可以发现,其红外吸收光谱与S-2.25几乎一致。据此可以推断,在LiCl溶液中,S-2.25对Li+几乎没有吸附性能。这与2.4.1 节中, 锂离子筛 S-2.25 在 pH=7 的 LiCl溶液中几乎没有吸附容量的实验结果相一致。对于2.25-LiOH,可以发现,910 cm-1的H+耦合振动峰消失了,说明S-2.25经过LiOH溶液的浸泡,其中的H+消失。联系 2.4.1 节锂离子筛 S-2.25 在 pH=13 的 LiOH 溶液中具有可观吸附容量的实验事实可以知道,吸附过程中同样存在H+-Li+离子交换过程。因此,红外光谱中910 cm-1处的H+耦合振动峰可以认为是Li+-H+离子交换过程的证据;它的出现和消失,与Li2O·2.25MnO2的抽 Li+/吸 Li+性质密切相关。

图11 Li2O·2.25MnO2、S-2.25、2.25-LiCl和 2.25-LiOH的红外光谱Fig.11 IR spectra of Li2O·2.25MnO2,S-2.25,2.25-LiCl and 2.25-LiOH
2.5.2 锂离子筛 S-2.25 的吸附模型
根据文献[19-20],只含Mn4+的锂离子筛的吸附行为符合Li+-H+离子交换机理,这一机理可以很好地用Langmuir模型描述。分别用Langmuir和Freundlich吸附等温模型(公式(3)和公式(4))对锂离子筛S-2.25在含不同Li+浓度的溶液中(pH=13)的Li+吸附行为进行拟合,得到数据拟合图12。从图12中可以看出,S-2.25对 Langmuir模型拟合(L-Fit)的相关系数为0.99741,高于对 Freundlich 模型拟合(F-Fit)的相关系数0.85568。 这说明锂离子筛S-2.25在含Li+溶液中的吸附行为符合Langmuir模型,也间接印证了锂离子筛吸附的Li+-H+离子交换机理。从Langmuir拟合直线的斜率和截距求得Qm和KL分别为38.40 mg·g-1和 0.107 5 L·mg-1。
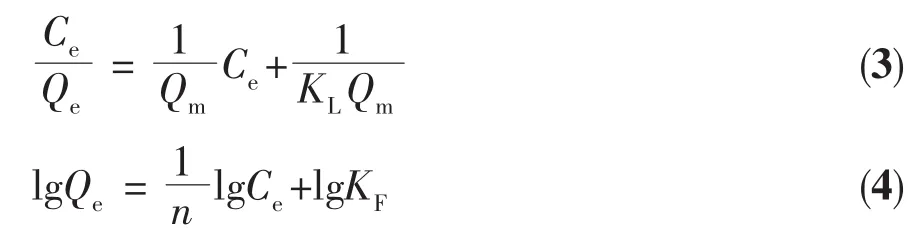
式中,Ce代表溶液中的Li+平衡浓度,Qe是Li+平衡吸附容量,Qm是理论最大Li+吸附容量,KL是Langmuir经验常数,KF和n分别代表与吸附容量和吸附强度相关的Freundlich常数。

图12 锂离子筛 S-2.25吸附 Li+的 Langmuir(L-Fit)和Freundlich(F-Fit)吸附等温模型Fig.12 Langmuir(L-Fit)and Freundlich(F-Fit)isotherms for Li+adsorption by sieve S-2.25
3 结 论
(1)通过柠檬酸配合法合成了系列尖晶石富锂锂锰氧化物 Li2O·nMnO2(n=1.75,2.0,2.25,2.5,3.0),其最佳合成配比n=2.25,最佳合成温度为350℃。
(2)350℃合成的Li2O·2.25MnO2具有纯相尖晶石锂锰氧化物结构,结晶度较低,在弱酸性介质中具有高Li溶出率和低Mn溶损率。其酸浸后转型为锂离子筛S-2.25。S-2.25仍然保持尖晶石的结构和形貌。
(3)S-2.25的吸附实验表明,该锂离子筛在碱性含锂溶液中对Li+具有吸附性能,且吸附容量随着溶液温度和pH值的升高而增大。当pH=13,温度为60 ℃时,Li+吸附容量最高能达到 40.14 mg·g-1。
(4)通过红外光谱研究了S-2.25吸附Li+的机理,并用Langmuir模型描述了其吸附Li+的行为。
[1]Pauwels H,Brach M,Fouillac C.Colloids Surf.A,1995,100:73-82
[2]Umeno A,Miyai Y,Takagi N,et al.Ind.Eng.Chem.Res.,2002,41:4281-4287
[3]Hunter J C.J.Solid State Chem.,1981,39:142-147
[4]Ooi K,Miyai Y,Sakakihara J.Langmuir,1991,7:1167-1171
[5]Feng Q,Miyai Y,Kanoh H.Langmuir,1992,8:1861-1867
[6]MA Li-Wen(马立文),CHEN Bai-Zhen(陈白珍),SHI Xi-Chang(石西昌),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2010,26(3):413-418
[7]DONG Dian-Quan(董殿权),LIU Wei-Na(刘维娜),LIU Yi-Fan(刘亦凡).Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2009,25(7):1238-1242
[8]Yang X J,Kanoh H,Tang W P,et al.J.Mater.Chem.,2000,10:1903-1909
[9]Chitrakar R,Kanoh H,Miyai Y,et al.Chem.Mater.,2000,12:3151-3157
[10]Thackeray M M.Prog.Solids Chem.,1997,25:l-71
[11]Tang X C,Jiang C K,Pan C Y,et al.J.Solid State Chem.,2006,179:1100-1109
[12]CHEN Yong-Xi(陈永熙),ZHOU Li-Juan(周立娟),GUO Li-Ping(郭丽萍),et al.J.Wuhan University of Technology(Wuhan Ligong Daxue Xuebao),2001,23(10):1-3
[13]Crasa F L,Blochb D,Anne M.Solid State Ionics,1996,89:203-213
[14]Tang W P,Kanoh H,Yang X J.Chem.Mater.,2000,12:3271-3279
[15]LIAO Li-Bing(廖立兵),Li Guo-Wu(李国武).X-ray Diffration Methods and Their Application(X射线衍射方法与应用).Beijing:Geology Press,2008.
[16]Wang L,Meng C G,Ma W.Colloids Surfaces A:Physicochem.Eng.Aspects,2009,334:34-39
[17]Ammundsen B,Aitchison P B,Burns G.R,et al.J.Solid State Ionics,1997,97:269-276
[18]Feng Q,Miyai Y,Kanoh H,et al.Chem.Mater.,1993,5:311-316
[18]Ammundsen B,Jones D J,Roziere J,et al.Chem.Mater.,1995,7:2151-2160
[19]Misak N Z.React.Funct.Polym.,2000,43:153-164
Preparation and Li+Extraction/Adsorption Properties of Lithium-Rich Manganese Oxide in Aqueous Solution
MA Li-Wen CHEN Bai-Zhen SHI Xi-Chang*FENG Da-Wei
(School of Metallurgical Science and Engineering,Central South University,Changsha 410083,China)
Spinel lithium-rich manganese oxides of Li2O·nMnO2(n=1.75,2.0,2.25,2.5,3.0)were synthesized via citric acid complex method.The results of XRD analysis and acid treatment reveal that Li2O·2.25MnO2prepared at 350℃consists of pure spinel phase of lithium manganese oxide and exhibits high Li extraction ratio and low Mn dissolution ratio.After acid treatment Li2O·2.25MnO2is transformed to lithium ion-sieve.XRD and SEM analyses show that lithium ion-sieve can maintain the spinel structure and morphology of lithium manganese oxide.The Li+adsorption experiments show that lithium ion-sieve can adsorb Li+in alkaline solution and the Li+adsorption capacities increase with the increase of temperature and pH value of the solution.The maximum Li+adsorption capacity can reach 40.14 mg·g-1.The Li+adsorption mechanism was suggested based on FTIR spectroscopy results and the Li+adsorption behavior was modeled by Langmuir isotherm.
lithium manganese oxide;lithium ion-sieve;structure;stability;adsorption
O614.111;O614.7+11;O647.3
:A
:1001-4861(2011)04-0697-07
2010-09-25。收修改稿日期:2010-12-09。
国家科技支撑计划“十一五”重大项目(No.2008BAB35B04),2010年湖南省博士科研创新项目(No.CX2010B111)和中央专项中南大学前沿研究计划重点项目(No.2010QZZD003)资助。
*通讯联系人。 E-mail:xichang.shi@gmail.com

