携带人类GAD67基因真核表达载体的构建及转染骨髓基质细胞*
谢三平,陈吉相,李慧,徐婧,黄园园
1.华中科技大学同济医学院附属协和医院神经内科,武汉 430022;2.荆州市中心医院神经内科,湖北荆州 434020
携带人类GAD67基因真核表达载体的构建及转染骨髓基质细胞*
谢三平1,2,陈吉相1#,李慧1,徐婧1,黄园园1
1.华中科技大学同济医学院附属协和医院神经内科,武汉 430022;2.荆州市中心医院神经内科,湖北荆州 434020
目的:构建携带人类谷氨酸脱羧酶67(GAD67)基因的真核表达载体pDC316-CMVEGFP-GAD67,并转染大鼠骨髓基质细胞(BMSCs)。方法:利用基因重组技术,构建 pDC316-CMV-EGFP-GAD67真核表达载体;利用脂质体将其转染通过贴壁方法分离培养出来的BMSCs,荧光显微镜下观察并经流式细胞仪检测其转染效率,免疫组化检测GAD67蛋白在BMSCs中的表达。结果:成功构建pDC316-CMV-EGFP-GAD67真核表达载体,转染BMSCs后荧光显微镜下观察可见绿色荧光细胞,流式细胞仪检测转染后48 h的转染效率为37.3%,免疫组化检测转染后48 h,BMSCs内GAD67蛋白呈阳性表达。结论:构建pDC316-CMV-EGFP-GAD67真核表达载体并成功转染BMSCs。
谷氨酸脱羧酶67;真核表达载体;转染;骨髓基质细胞
#【通讯作者】陈吉相,Tel:86-27-85726203,E-mail:cz283895@yahoo.cn
研究显示,癫痫的发生与神经元退行性变性引起的脑内兴奋性递质与抑制性递质系统功能失衡有密切联系。谷氨酸(glutam inic acid,GLU)和γ-氨基丁酸(gamma-am inobutyric acid,GABA)是调节脑内兴奋性与抑制性平衡最重要的2种递质,谷氨酸脱羧酶(g lu tamic acid decarboxylase,GAD)催化GLU脱羧反应生成GABA。GAD有GAD65和GAD67两种亚型,其中GAD67在调节GABA的生成和释放中起主要作用[1]。利用携带及表达GAD67基因的神经干细胞脑内移植治疗癫痫可能具有重要价值[2]。骨髓基质细胞(bonemarrow stromal cells,BMSCs)是骨髓内造血干细胞以外的非造血干细胞,属于多能干细胞[3],在特定条件下,可以分化为成骨细胞、脂肪细胞、骨骼肌细胞、肝细胞、心肌细胞等[4-8],还能分化为神经前体细胞[9,13],具有神经细胞分化潜能,被作为种子细胞广泛应用于神经系统疾病的治疗研究中。本研究利用基因重组技术,通过酶切、连接重组方法构建携带人类GAD67基因片段的真核表达载体 pDC316-CMV-EGFPGAD67后,借助转基因技术,利用脂质体介导将其转染入BMSCs,观察其转染效果及转染后目的基因的表达,为进一步研究基因修饰后的BMSCs移植治疗癫痫提供前提条件。
1 材料与方法
1.1 材料 ①动物:雌性SD大鼠,体质量为(150±15)g,由华中科技大学同济医学院实验动物中心提供。②主要试剂与材料:NotI、SpeI及 T4连接酶(购于 NEB公司);Easy Taq DNA聚合酶、dNTPs(购于北京全式金生物技术有限公司);小牛肠碱性磷酸酶(calf intestinal alkaline phosphatase,CIAP)(购于 Prom ega公司);PCR引物、LipofectamineTM2000(购于 Invitrogen公司);DNA凝胶回收与纯化试剂盒(购于北京博迈德科技发展有限公司);无内毒素高纯质粒小量快速提取试剂盒(购于北京百泰克生物技术有限公司);DNA Marker(购于诺维森生物科技有限公司);DMEM/F12培养基(购于Hyclone公司);胎牛血清(购于杭州四季青生物工程有限公司);胰蛋白酶(购于Ameresco公司);G418(购于Calbiochem公司);兔抗人GAD67多克隆抗体、生物素标记的羊抗兔IgG抗体、SP免疫组化试剂盒、DAB底物显色试剂盒(购于武汉博士德生物工程有限公司)。③质粒和菌株:感受态DH 5α(购于北京全式金生物技术有限公司);真核表达载体 pDC316-cm v-EGFP和 pCM V6-XL5-GAD67质粒[毅新兴业(北京)科技有限公司提供]。
1.2 方法
1.2.1 真核表达载体pDC316-CMV-EGFPGAD67的构建及鉴定 由毅新兴业(北京)科技有限公司完成。
1.2.2 BMSCs的分离、培养 取SD大鼠1只,10%水合氯醛0.3m L/100g体质量腹腔注射麻醉,75%的乙醇浸泡5min,无菌条件下分离双侧股骨、胫骨,沿骨骺线剪去两端,无菌注射器抽取6 m L培养液(含20%胎牛血清的DM EM/F12)冲出骨髓液,反复吹打制成细胞悬液,200 mm滤网过滤,收集细胞悬液,4℃离心6min,去掉上清,加入新培养液吹打成单细胞悬液后接种于50 m L培养瓶中,放入 37℃、5%CO2培养箱中培养。3 d后首次换液,去掉未贴壁细胞,继续培养;4 d后再次换液。第9天时细胞生长融合达90%左右,用0.25%的胰蛋白酶室温下消化约60 s,镜下观察贴壁细胞突起收缩,细胞变圆开始漂浮时倒掉消化液,加入含血清的培养液终止消化,吸管吹打并混匀成单细胞悬液,分装入2个50 m L培养瓶中继续培养,以后传代1次/周,中途换液1次。
1.2.3 pDC316-CMV-EGFP-GAD67载体转染BMSCs 取第3代BMSCs,按1×106个/孔接种于24孔板中,第2天镜下观察细胞融合度达85%左右即进行转染,转染参照LipfectamineTM2000说明书进行,每孔加质粒DNA 1 μg,Lip fectamineTM2000 2 μL,无血清培养基室温下孵育后转染,6 h后更换含血清的完全培养基继续培养。同时设空白对照组(仅加等量质粒DNA),空质粒转染组(仅加等量 LipfectamineTM2000)、完全空白组。并于转染24 h后加入G418(400μg/m L)加压筛选。
1.2.4 pDC316-CMV-EGFP-GAD67载体转染BMSCs检测 分别于转染后24、48及72 h在荧光显微镜下观察绿色荧光蛋白在BMSCs中的表达;转染后48 h,选取5张片子,每张片子随机取10个高倍视野,每个视野计数100个细胞,阳性细胞百分比=阳性细胞数/(阳性细胞数 +阴性细胞数)×100%;并于48 h后消化转染的BMSCs,滴管吹打成单细胞悬液,取1.5 m L的细胞悬液流式细胞仪检测转染率。
1.2.5 转染后GAD67蛋白在BMSCs中的表达 转染48 h后消化BMSCs,吹打成单细胞悬液,接种于盖玻片上培养,次日细胞贴壁后弃去培养基,PBS溶液冲洗2遍,4%多聚甲醛固定20min后弃掉固定液,PBS溶液洗2遍;加入一抗(兔抗人GAD67多克隆抗体,1∶100稀释),4℃湿盒过夜,再37℃孵育1 h,PBS冲洗,5min/次,共3次;加二抗(生物素标记的羊抗兔IgG,1∶100稀释),37℃湿盒孵育1 h,PBS冲洗,5min/次,共3次;按SP免疫组化试剂盒说明进行,DAB显色。同时设空白对照和未加一抗的阴性对照。普通光镜下观察并拍照。
2 结果
2.1 pDC316-CM V-EGFP-GAD67的构建及鉴定 构建 pDC316-CMV-EGFP-GAD67真核表达载体后通过PCR引物鉴定正反,并电泳检测,见图1A;挑选出阳性克隆行双酶切验证,可切出双条带,见图1B;对经过酶切结果呈阳性的质粒进行测序,分别对其5'-端进行正向测序和3'-端进行反向测序,将测序结果与NCBI上的NM_000817分别进行比对,结果显示插入pDC316-CM V-EGFP-GAD67真核表达载体中的GAD1cDNA序列正确,全长3.5 kbp。
2.2 BMSCs的体外培养及观察 倒置显微镜下观察,初种细胞呈圆形,散在悬浮于培养液中;72 h后首次换液时,显微镜下观察可见部分细胞贴壁生长,呈圆形、梭形或不规则形,见图2A;传代后的细胞生长形态较均一,折光性强,呈纺锤状,长突起延伸于两端,漩涡状、网状、辐射状排列,见图2B。
2.3 转染结果及转染效率 转染24 h后荧光显微镜下观察,PDC316-CMV-EGFP空质粒转染孔及 pDC316-CMV-EGFP-GAD67转染孔均可见绿色荧光,见图2C、2D;72 h时发绿色荧光细胞增加,荧光亮度增强,见图2E;空白对照孔中无绿色荧光,见图2F;转染后48 h,GAD67阳性细胞百分比为(15.6±4.15)%;48 h后流式细胞仪检测pDC316-CM V-EGFP-GAD67转染BMSCs效率为37.3%,见图2G。
2.4 转染后BMSCs中GAD67蛋白的表达
免疫组织化学检测显示,转染48 h后的BMSCs内GAD67蛋白呈阳性表达,见图2H,空质粒转染组及空白对照组均未见阳性表达,见图 2I、2J。
3 讨论
目前认为癫痫发病的最终环节与脑内兴奋性及抑制性递质功能失衡有关。GAD是调节GLU与GABA生成平衡的关键酶,GAD功能下调将会导致GABA递质功能相对或绝对不足,造成兴奋性与抑制性神经功能的失调[10,11]。GAD功能下调可能与GABA能为主的抑制性中间神经元(GAD阳性神经元)的减少有关[12]。增强癫痫患者致痫灶中的GABA能细胞的作用或移植GABA能神经元到癫痫患者致痫灶中以补充其不足,可能对癫痫、尤其对难治性癫痫起到意想不到的治疗效果。
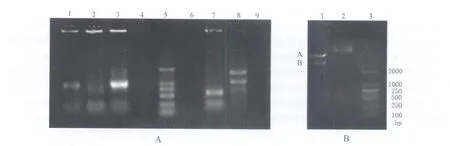
图1 A-B A:菌落PCR结果,1、3孔道内的克隆为阳性克隆,5孔道为DNA Marker(上至下依次为2000,1000,750,500,250,100 bp);B:酶切鉴定结果,1孔道为酶切产物,其中A为pDC316-CMV-EGFP质粒,B为GAD67片段,2孔道为酶切前的质粒,3孔道为DNA Marker
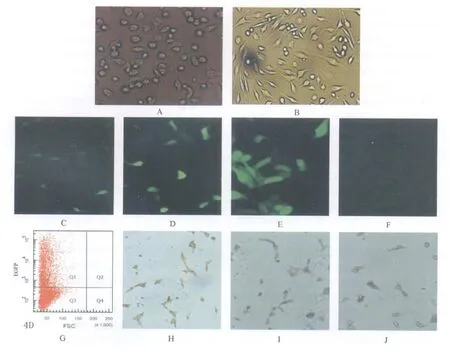
图2 A-J 原代培养72 h(A)及传代后(B)的 BMSCs形态(倒置显微镜,×200);空质粒转染(C)、转染后24 h(D)、72 h(E)、未转染(F)BMSCs荧光显微镜下细胞形态(荧光显微镜,×200)及流式细胞仪检测结果(G);转染48 h后(H)、空质粒转染(I)及空白对照组(J)的BMSCs内GAD67蛋白免疫组化染色结果(光学显微镜,×100)
BMSCs是广泛应用于神经科学领域研究中非胚源性多能干细胞,Wislet-Gendebien等[9]将BMSCs与小脑颗粒细胞共同培养后发现成体BMSCs能表达神经元特异抗原,并具备神经细胞样功能,可与GABA、甘氨酸、GLU等神经递质发生反应,产生单程动作电位。Tseng等[13]研究发现,BMSCs在体外经生长因子和化学处理后,可向神经样细胞分化,表达神经元特异标记如神经丝蛋白、β-微管蛋白Ⅲ、Tau蛋白,少量神经样细胞可分泌GABA。诸多体外研究都发现BMSCs可能具有功能性神经细胞分化潜能[9,13],且可来源于自体、取材方便、并可避免免疫排斥反应等,是理想的种子细胞[14]。体内研究也证实 BMSCs在神经系统疾病中的应用价值。Shen等[15]将BMSCs移植治疗大脑中动脉闭塞脑动物模型,发现细胞移植治疗2周后脑缺血动物的神经缺失症状开始得到改善,且疗效至少可持续1年;原位杂交反应显示,移植后的细胞可在宿主脑内存活并部分[(22.3±1.95)%]表达星形胶质细胞特异性胶质纤维酸性蛋白(glia fibrillary acidic p rotein,GFAP),部分[(16.8±2.13)%]表达神经元特异性微管相关蛋白-2(microtubu le associated p rotein-2,MAP-2),增加缺血组织周围突触囊泡蛋白表达,明显减轻突触缺失。BMSCs作为基因治疗的载体细胞应用于神经系统疾病的研究也曾有报道,Lu等[16]利用腺相关病毒载体将多巴胺生成限速酶-酪氨酸羟化酶(ty rosine hydroxylase,TH)基因导入BMSCs,然后将表达 TH基因的 BMSCs移植到帕金森病模型鼠的纹状体内后观察发现,治疗组阿扑吗啡诱导的不对称旋转症状较对照组明显减轻,6周后免疫组化检测发现TH基因主要在移植点周围表达,高效液相色谱仪及电化学检测证实TH基因修饰的BMSCs纹状体内移植可明显增加移植点周围多巴胺递质水平。
目前有关GAD67基因修饰的BMSCs致痫灶内定向移植治疗癫痫的研究还未曾见报道。本实验研究证实,利用基因重组技术构建的带有绿色荧光标记的GAD67基因真核表达载体pDC316-CM V-EGFP-GAD67可通过脂质体有效转入BMSCs中,并在转染后的BMSCs中呈阳性表达,提示外源GAD67基因可在 BMSCs中有效表达,为下一步GAD67基因修饰的BMSCs致痫灶内定向移植治疗癫痫的研究奠定了实验基础。但在本研究中还发现存在转染效率不高(37.3%),转染后GAD67基因在BMSCs中的表达不够理想,GAD67阳性细胞仅为(15.6±4.15)%,长时间加压筛选培养后外源基因在BMSCs中的表达有衰减趋势,转染后的细胞增殖能力下降等一系列问题,而且转染后GAD67基因能否在转染细胞中表达功能性GAD67蛋白,有效增加细胞内外抑制性神经递质GABA浓度,还有待后期进一步探究。
[1]Chattopadhyaya B,Di Cristo G,Wu CZ,et al.GAD67-mediated GABA synthesis and signaling regulate inhibitory synaptic innervation in the visual cortex[J].Neuron,2007,54(6):889-903.
[2]Thom pson KW,Suchom elova LM.Transplants of cells engineered to produce GABA suppress spontaneous seizures[J].Epilepsia,2004,45(1):4-12.
[3]PittengerMF,M ackay AM,Beck SC,et al.M ultilineage potential of adult human mesenchyma1 stem cells[J].Science,1999,284(5411):143-147.
[4]Deliloglu-Gurhan SI,Vatansever HS,Ozdal-Kurt F,et al.Characterization of osteoblasts derived from bonemarrow stromal cells in a modified cell cu lture system[J].Acta H istochem,2006,108(1):49-57.
[5]Rydén M,Dicker A,Götherström C,et al.Functional characterization of hum an mesenchymal stem cell-derived adipocytes[J].Biochem Biophys Res Commun,2003,311(2):391-397.
[6]Dezawa M,Ishikawa H,Itokazu Y,et al.Bone Marrow stromal cells generate muscle cells and repairm uscle degeneration[J].Science,2005,309(5732):314-317.
[7]Chen Y,Dong XJ,Zhang GR,etal.In vitro differentiation of mouse bone marrow stromal stem cells into hepatocytes induced by conditioned cu lture medium of hepatocy tes[J].JCell Biochem,2007,102(1):52-63.
[8]Li H,Yu B,Zhang Y,et a1.Jagged1 p rotein enhances the differentiation of mesen-chymal stem cells into cardioMyocytes[J].Biochem Biophys Res Commun,2006,341(2):320-325.
[9]W islet-Gendebien S,HansG,Leprince P,et al.Plasticity of cultured m esenchymal stem cells:sWitch from nestin-ostive to excitable neuron-1ike phenotype[J].Stem Cells,2005,23(3):392-402.
[10]Ellenberger C,Mevissen M,Doherr M,et al.Inhibitory and excitatory neurotransmitters in the cerebrospinal fluid of epileptic dogs[J].Am JVet Res,2004,65(8):1109-1113.
[11]Sperk G,Furtinger S,Schwarzer C,et al.GABA and its recep tors in epilepsy[J].Adv Exp M ed Biol,2004,548:92-103.
[12]Jessberger S,Römer B,Babu H,et al.Seizures induce p roliferation and dispersion of doublecortin-positive hippocampal progenitor cells[J].Exp Neurol,2005,196(2):342-351.
[13]Tseng PY,Chen CJ,Sheu CC,et al.Spontaneous differentiation of adult rat Marrow stromal stem cells in a long-term culture[J].JVet Med Sci,2007,69(2):95-102.
[14]Dezawa M,Hoshino M,Ide C.Treatment of neurodegenerative diseases using adult bone marrow stromal cell-derived neurons[J].Expert Opin Biol Ther,2005,5(4):427-435.
[15]Shen LH,LiY,Chen J,etal.One-year follow-up after bonemarrow stromal cell treatment in middle-aged female rats with stroke[J].Stroke,2007,38(7):2150-2156.
[16]Lu L,Zhao C,Liu Y,etal.Therapeutic benefit of TH-engineered mesenchym al stem cells for Parkinson's disease[J].Brain Res Brain Res Protoc,2005,15(1):46-51.
To Construct Eukaryotic Expression Vector with GAD67 Gene and Transfect It into Bone Marrow
Strom al Cells
XIE San-ping▲,CHEN Ji-xiang,L I H ui,XU Jing,HUANG Yuan-yuan.▲Departmentof Neurology,Union Hospital,Tongji Med ical College,Huazhong University of Science and Technology,Wuhan 430022,China
Ob jective:To constructhuman g lutamic acid decarboxy lase(GAD67)gene's recombinant eukaryotic expression vector pDC316-CMV-EGFP-GAD67 and to transfect it into bone marrow strom al cells(BMSCs)of rats.Methods:Eukaryotic exp ression vector pDC316-CMVEGFP-GAD67 was constructed with the technique of gene rearrangement.BMSCs of rats were cultivated by their adherence-dependent growth character,and the recombinant pDC316-CMVEGFP-GAD67 was transferred into the BSMCswith lipofectam ineTM2000.The cellswere observed by fluorescencemicroscopy,the efficiency of transfection was assessed by flow cytometry,and the expression of GAD67 protein in BMSCs w as detected by immunohistochemistry after transfecting.Results:The pDC316-CMV-EGFP-GAD67was constructed successfu lly.Green fluorocy tes were detected under fluorescence microscopy after transfection and the efficiency of transfection w as 37.3%at 48 hours post transfection.GAD67p rotein exp ressed in tansfected BM SCs at 48 hours post transfection.Conclusion:The eukaryotic expression vector pDC316-CMV-EGFPGAD67 was successfully constructed and effectively transfected into BMSCs.
g lutamic acid decarboxy lase67;eukaryotic exp ression vector;transfection;boneMarrow stromal cells
Q782;R742.2
A
1001-117X(2011)04-0235-06
10.3870/sjsscj.2011.04.001
湖北省科技攻关计划项目(No.GGS0064)
2011-06-09

