制麦过程中添加肌醇六磷酸酯酶对麦芽的影响
戚 月 秀, 王 小 万, 张 铭 振, 聂 妤, 赵 长 新
( 大连工业大学 生物工程学院, 辽宁 大连 116034 )
0 引 言
肌醇六磷酸酯亦称植酸,是大麦中磷元素的主要储藏形式,大约有70%的磷储藏在植酸中[1]。大麦中植酸以植酸盐螯合物形式存在,植酸在大麦干种子中含量约为1%[2]。作为衡量麦芽质量的重要参数麦芽浸出率,与植酸含量成高度负相关,高含量的植酸不利于麦芽制造[3]。
大麦中的植酸酶分解植酸盐得到的磷离子、蛋白、肌醇等制约着细胞的合成、大麦内部pH、能量供应等,这些因素会进一步影响大麦发芽过程中的其他酶活力,从而影响麦芽的品质[4]。但由于植酸酶在大麦中酶活力较低,不能充分分解植酸,使大麦中累积过多植酸,影响大麦水解酶的活力,制约麦芽浸出率,进而影响麦芽的质量。本研究目的在于在制麦过程中外源添加植酸酶,以期降低植酸含量,提高水解酶活力最终提高麦芽的浸出率。
1 材料与方法
1.1 实验材料
包衣型植酸酶,沈阳华星生物;大麦,Baudin,中粮麦芽大连股份有限公司。
1.2 实验方法
1.2.1 添加植酸酶的浸麦方法
取200 g大麦清洗3次放进烧杯,与水以1∶3的比例混合。采用浸5、断10.5、浸5.5、断3,16 ℃发芽96 h的浸麦发芽工艺。在第一次湿浸阶段添加0.83 U/g的包衣型植酸酶,调溶液pH至中性,称为样品。以同样浸麦工艺制麦,不添加植酸酶的正常大麦为对照样。
1.2.2 植酸含量的测定
称取粉碎大麦2 g,加入20 mL 1.2%HCl-10%Na2SO4溶液于室温下搅拌浸提2 h,4 000 r/min离心30 min,取上清液于4 ℃冰箱备用。取植酸浸提液2 mL,加入15%TCA(三氯乙酸)2 mL,于10 mL硬质玻璃管中混匀,于4 ℃冰箱中静置2 h后,4 000 r/min离心30 min。吸取上清液2 mL,用0.75 mol/L NaOH调节pH至6.0~6.5。取稀释液2 mL加1 mL 0.5%磺基水杨酸混匀后于500 nm处比色,测OD值。
1.2.3 酶液制备
称取200 g大麦,放入250 mL烧杯中,用水冲洗3遍,然后加水,置于培养箱内,温度设置在16 ℃,采用浸水4 h后断水8 h的工艺培养24 h后,称取10 g湿麦芽,用去离子水反复冲洗5遍,置入研钵内捣碎,将捣碎的麦芽放入糖化杯内,加去离子水90 mL,0.2 mol/L的醋酸-醋酸钠缓冲液10 mL,于40 ℃水浴保温搅拌1 h过滤,最初的20 mL滤液弃掉。最后得到的滤液用来测定植酸酶活性。另取10 g湿麦芽捣碎后烘干,计算麦芽水分。在此过程中,所有容器均用去离子水冲洗3遍。
1.2.4 水解酶活力的测定
α-淀粉酶活力测定、蛋白酶活力测定见参考文献[4],植酸酶活力测定见参考文献[1],β-葡聚糖酶活力测定见参考文献[5]。
1.2.5 麦汁得率测定
测定方法见参考文献[2]。
2 结果与讨论
2.1 大麦发芽过程中植酸质量浓度的变化
由图1可见,0~24 h,由于植酸酶被激活,植酸质量浓度迅速降低;24~48 h,由于植酸分解释放出大量磷离子,植酸酶活力下降,使植酸质量浓度降低减慢;48~72 h,磷离子参与细胞合成等被大量消耗,使植酸酶再次大量分解植酸,使植酸质量浓度又大幅下降;72~96 h,植酸酶活力降低,大麦中剩余植酸较少,所以植酸质量浓度有微小降低。由于外源添加的植酸酶在浸麦期间随水溶液从珠孔进入大麦中,开始大量分解糊粉层中的植酸,所以整体上样品比对照样的植酸质量浓度低。
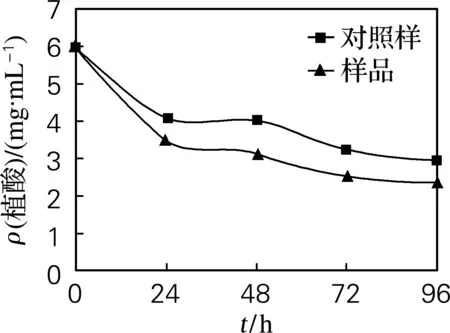
图1 植酸质量浓度的变化
2.2 外源植酸酶对大麦中水解酶活力的影响
2.2.1 对植酸酶活力的影响
由图2可见,样品比对照样的植酸酶活力高,原因是外源添加的植酸酶在浸麦期间随水溶液从珠孔进入大麦中,开始大量分解糊粉层中的植酸,释放出金属离子等,导致赤霉酸等植物生长激素大量生成,进而促使大麦内源植酸酶迅速激活。其中释放出的磷离子又迅速参与细胞以及各种ATP的合成,酶原的激活,因此磷离子消耗较大,促使植酸酶大量合成进而分解更多植酸,在24 h处达到峰值2.66 U/g;24~48 h,植酸浓度降低缓慢,大麦内部累积较大浓度的磷离子,植酸酶活力又在48 h降到最低。当磷离子再次消耗时,植酸酶活力再次增加,并在72 h处再次达到峰值2.34 U/g。而对照样本身植酸酶活力较低,不足以分解大麦中植酸,所以其中植酸质量浓度较高。分析原因可能是外源植酸酶大量分解大麦中植酸,促进赤霉素等生长激素的合成,进而促进内源植酸酶活力的提高。

图2 植酸酶活力的变化
2.2.2 对α-淀粉酶活力的影响
由图3可见,由于样品中植酸酶活力较大,分解植酸释放出Ca、Mg等金属离子以及无机磷酸。在大麦的发芽初期,大麦的胚产生了大量赤霉素,赤霉素刺激大麦中的糊粉层,提高了α-淀粉酶合成量。而添加外源植酸酶分解植酸产生的无机磷离子为合成大量的mRMA提供了足够的原料,从而使α-淀粉酶合成量增加,活力增大。样品中α-淀粉酶活力最大值比对照样提高了25.78%。

图3 α-淀粉酶活力变化
2.2.3 对蛋白酶活力的影响
由图2可知,植酸酶在72 h活力较大,此时分解植酸释放出大量金属离子,其中Mg离子对蛋白酶的激活有一定地促进作用,由图4可知,样品中蛋白酶活力在96 h达到最大值1 028 U/g,比对照样中蛋白酶活力提高了42.77%。
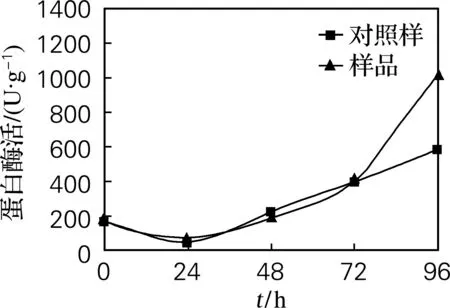
图4 蛋白酶活力变化
2.2.4 对β-葡聚糖酶活力的影响
由图5可见,样品的β-葡聚糖酶活力比对照样高,说明外源添加植酸酶促进糊粉层产生赤霉素,在此作用下,分泌出溶解细胞壁的半纤维素酶(β-葡聚糖酶)。开始发芽时,β-葡聚糖酶分解细胞壁,糊粉层中合成的各种水解酶进入淀粉层,即打开了酶的作用通道,因此在24 h酶活力达到最大值。之后β-葡聚糖酶活力下降,在48 h有最小值;当可溶性的分解产物迅速地向正在生长的胚中轴转移时,又需要β-葡聚糖酶大量合成再次分解细胞壁,因此在72 h处酶活力又达到峰值。
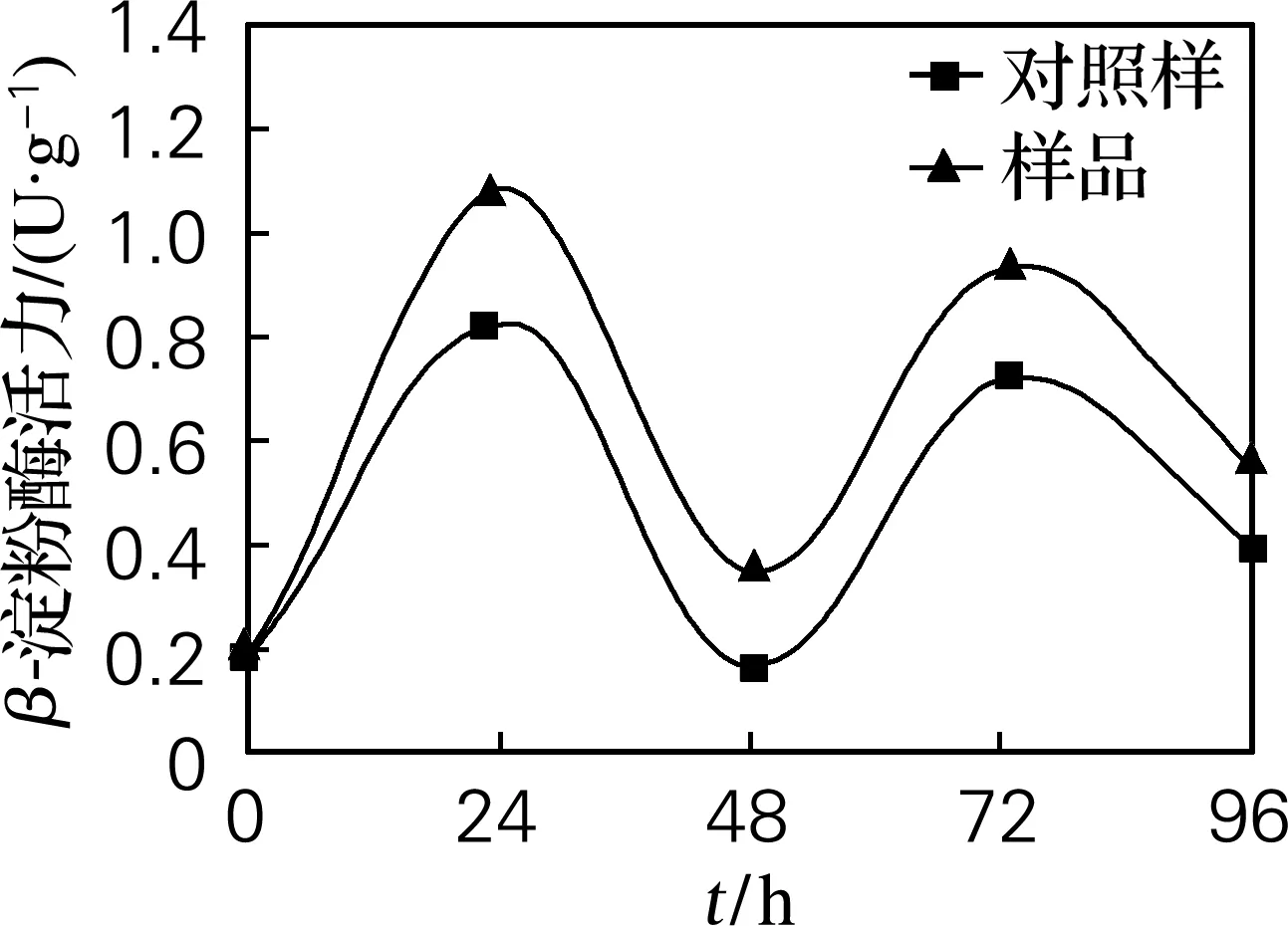
图5 β-葡聚糖酶活力变化
2.3 外源植酸酶对麦汁浸出率的影响
添加植酸酶浸麦的麦汁得率达到81.00%,而正常麦芽的麦汁得率为80.15%,说明浸麦中添加植酸酶可以使麦汁浸出率提高近1%。大麦内源植酸酶活力较低,使植酸包裹的部分淀粉、蛋白、金属复合物等不能完全分解,是造成目前麦汁浸出率较低的部分因素。由实验分析可知,外源添加植酸酶可以加速大麦的发芽,提高麦汁的浸出率。
3 结 论
大麦中植酸浓度是影响大麦水解酶活力和麦芽浸出率的主要因素之一。原大麦中植酸酶活力较低,大麦自然发芽过程中植酸酶活力虽有一定提高,但由于植酸含量较高,内源植酸酶不能完全分解植酸,使植酸结合的淀粉、蛋白质等溶解降低,影响水解酶的催化及麦汁得率。结果表明,在制麦过程中第一次湿浸阶段添加外源包衣型植酸酶分解植酸盐螯合物,降低了大麦中植酸浓度,提高了大麦发芽过程中α-淀粉酶、植酸酶、蛋白酶、β-葡聚糖酶的活力,并使结合的淀粉及蛋白质溶解,麦汁浸出率提高了近1%。
[1] 郭建华,赵长新,董亮,等. 植酸酶和无机磷的相关性以及与大麦发芽之间关系的初步研究[J]. 作物杂志, 2006(1):70-72.
[2] LIU Zhenghui, CHENG Fangmin, ZHANG Guoping. Grain phytic acid content in japonica rice as affected by cultivar and environment and its relation to protein content[J]. Food Chemistry, 2005, 89(1):49-52.
[3] DAI Fei, WANG Junmei, ZHANG Saihua, et al. Genotypic and environmental variation in phytic acid content and its relation to protein content and malt quality in barley[J]. Food Chemistry, 2007, 105:606-611.
[4] 郭建华,赵长新,孙丽华,等. 大麦萌发时植酸酶酶学特性及形成机理的初步研究[J]. 河南工业大学学报, 2006, 27(1):15-17.
[5] 李旺军,李胤. 制麦对大麦中β-葡聚糖酶和植酸酶活力的影响[J]. 酿酒科技, 2005(3):50-56.

