核盘菌和草酸诱导下的油菜几种酶活力的变化分析
毛 玮 , 侯 英 敏, 刘 志 文
( 大连工业大学 生物工程学院, 辽宁 大连 116034 )
0 引 言
油菜菌核病(Sclerotiniasclerotiorum)是由子囊菌亚门柔膜菌目核盘菌引起的一种真菌性病害,在油菜各个生育期和各部位均能为害,尤其以茎部受害最重。菌核病已成为一种世界性的病害,严重地影响了世界各国的油菜生产,在我国各油菜产区,特别是长江中下游产区,表现得尤为突出[1]。
关于油菜菌核病菌致病的生化机理,有研究表明核盘菌分泌的草酸毒素和纤维素酶等多种胞壁降解酶起着重要作用[2],可以共同作用破坏植物细胞壁细胞。也有报道,草酸可诱导油菜体内PPO、POD活性的变化,这些酶活性的变化与油菜的抗病机制有密切的关系[3]。此外,几丁质酶在植物抗性中的作用也引起了学者们的注意[4]。
本实验采用草酸与核盘菌分别处理离体的油菜叶片,系统分析油菜叶片中PPO、POD、纤维素酶与几丁质酶活力的变化,探讨这些酶与油菜菌核病致病机理及抗病机制的关系,为进一步防治菌核病奠定基础。
1 材料与方法
1.1 材 料
核盘菌(Sclerotiniasclerotiorum)由华中农业大学油菜研究室提供;甘蓝型油菜华协一号由甘肃省种子推广总站提供,种植于温室的营养钵中。
1.2 方 法
1.2.1 采样与接种
将核盘菌菌核移入PDA平板培养基上,在26 ℃下进行活化培养,待琼脂平板上长满菌丝后用打孔器打成直径为0.5 cm的菌丝琼脂块,供接种用。
选6叶期生长健壮的油菜叶片进行离体处理,第1组为接入菌丝琼脂块,将离体叶片叶柄基部浸入盛有清水的平皿中,并用保湿棉保湿,用无菌镊子夹菌丝琼脂块,放在叶片中部,将有菌丝的一面紧贴叶片正面;第2组为草酸溶液浸叶,将离体叶片叶柄基部浸入3 mmol/L草酸溶液中,保湿;第3组为清水对照组,将离体叶片浸入清水并保湿;各组处理设3次重复,分别测定各次重复的酶活力。
1.2.2 酶活力的测定
1.2.2.1 POD和PPO活性的测定
称取鲜重0.1 g的叶片,于10 mL 0.1 mol/L pH 6.5的 PBS 冰浴中研磨,8 000 r/min离心10 min,上清即为粗酶液。
POD活性测定参照张笑宇[5]的方法:分别加入1 mL 0.1 mol/L pH 6.0 的PBS、2 mL 3% H2O2、1 mL 0.2 mol/L的愈创木酚溶液、1 mL粗酶液,于室温反应4 min后,在波长470 nm下测OD值。定义OD470每分钟变化0.1所需的酶量为一个酶活力单位。
PPO活性测定也参照张笑宇[5]的方法:分别加入4 mL 0.2 mol/L 邻苯二酚溶液、1 mL 粗酶液,40 ℃水浴10 min后在波长400 nm下测OD值。定义OD400每分钟变化0.1所需的酶量为一个酶活力单位。
1.2.2.2 纤维素酶活性的测定
称取鲜重0.2 g的叶片,用2 mL 0.1 mol/L pH 4.6 的HAc-NaAc溶解制成粗酶液。纤维素酶活性测定采用DNS法[6]。加入0.1 mL 1% CMC底物、0.4 mL PBS、1 mL粗酶液,50 ℃下水浴30 min。加入2 mL DNS,煮沸5 min。在520 nm下测OD值。定义每小时生成1 mg还原糖为一个酶活力单位。
1.2.2.3 几丁质酶活性的测定
称取鲜重0.2 g的叶片,用2 mL 0.1 mol/L pH 5.0 HAc-NaAc制成粗酶液。按Boller等[7]的方法测定几丁质酶活力。加入0.1 mL几丁质溶液、0.4 mL PBS、1 mL粗酶液,35 ℃下水浴1 h。加入2 mL DNS,煮沸5 min。在520 nm下测OD 值。定义每小时生成1 mg还原糖为一个酶活力单位。
2 结果与分析
2.1 叶片的选择
不同生育期的油菜其酶活力差异较大,选择生育期为6叶期与20叶期油菜进行PPO与POD活力测定。在预实验中,将菌丝块分别接种于生育期为6叶期与20叶期油菜的同一部位叶片,结果表明核盘菌侵染6叶期叶片的速度较快且病斑面积较大。
由表1可以看出,20叶期油菜的PPO活力较6叶期高,此外6叶期与20叶期油菜都含有大量的POD,且20叶期的POD活力明显高于6叶期,这是因为过氧化物酶能使组织中所含的某些碳水化合物转化成木质素,增加木质化程度[8]。因此综合以上结果考虑选用6叶期油菜的叶片为实验材料。
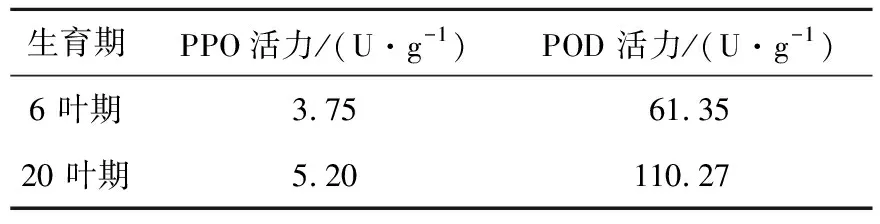
表1 不同生长期PPO、POD活力
2.2 草酸浓度的选择
选择同一时期播种的6 叶期油菜的叶片,将离体叶片叶柄分别浸入到盛有3、6、9 mmol/L草酸溶液的平皿中,并以清水为对照。72 h后分别测PPO与POD活力,结果如图1所示。由图1可以看出,PPO、POD活力随着草酸浓度增加而增大,但在6和9 mmol/L浸叶过程中草酸对叶片的损伤很大,干枯现象严重,影响了酶活力的测定和分析,故选用草酸浓度为3 mmol/L。
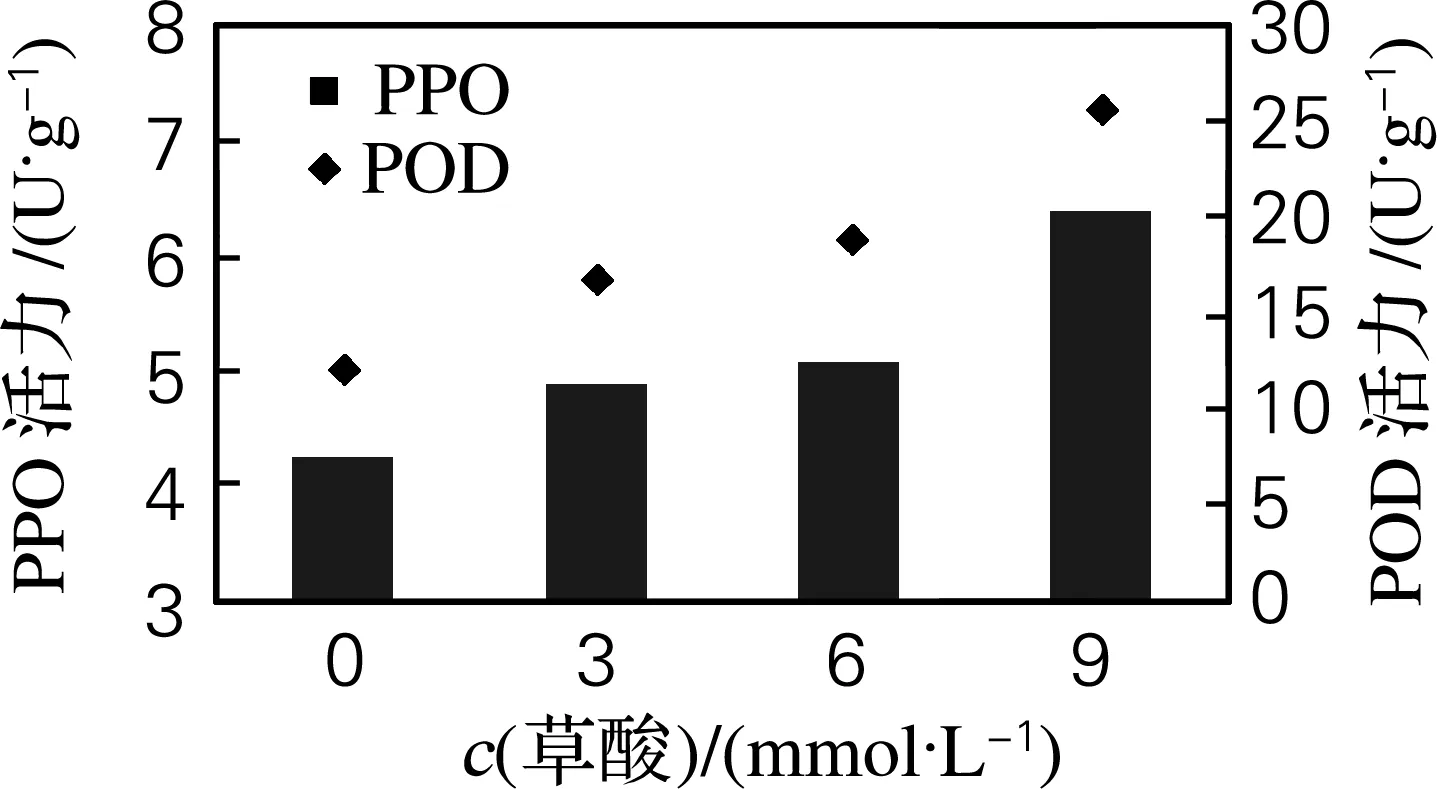
图1 不同草酸浓度浸染后PPO、POD的变化
Fig.1 The activity of PPO and POD induced by different oxalic concentration
2.3 PPO和POD活力的变化
如图2、3所示,经草酸和核盘菌处理后,PPO和POD活力均有明显变化。从图2可以看出,在核盘菌诱导48 h内,PPO活力较对照略有升高,但效果不明显;诱导48 h后PPO活力开始升高,且都高于对照组。PPO活力在核盘菌诱导72 h后达到峰值,为43.4 U/g,较对照提高了42.76%,72 h后逐渐开始下降;草酸诱导96 h后PPO活力最高,为36.7 U/g。从图3可以看出,POD的活性随诱导时间的延长呈先升高后降低的趋势,经过核盘菌和草酸诱导12 h后达到最大,分别为37.5和35.1 U/g;在48 h后开始逐渐下降,96 h接近对照组。
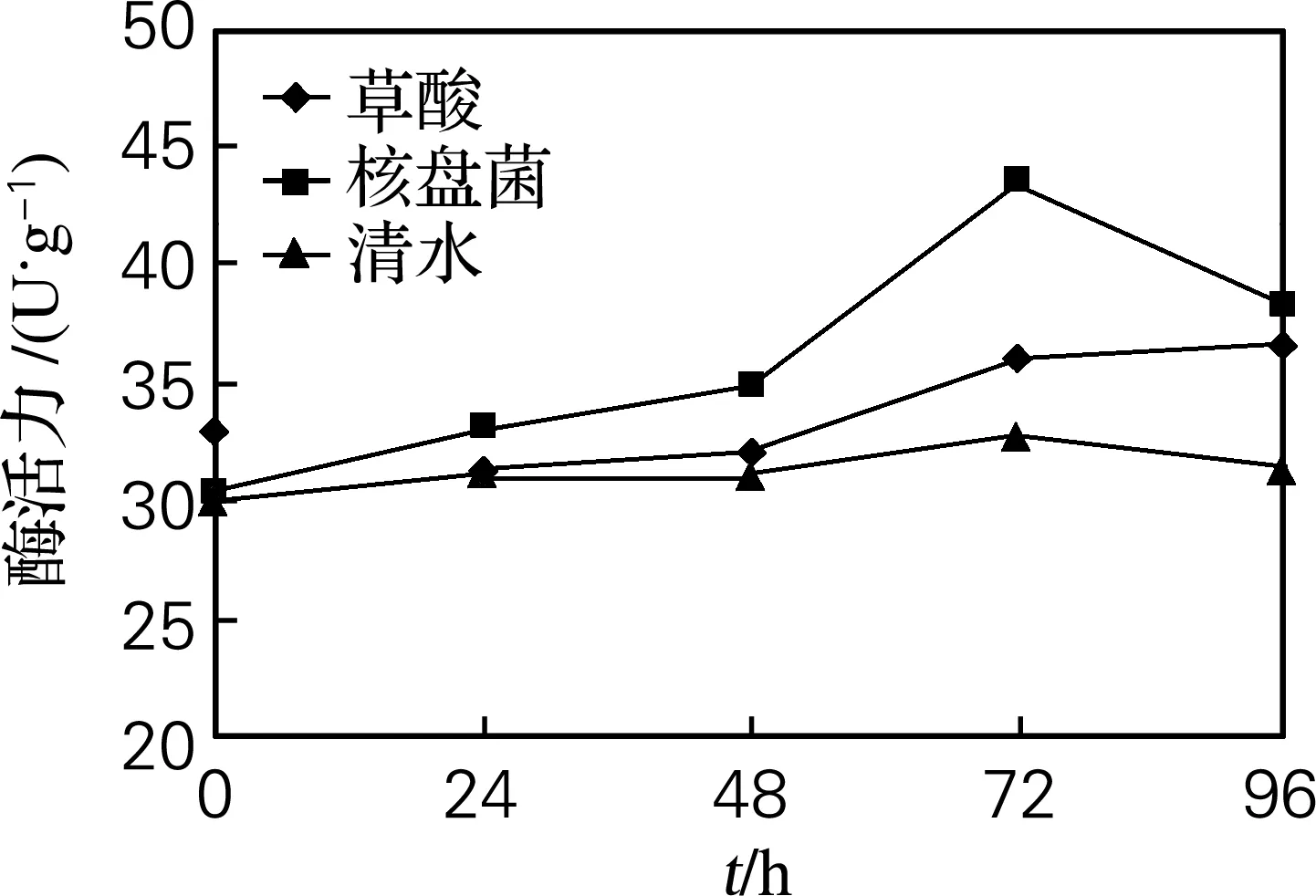
图2 草酸处理和接种核盘菌后叶片中PPO活力的变化
Fig.2 PPO activity in leaves soaked in oxalic acid solution and inoculated withS.sclerotiorum

图3 草酸处理和接种核盘菌后叶片中POD活力的变化
Fig.3 POD activity in leaves soaked in oxalic acid solution and inoculated withS.sclerotiorum
2.4 纤维素酶活力的变化
如图4所示,草酸和核盘菌诱导初期,纤维素酶活力变化不明显,随着诱导时间的延长,48 h后酶活力开始逐渐升高,且均高于对照组,可推断核盘菌在48 h后开始分泌纤维素酶。在接种核盘菌96 h后酶活达到高峰,为3.11 U/g,草酸诱导72 h后酶活力达到最大,为1.03 U/g。
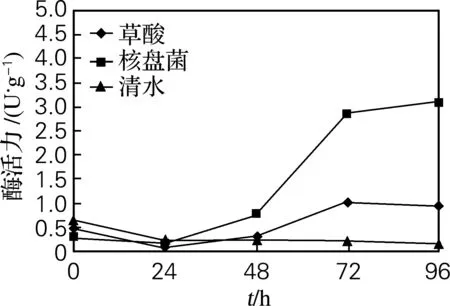
图4 草酸处理和接种核盘菌后叶片中纤维素酶活力变化
Fig.4 Cellulase activity in leaves soaked in oxalic acid solution and inoculated withS.sclerotiorum
2.5 几丁质酶活力的变化
如图5所示,几丁质酶在核盘菌和草酸诱导48 h内活力变化不明显;在核盘菌诱导48 h后,几丁质酶活力大幅升高,72 h左右达到最大,为1.44 U/g,随着诱导时间的延长,活力逐渐开始下降。草酸诱导48 h后也使得几丁质酶活力升高,但没有核盘菌作用明显。

图5 草酸处理和接种核盘菌后叶片中几丁质酶活力变化
Fig.5 The change of chitinase activity in leaves soaked in oxalic acid solution and inoculated withS.sclerotiorum
3 讨 论
实验结果表明,核盘菌和草酸都可以诱导油菜叶片中PPO和POD的活性提高,从而提高植物的抗病性。分析酶活力升高的原因,一方面是油菜发病后激活了相应的与POD和PPO有关的信号分子,使POD和PPO次生代谢增强,其含量增加[9];另一方面PPO和POD参与酚类物质的氧化,植物受病原菌侵染时会生成大量具有抗菌素性质的酚化合物,杀死寄主本身细胞的同时也能杀死侵染的病原物,因此PPO和POD活性的增加可以大大增加酚氧化物的含量,从而增强植物抗病的能力。
纤维素酶被认为与病菌的致病力密切相关,在发病过程中可能起一种分解寄主组织细胞壁提供营养的作用[10]。实验结果表明,在接种核盘菌96 h后纤维素酶活力达到最大,说明核盘菌入侵叶片组织时大量分泌纤维素酶,加快了核盘菌对细胞壁结构的破坏,使叶片迅速腐烂。同时核盘菌所分泌的草酸降低了组织的pH使酶活性达到高峰,充分说明了草酸和纤维素酶是油菜菌核病重要的治病因子。
有研究表明,几丁质酶可以水解真菌细胞壁中的几丁质。在本研究中,核盘菌和草酸侵染72 h后几丁质酶活力大大提高,分解核盘菌细胞壁中的结构物质,将几丁质水解成小分子的还原性寡糖,具有攻击细胞壁的能力,推断几丁质酶参与植物防卫反应。
[1] 韦善君,陈学章,李国庆,等. 盾壳霉在油菜花瓣上萌发的影响因子分析[J]. 华中农业大学学报, 1999, 18(6):254-257.
[2] CESSNA S G, SEARS V E, DICKNAN M B, et al. Oxalic acid, a pathogenicity factor forSclerotiniasclerotiorum, suppresses the oxidative burst of the host plant[J]. Plant Cell, 2000, 12(11):2191-2199.
[3] 刘胜毅,周必文,潘家荣. 油菜对毒素草酸的吸收代谢与抗性机理[J]. 植物病理学报, 1998, 28(1):33-37.
[4] 徐同,柳良好. 木霉几丁质酶及其对植物病原真菌的拮抗作用[J]. 植物病理学报, 2002, 32(2):97-102.
[5] 张笑宇,刘正坪,胡俊,等. 向日葵菌核病菌毒素对向日葵体内几种酶活性的影响[J]. 北京农学院学报, 2005, 20(1):49-52.
[6] 王琳,刘国生,王林嵩,等. DNS法测定纤维素酶活力最适条件研究[J]. 河南师范大学学报:自然科学版, 1998, 26(3):66-69.
[7] BOLLER T, GEHRI A, MOUCH F, et al. Chitinase in bean leaves:induction by ethylene, purification, properties, and possible function[J]. Planta, 1983, 157(1):22-31.
[8] 席玙芳,罗自生,程度. 竹笋采后木质化与多酚氧化酶、过氧化物酶和苯丙氨酸解氨酶活性的关系(简报)[J]. 植物生理学通讯, 2001, 37(4):294-295.
[9] 尹德明,丁得亮,郑志广,等. 水稻感染小球菌核病后多酚氧化酶活性的研究初报[J]. 天津农学院学报, 2003, 10(1):14-17.
[10] 双桑,阮颖,彭冬平,等. 油菜菌核病及抗病育种研究进展[J]. 作物研究, 2006(5):552-556.

