生物表面活性剂产生菌的筛选及特性研究
王 健, 孙 玉 梅, 王 培 忠, 曹 方
( 大连工业大学生物工程学院,辽宁大连 116034 )
0 引 言
经过一次、二次常规采油之后,遗留在地层的残余油仍然占石油总量的60%~70%。如何最大限度地开采出地下剩余的原油,已经成为石油工业的重要任务。Zobell在1946年发表了利用微生物提高石油采收率的专利,并发现微生物提高石油采收率的机理之一是微生物代谢过程中产生了生物表面活性剂[1-2]。产生表面活性剂的微生物种类很多,如酵母菌、真菌、细菌等。能以原油组分为碳源和能源产生生物表面活性剂的微生物,是微生物采油的首选菌种。现已知的能应用于微生物采油的菌种有近30个属100多种。利用不同的培养基对不同的菌种进行培养、驯化,获得了可以产生大量表面活性剂、对稠油具有较强的分散、乳化作用的菌种[3]。从污水中分离到的一株地衣芽孢杆菌可以耐受高温和高浓度盐,且对原油具有较强的乳化、增溶和降黏作用[4]。Ghojavand等[5]在兼性厌氧条件下筛选出耐高温(60 ℃)、高矿化度(15%NaCl)的枯草芽孢杆菌,该菌对原油具有较强的降黏作用。研究生物表面活性剂产生菌在微生物采油过程中的生长规律,探讨其作用机理,对微生物采油技术的改进和完善具有十分重要的理论和实际意义[6]。本研究通过原油平板培养法,筛选出3株生物表面活性剂产生菌,对各菌株进行生理生化试验和初步鉴定;测定各菌株在发酵过程中发酵液表面张力、pH、菌体密度和细胞疏水性等特征参数;对各菌株产生的生物表面活性剂组成进行分析。
1 材料与方法
1.1 材 料
1.1.1 菌 源
盘锦油田被原油污染的土壤。
1.2 方 法
1.2.1 培养基及其制备方法
液体富集培养基(g/L):原油3.0,NaCl 3.0,NH4Cl 0.1,MgSO40.02,NaNO30.2,KH2PO40.1,K2HPO40.2,pH 7.0。于1.03×105Pa灭菌30 min。
平板富集培养基(g/L):原油3.0,蛋白胨5.0,琼脂20.0,NaCl 3.0,NH4Cl 0.1,MgSO40.02,NaNO30.2,KH2PO40.1,K2HPO40.2,pH 7.0。于1.03×105Pa灭菌30 min。
平板分离及保藏培养基(g/L):葡萄糖3.0,蛋白胨8.0,酵母膏3.0,KH2PO42.7,NaCl 5.0,琼脂20.0,pH 7.0。于0.8×105Pa灭菌30 min。
种子培养基(g/L):NaCl 5.0,牛肉膏5.0,蛋白胨10.0,pH 7.0,于1.03×105Pa灭菌30 min。
发酵培养基(g/L):KH2PO43.4,Na2HPO41.5,(NH4)2SO44.0,MgSO4·7H2O 0.7,酵母粉0.2,液体石蜡17,pH 7.0,于1.03×105Pa灭菌30 min。
1.2.2 菌源微生物的富集
称取土样10 g,加入生理盐水90 mL,振荡均匀,静止12 h。取上清液按10%接种量接种到液体富集培养基中,于30 ℃、180 r/min的恒温摇床中振荡培养3 d。连续转接培养3次。
1.2.3 生物表面活性剂产生菌的分离、筛选与鉴定
生物表面活性剂产生菌的分离、初筛:将液体富集培养液用无菌生理盐水稀释105、106、107倍,每个稀释度取0.1 mL菌液涂布于平板富集培养基上,于30 ℃静置培养4 d。将平板富集培养基上有乳化圈或噬油斑[7]的菌落,进一步在平板分离培养基上划线分离纯化,挑取单菌落保藏在斜面保藏培养基上。
生物表面活性剂产生菌的复筛:将斜面保存的初筛菌株接种在种子培养基中,于30 ℃、180 r/min振荡培养1~3 d,再以体积分数为5%的接种量将种子培养液接于液体发酵培养基,于30 ℃、180 r/min振荡培养。根据液体石蜡被乳化及发酵液表面张力的变化,筛选出产生物表面活性剂的优势菌株。
生物表面活性剂产生菌的鉴定:根据《伯杰氏(Berge)菌种鉴定手册》对分离得到的部分菌株进行形态观察和生理生化鉴定。
1.2.4 生物表面活性剂提取与分析
1.2.4.1 生物表面活性剂的提取
将发酵液用滤纸过滤除油,滤液于3 000g离心20 min除菌,取上清液加入等体积的氯仿和甲醇(体积比为2∶1)的混合液,萃取3次。将萃取后的有机相于40 ℃旋转蒸发得表面活性剂粗品[8]。
1.2.4.2 生物表面活性剂的化学组成分析
将发酵液用滤纸过滤除油,滤液于3 000g离心20 min除菌,取上清液加入等体积氯仿和甲醇(体积比为2∶1)萃取所得有机相进行薄层层析。以氯仿、甲醇和水(体积比为65∶15∶2) 为展开剂,以苯酚-硫酸试剂为显色剂,显棕色斑点为糖脂;以茚三酮试剂为显色剂,显红色斑点为脂肽。
取150 mg样品加入2 mol/L H2SO4,于100 ℃密封水解8 h,用BaCO3中和至中性,3 000g离心10 min,取上清液进行薄层层析。以氯仿、甲醇和水(体积比为65∶15∶2)为展开剂,以苯酚-硫酸试剂为显色剂,以鼠李糖为标准样品[9]。
薄层层析用硅胶板为德国Merck公司产品silica gel 60 F254。
1.2.5 生物表面活性剂产生菌的生长特性
菌体密度的测定:采用浊度法[10]。移除发酵液上层油相,取发酵液3 mL,加入TritonX-100(0.2%)溶液0.5 mL ,漩涡振荡1 min,于3 000g离心20 min,倒掉上清液,用3 mL去离子水重悬菌体,以去离子水为空白,于600 nm测定菌悬液的光密度OD600,以此表示发酵液的菌体密度。
疏水性(BATH)测定:采用BATH测定方法[10-11]。移除发酵液上层油相,取发酵液3 mL,测定OD′600。加入石油醚0.1 mL,振荡1 min,静置30 s,再振荡1 min,于30 ℃水中静置15 min,取下层液体测定OD600。细胞疏水性BATH=OD600/OD′600。
表面张力测定:采用JY-180表面张力仪(承德大华试验机有限公司) 测定。将发酵液用滤纸过滤除油,滤液于3 000g离心20 min除菌,取上清液测定表面张力。
pH测定:采用pH3-3C精密pH计(上海雷磁仪器厂)测定。将发酵液用滤纸过滤除油,滤液于3 000g离心20 min除菌,取上清液测定pH。
2 结果与分析
2.1 生物表面活性剂产生菌的筛选
经富集分离共得到49株细菌,初步筛选出14株生长较好的目的菌株接种于发酵培养基。在微生物采油过程中,表面活性剂和有机酸可以把原油从岩层中剥离下来,提高原油流动性。因此,以发酵过程中发酵液的pH和表面张力的降低为指标,对初筛得到的菌株进行复筛,同时分析所产生物表面活性剂的类型,结果见表1。

表1 初筛菌株的发酵测定结果
由表1可知,菌株29#、30#、31#、37#、47#的发酵液的表面张力值及pH较低。选取该5株菌进行分析,菌株29#、30#、31#发酵液的表面张力及pH比较接近,产生的生物表面活性剂均为糖脂,在原油平板上的菌落均为荧光绿色,种子液和发酵液均为荧光绿色,细胞均为杆状且大小相同。因此,判断该3株菌为同一菌种。复筛得到的菌株为31#、37#、47#。
2.2 生物表面活性剂产生菌的生理生化特性
对筛选所得菌株进行常规生理生化特性实验,结果如表2所示。根据表2所示结果和《伯杰氏(Berge)菌种鉴定手册》的描述,可鉴定菌株31#为假单孢属,菌株37#、47#均为芽孢杆菌属。

表2 生物表面活性剂产生菌的生理生化特性
2.3 生物表面活性剂产生菌的生长特性
2.3.1 菌株31#的生长特性
菌株31#的生长特性如图1所示。在发酵前48 h,菌株31#细胞疏水性呈上升趋势,菌体密度逐步增长,发酵液的表面张力下降。表明较强的细胞疏水性能增加菌体对疏水性有机物的吸附,从而增加菌体与有机物的接触机会,增强对有机物的利用能力,导致菌体大量生长并产生大量的生物表面活性物质,使发酵液的表面张力大幅度下降,产生的生物表面活性物质通过改变吸附界面的特性来调节细胞与界面之间的亲和力,进一步促进微生物细胞对烃类化合物的附着和烃类化合物穿透细胞膜间隙[12-13]。在发酵48~84 h期间,菌体生长进入衰亡期,细胞疏水性下降,发酵液的表面张力呈下降趋势,这是部分菌体自溶释放出细胞内的生物表面活性物质的结果[14]。在发酵84~108 h期间,细胞疏水性呈下降趋势,发酵液的表面张力随菌体密度增大而增大,表明菌体摄取烃类化合物能力降低,利用发酵液中积累的生物表面活性剂呈现二次生长。在发酵108~120 h期间,细胞疏水性上升,表面张力下降。由于31#为革兰氏阴性菌,细胞外壁中存在与其疏水性密切相关的脂多糖,发酵液中大量积累的生物表面活性剂导致细胞壁中脂多糖大量流失,从而引起细胞疏水性增大[15]。
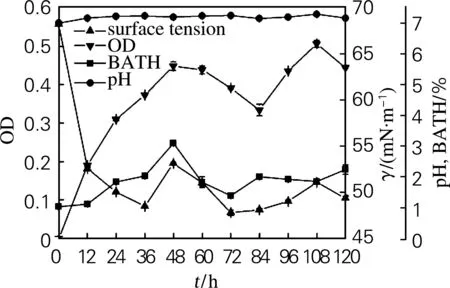
图1 菌株31#的好氧培养过程曲线
Fig.1 Cultivation course curve of strain 31#under aerobic condition
2.3.2 菌株37#的生长特性
菌株37#的生长特性如图2所示。在发酵过程中,细胞疏水性总体呈上升趋势。发酵24 h时,细胞疏水性大于1,菌体密度随细胞疏水性的增大而增大。发酵36 h时,发酵液的表面张力降低,这是因为烃类的难溶性使得微生物在摄取烃类生长过程中往往伴随着生物表面活性剂的生成,其主要作用是使烃类在水溶液中有效扩散,并渗入细胞内部被同化分解[16],菌体能够更好地利用烃类碳源生长,菌体密度上升。在发酵48~84 h期间,菌体生长进入稳定期,菌体密度保持不变。在发酵84~96 h期间,菌体密度上升,细胞出现二次生长。这是由于液体石蜡是一种混合物,菌体首先摄取较易利用的10个碳以上的长链烷烃[17],然后再利用其他链长的烷烃进行生长,同时因为细胞疏水性上升,细胞利用液体石蜡的能力增强,从而产生大量的生物表面活性物质,使发酵液的表面张力下降。在发酵96~120 h期间,细胞疏水性的降低,菌体密度降低,菌体生长进入衰亡期,发酵液的表面张力上升。

图2 菌株37#的好氧培养过程曲线
Fig.2 Cultivation course curve of strain 37#under aerobic condition
2.3.3 菌株47#的生长特性
菌株47#的生长特性如图3所示。在发酵前48 h,菌体密度显著增长,细胞疏水性增大,发酵液的表面张力降低。在发酵60~72 h期间,菌体密度减小,细胞疏水性降低,发酵液表面张力降低,菌体生长进入衰亡期。在发酵72~84 h期间,菌体密度增加,细胞出现二次生长,产生大量的生物表面活性物质,使发酵液的表面张力大幅下降。在发酵84~120 h期间,菌体密度降低,发酵液的表面张力在保持一段时间的基本稳定后升高。表明菌体在利用烃类生长过程中,产生了生物表面活性剂。生物表面活性剂的产生降低了油水界面张力,使烷烃得以有效扩散,增大油水界面面积,从而便于细胞与较大油滴之间的直接接触,同时使细胞的疏水性变大,导致细胞亲油,从而有利于菌对烃类的利用[18]。
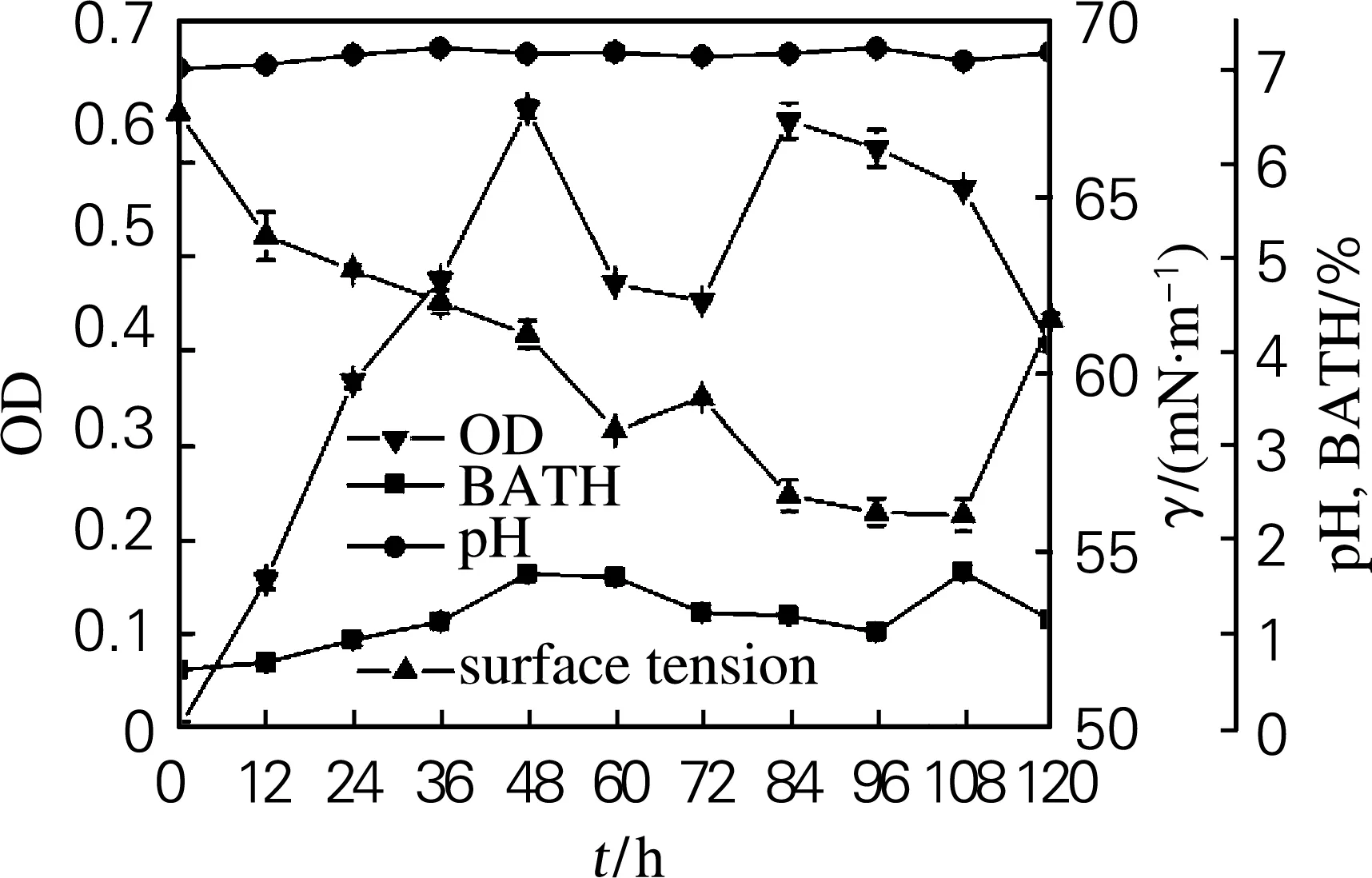
图3 菌株47#的好氧培养过程曲线
Fig.3 Cultivation course curve of strain 47#under aerobic condition
2.4 生物表面活性剂的化学组分分析
将菌株31#、37#和47#于30 ℃培养后,对发酵液萃取所得生物表面活性剂粗制品进行硅胶薄层层析,结果如图4所示。将萃取所得生物表面活性剂粗制品进行酸解,硅胶薄层层析结果如图5所示。
图4的层析结果显棕色,说明菌株31#、37#和47#所产的生物表面活性剂均为糖脂。由图5可知,菌株31#、37#和47#所产的生物表面活性剂经酸解后显棕色斑点,且Rf值与鼠李糖的Rf值相同,说明菌株31#、37#和47#所产的生物表面活性剂的糖基均为鼠李糖。

图4 生物表面活性剂粗品的TLC图谱

图5 生物表面活性剂酸解后的TLC图谱
Fig.5 Thin-layer chromatography of biosurfactant hydrolyzed by acid
3 结 论
通过对发酵液表面张力及pH的测定,筛选出3株生物表面活性剂产生菌,且所产的生物表面活性剂均为鼠李糖脂;经生理生化鉴定,菌株31#为假单胞菌属,菌株37#、47#为芽孢杆菌属;通过对所筛菌株的生长特性的研究,说明菌体密度、细胞疏水性、发酵液的pH及表面张力之间密切相关,相互制约。在以液体石蜡为唯一碳源培养时,菌株31#的发酵液表面张力下降最多,且表现出的细胞疏水性最强,发酵液表面张力下降到49.47 mN/m,细胞疏水性为3.09%。较强的细胞疏水性有利于菌体对疏水性基质的利用,从而导致菌体密度的增长及发酵液表面张力的下降,这对微生物开采稠油十分有利。
[1] 王霞,潘成松,范舟,等. 微生物采油技术的发展现状[J]. 石油地质与工程, 2007, 21(5):65-68.
[2] 卢家亭,李闽. 微生物采油现状及前景展望[J]. 内蒙古石油化工, 2006(4):24-26.
[3] 李牧,杨红,刘思贤. 微生物表面活性剂在稠油乳化降粘中的实验研究[J]. 特种油气藏, 1999, 6(4):53-58.
[4] 张翠竹,张心平,梁凤来. 一株地衣芽孢杆菌产生的生物表面活性剂[J]. 南开大学学报:自然科学版, 2000, 33(4):41-45.
[5] GHOJAVAND H, VAHABZADEH F, MEHRANIAN M, et al. Isolation of thermotolerant, halotolerant, facultative biosurfactant-producing bacteria[J]. Applied Microbiology and Biotechnology, 2008, 80:1073-1085.
[6] 邓勇,易绍金. 稠油微生物开采技术现状及进展[J]. 油田化学, 2006, 23(3):289-292.
[7] 贾燕,尹华,彭辉,等. 一株表面活性剂产生菌的筛选及其特性研究[J]. 微生物学通报, 2007, 34(6):1066-1070.
[8] 侯百友,孙玉梅,杨冠科,等. 烃降解菌HB29产糖脂发酵条件的研究[J]. 中国酿造, 2009(2):83-85.
[9] 梁凤来,张心平,刁虎欣,等. 假单胞菌GD-23原油发酵液乳化物质的提取和分析[J]. 南开大学学报:自然科学版, 2001, 34(1):13-16.
[10] 陈延君,王红旗,王然,等. 鼠李糖脂对微生物降解正十六烷以及细胞表面性质的影响[J]. 环境科学, 2007, 28(9):2117-2122.
[11] RAGHEB A, ALTAHHAN, TODD R, et al. Rhamnolipid-Induced removal of lipopolysaccharide fromPseudomonasaeruginosa:effect on cell surface properties and interaction with hydrophobic substrates [J]. Applied and Environmental Microbiology, 2000, 66(8):3262-3268.
[12] 赵敏,马宏瑞. 油烃降解菌的降解特性研究[J]. 油气田环境保护, 2007, 17(2):8-10.
[13] ANNA Z, MALTE H. Effects of bacterial cell surface structures and hydrophobicity on attachment to activated sludge flocs[J]. Applied and Environmental Microbiology, 1997, 63(3):1168-1170.
[14] 马宏瑞,赵敏,杜战鹏,等. 两株柴油降解菌的性能研究[J]. 化工环保, 2007, 27(2):105-108.
[15] 梁生康. 鼠李糖脂生物表面活性剂对石油烃污染物生物降解影响的研究[D]. 青岛:中国海洋大学. 2005.
[16] 钱欣平,阳永荣,孟琴. 生物表面活性剂对微生物生长和代谢的影响[J]. 微生物学通报, 2002, 29(3):75-78.
[17] 钱欣平,阳永荣,孟琴. 利用不同碳源合成生物表面活性剂的研究[J]. 日用化学工业, 2002, 32(1):15-17.
[18] 赵晴,张甲耀,陈兰洲,等. 疏水性石油烃降解菌细胞表面疏水性及降解特性[J]. 环境科学, 2005, 26(5):132-136.

