猪繁殖与呼吸综合征病毒ORF7基因的克隆、高效表达与鉴定
张 秀 云, 吴 斌, 肇 慧 君, 贾 赟, 刘 霞, 张 瑞
( 1.大连工业大学 生物工程学院, 辽宁 大连 116034;2.辽宁出入境检验检疫局, 辽宁 大连 116001;3.河南农业大学 牧医工程学院, 河南 郑州 450002 )
0 引 言
猪繁殖与呼吸综合征(Porcine Reproductive and Respiratory Syndrome, PRRS)是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus, PRRSV)。近年来,PRRS在我国存在不同程度的流行,造成严重的经济损失[1]。自PRRSV在北美发现以来,围绕其准确诊断与疫苗的研究不断深入。但由于PRRSV基因组具有较大的变异性[2],为研究带来一定的难度。
PRRSV系单股正链RNA病毒,该病毒的基因组长约15 kb。PRRSV的核衣壳N蛋白最为保守,是该病毒免疫原性最强的结构蛋白[3],也是目前进行PRRS诊断的抗原基础。感染PRRSV后的早期免疫应答主要是针对N蛋白的,对其产生的抗体持续时间也最长,N蛋白以其强大的免疫性和相对的保守性成为现行诊断试验的抗原基础,也是研制重组诊断抗原的首选靶抗原[4]。
本实验对PRRSV的N蛋白基因(ORF7)[5]进行克隆、测序鉴定、原核表达及纯化,纯化后的重组蛋白和PRRSV阳性血清进行免疫学印迹试验(Western-blotting),验证表达蛋白的免疫学活性,为下一步血清学检测方法的建立和诊断试剂盒的研制奠定基础。
1 材料与方法
1.1 细胞、质粒、菌种与毒株
Marc-145细胞及PRRSV ATCC VR2332标准毒株冻干样品由辽宁出入境检验检疫局动检实验室提供;pET-28a(+)、Ni-NTA His Bind Resis购自Novagen公司;感受态细胞DH5α、BL21(DE3)宿主菌、pMD18-T载体均购自大连宝生物公司;巴氏小鼠购自大连医科大学实验动物中心。
1.2 试 剂
DMEM培养基为GIBCO公司出品;新生犊牛血清购自杭州四季青公司;Taq DNA聚合酶、限制性内切酶、反转录酶AMV购自大连宝生物公司;一抗为自制鼠抗PRRSV抗体;二抗(羊抗鼠IgG-HRP)购自SIGMA公司;病毒RNA/DNA快速纯化试剂盒、DNA凝胶回收试剂盒、质粒DNA小量纯化试剂盒购自大连宝生物公司。
1.3 引物的设计与合成
根据GenBank发表的PRRSV VR2332株的核衣壳ORF7基因序列,采用Oligo 6.0软件自行设计引物,由大连宝生物公司合成,扩增完整的ORF7基因序列。
P1:5′-GCCGAATTCATGCCAAATAACAAC-3′
EcoRI
P2:5′-AATCTCGAGTCATGCTGAGGGTGA-3′
XhoI
扩增目的片段长度为372 bp。
1.4 PRRSV标准毒株的增殖
MARC-145细胞在含10%小牛血清的DMEM培养基内贴壁长满单层后,弃培养基,按病毒液与维持液(含2%小牛血清的DMEM)1∶10的比例,接种PRRSV VR2332标准毒株冻干样品稀释液,37 ℃吸附1 h,加入维持液后置37 ℃、5% CO2细胞培养箱中继续培养,待细胞出现70%以上病变时收获病毒。冻融3次后的细胞培养液作为提取PRRSV的RNA的材料,RNA提取方法按Trizol法进行。
1.5 ORF7基因片段扩增
RT-PCR扩增反应,获得目的基因。反转录条件:42 ℃,1 h;95 ℃,15 min。
PCR条件:94 ℃,5 min; 94 ℃,45 s;52 ℃,45 s;72 ℃,1 min,30个循环;72 ℃,10 min。1%琼脂糖凝胶电泳检查PCR产物,按胶回收试剂盒说明书回收特异性目的片段。
1.6 ORF7基因片段的克隆、鉴定和测序
将回收的N基因片段与pMD-18T载体进行连接反应,构建重组质粒pMD-18T-N。pMD18T-N转化至DH5α感受态细胞,涂氨苄平板,置37 ℃恒温箱过夜培养,挑取单菌落接种于含50 μg/mL氨苄青霉素的液体LB中过夜培养。按试剂盒提取质粒,用EcoRI、XhoI酶切鉴定重组质粒pMD-18T-N,核酸电泳检查插入片段的大小,然后对pMD-18T-N进行测序。
1.7 重组表达质粒的构建
经EcoRI、XhoI双酶切的ORF7基因片段与表达载体pET-28a(+) 进行连接,连接产物转化至BL21感受态细胞,涂卡那霉素平板,置37 ℃恒温箱过夜培养,挑取单菌落接种于含50 μg/mL卡那霉素的液体LB培养基内振荡过夜培养。按试剂盒提取质粒,重组质粒经PCR扩增及双酶切鉴定,筛选到阳性重组质粒pET-28a(+)-N。
1.8 阳性重组质粒在大肠杆菌中的表达
将pET-28a(+)-N转化至BL21感受态细胞,涂板,挑取单菌落37 ℃过夜培养,菌液以1∶100比例接种于含卡那霉素的新鲜LB培养基中,于37 ℃振荡培养约3 h,至OD600值达到0.6时,分别在30、37 ℃培养温度下,加入不同终浓度的IPTG(0.2、0.4、0.6、0.8、1.0 mmol/L),继续培养5 h,其间每隔1 h取1 mL菌液进行12% SDS-PAGE电泳鉴定。
1.9 重组蛋白的纯化及免疫学活性检测
将在37 ℃,0.2 mmol/L IPTG诱导培养5 h的500 mL菌液离心沉淀,用8 mL Denaturing Binding Buffer(8 mol/L Urea,20 mmol/L Na2HPO4,500 mmol/L NaCl,pH 7.8) 重悬,将其置于冰浴中超声破碎12 min。5 000 r/min离心15 min,获取上清待用。另取20 μL上清进行SDS-PAGE电泳鉴定。
用Ni-NTA层析柱在变性条件下纯化重组蛋白。Ni-NTA resin经装柱、平衡、上样后,依次洗脱、收集、透析复性。收集的蛋白在-80 ℃保存备用。按Western-blotting方法鉴定表达蛋白免疫学活性。
2 结果与分析
2.1 病毒增殖
将PRRSV ATCC VR2332病毒接种于Marc-145细胞上,在72 h出现约70%的细胞病变,如图1所示。
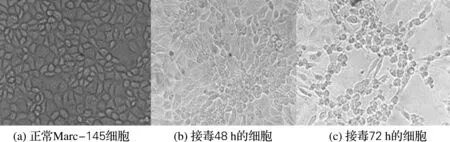
图1 Marc-145细胞接毒后病变情况
2.2 PRRSV ORF7基因片段扩增
以RT-PCR获得的CDNA为模板扩增完整ORF7基因片段,大小为372 bp,与预计相符。如图2所示。

M,DL2000 Marker;1、2,RT-PCR扩增产物;3,阴性对照
图2 PRRSV VR2332标准株ORF7基因的RT-PCR扩增
Fig.2 RT-PCR amplification for ORF7 gene of PRRSV VR2332
2.3 重组质粒pMD-18T-N的酶切鉴定和测序分析
将PCR产物连接入pMD-18T载体,用EcoRI、XhoI双酶切鉴定,选取酶切出现约2.7 kb和372 bp大小的质粒为阳性重组质粒,挑取阳性重组质粒进行测序。
用DNA star软件对测序结果进行分析,并与美洲株VR2332、欧洲株LV和国内数株参考毒株ORF7基因序列进行比较分析。其基因与氨基酸同源性比较结果如表1所示。
由表1可以看出,测序基因与VR2332株ORF7基因序列同源性为100%,与LV株ORF7基因序列同源性为65.1%。氨基酸同源性比较中,本实验室毒株与VR2332株ORF7同源性为100%,与LV株氨基酸同源性为58.5%,并与大部分国内PRRSV毒株氨基酸序列同源性较高。
2.4 原核表达重组质粒pET-28a(+)-N的鉴定
以特异性引物扩增重组质粒pET-28a(+)-N,核酸电泳显示出现大小为372 bp的ORF7基因片段。阳性质粒经EcoRI及XhoI双酶切,出现5 324 bp和372 bp两条带,说明ORF7基因被定向插入到表达载体pET-28a(+)内,构建成重组质粒pET-28a(+)-N,如图3所示。

表1 测序基因与国内外其他毒株N基因和氨基酸同源性比较
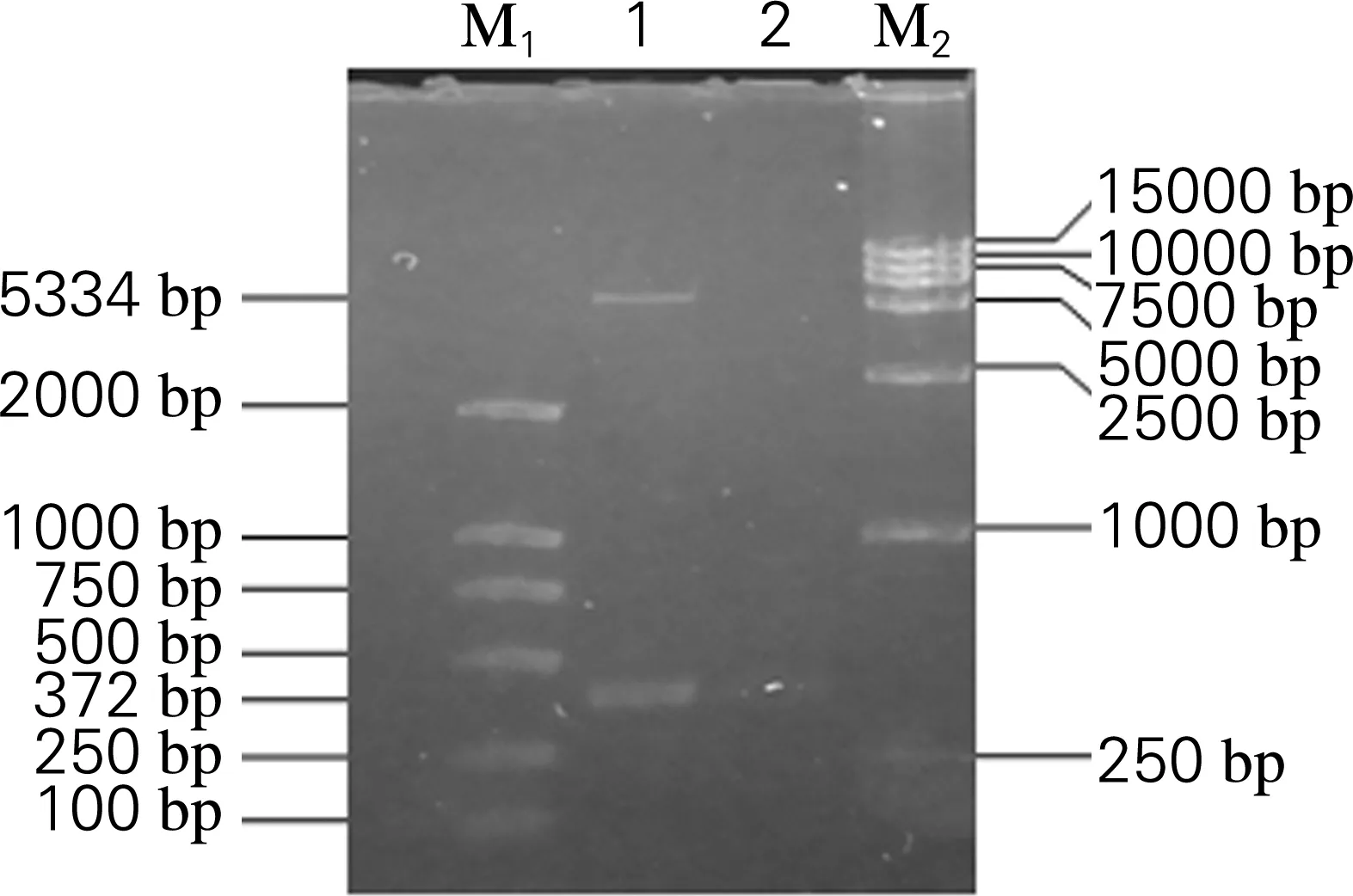
M1,DL2000 DNA Marker;1,重组质粒pET-28a(+)-N的EcoRI和XhoI的双酶切;2,阴性对照;M2,DL15000 DNA Marker
图3 重组质粒pET-28a(+)-N酶切鉴定
Fig.3 The identification of pET-28a(+)-N
2.5 重组质粒pET-28a(+)-N的表达及表达蛋白的纯化
SDS-PAGE电泳显示,重组质粒pET-28a(+)-N转化至BL21细胞中,在0.2 mmol/L IPTG,37 ℃诱导表达5 h时,PRRSV核衣壳重组蛋白在BL21细胞中获得了高效表达,大小约为22 ku,与预期相符。重组蛋白经His-bind Purification Kit亲和层析柱纯化、透析复性,12%的SDS-PAGE电泳显示获得单一纯化蛋白。结果如图4所示。
2.6 重组蛋白免疫原性Western-blotting分析
以自制鼠抗PRRSV全病毒的阳性血清作为一抗,对诱导表达的原核重组N蛋白进行Western-blotting检测。结果在大小约22 ku处出现一清晰的特异性反应条带,而宿主菌空载体pET-28a(+)无此条带。表明重组蛋白在大肠杆菌中得到了正确表达并保留了与PRRSV阳性血清反应的抗原性,结果如图5所示。因此,本实验制备的重组蛋白可用来建立PRRS的血清学检测方法。
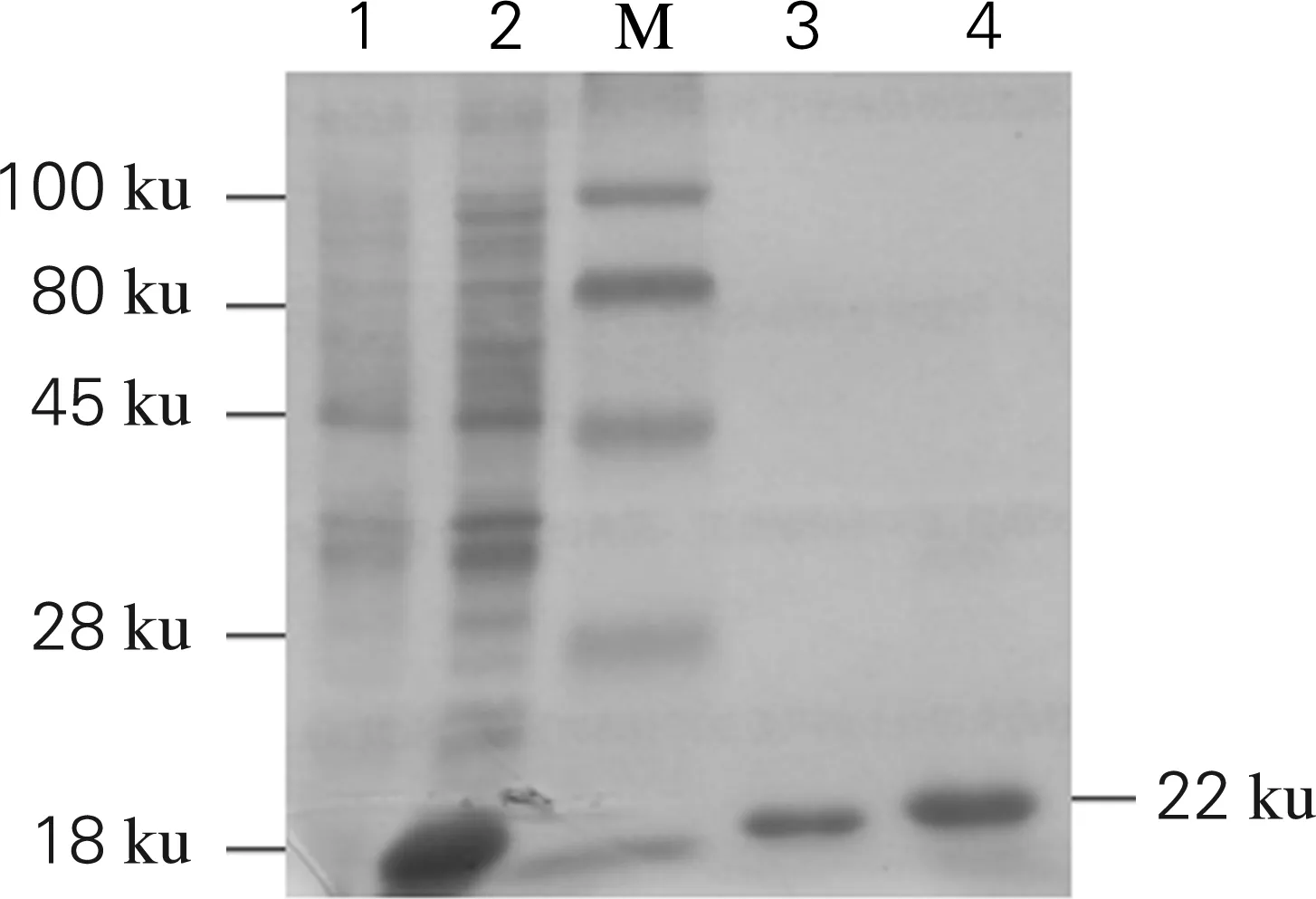
1,pET-28a(+)/BL21诱导后的菌体总蛋白; 2,pET-28a(+)-N/BL21诱导后的菌体总蛋白; M,低分子质量蛋白Marker;3,纯化后重组蛋白;4,复性后重组蛋白
图4 重组蛋白pET-28a(+)-N表达产物的SDS-PAGE分析
Fig.4 SDS-PAGE analysis of the recombinant protein expression by pET-28a(+)-N

1,pET-28a(+)/BL21诱导后的菌体总蛋白;2,pET-28a(+)-N/BL21诱导后的菌体总蛋白; M,低分子质量蛋白Marker;3,纯化后的重组蛋白;4,复性后的重组蛋白
图5 重组蛋白pET-28a(+)-N的Western-blotting检测
Fig.5 Western-blotting analysis of the recombinant protein expression by pET-28a(+)-N
3 结 论
本研究使用的PRRSV ATCC VR2332是猪繁殖与呼吸综合征美洲型病毒的标准毒株,与GenBank中PRRSV VR2332 N基因进行比对符合率为100%,与国内毒株N基因对比符合率也都较高。这对于建立具有临床普遍意义的PRRSV检测方法具有重要意义。将PRRSV株0RF7基因克隆到原核表达载体pET-28a(+)中,以期获得原核表达重组质粒pET-28a(+)-N,将其转化大肠杆菌BL21,在IPTG诱导下获得了高效表达。将纯化复性后的重组N蛋白与抗PRRSV全病毒阳性血清进行Western-blotting鉴定,结果重组N蛋白与PRRSV阳性血清发生特异性反应,表明表达的重组N蛋白具有较好的反应活性。
制备的重组N蛋白,与全毒检测的方法相比,可以克服散毒这一弊端,只需通过简单的温度诱导就可获得大量的重组表达。通过Ni-NTA柱的纯化和透析复性后,重组蛋白的纯度大大提高,并且抗原性更佳,可用做诊断抗原。这为利用该原核表达产物建立反应机体抗体水平的特异性诊断方法提供了基础材料。
[1] 蔡雪辉. 我国猪繁殖与呼吸综合征的流行特点、分布规律与防制策略 [J]. 吉林畜牧兽医, 2002(4):6-7,17.
[2] DENAC H, MOSER C, TRATSH J D, et al. An indirect ELISA for the detection of antibodies against porcine reproductive and respiratory syndrome virus using recombinant nucleocapsid protein as antigen[J]. Journal of Virological Methods,1997, 65(2):169-181.
[3] WISSINK E H J, WIJK H A R, KROESE M V, et al. The major envelope protein GP5 of a European porcine reproductive and respiratory syndrome virus contains a neutralization epitope in its N-terminal ectodomain[J]. Journal of General Virology, 2003, 84(6):1535-1543.
[4] SEUBERLICH T, TRATSCHIN J, THUR B, et al. Nucleocapsid protein-based enzyme-linked immunosorbent assay for detection and differentiation of antibodies against European and North American porcine reproductive and respiratory syndrome virus[J]. Clinical and Diagnostic Laboratory Immunology, 2002, 9(6):1183-1191.
[5] PIRZADEH B, DEA S. Immune response in pigs vaccinated with plasmid DNA encoding ORF5 of porcine reproductive and respiratory syndrome virus[J]. Journal of General Virology, 1998, 79(5):989-999.

