盐度突变对半滑舌鳎血浆渗透压和鳃丝Na+/K+-ATP酶活性的影响
田相利, 王国栋 董双林 房景辉 刘 营
(1. 中国海洋大学 水产学院 教育部海水养殖重点实验室, 山东 青岛 266003; 2. 盘锦光合水产有限公司,辽宁 盘锦, 124200)
盐度突变对半滑舌鳎血浆渗透压和鳃丝Na+/K+-ATP酶活性的影响
田相利1,2, 王国栋1, 董双林1, 房景辉1, 刘 营1
(1. 中国海洋大学 水产学院 教育部海水养殖重点实验室, 山东 青岛 266003; 2. 盘锦光合水产有限公司,辽宁 盘锦, 124200)
研究了半滑舌鳎(Cynoglossus semilaevis)由盐度30突变至0、10、20、35和40盐度后血浆渗透压和鳃丝Na+/K+-ATP酶活性的变化。结果表明, 盐度对半滑舌鳎血液渗透压和鳃丝Na+/K+-ATP酶活性均有显著影响(P<0.05)。盐度突变后, 各处理组的血液渗透压和鳃丝Na+/K+-ATP酶活性均随盐度的变化而相应地上升和下降, 且其变化幅度与盐度的变化幅度直接相关。各处理组血液渗透压在经历盐度变化6 d内有峰值变化, 峰值出现在2 d时, 6 d后血液渗透压趋于稳定; 而鳃丝Na+/K+-ATP酶活性在经历盐度变化9 d时调节至稳定状态, 峰值则出现在6 d时, 峰值大小亦与盐度的变化幅度正相关。本研究表明半滑舌鳎对盐度可能具有较强的适应能力。
半滑舌鳎(Cynoglossus semilaevis);盐度; 血液渗透压; 鳃丝Na+/K+-ATP酶活性
生活在淡水或海水中的各种硬骨鱼类, 其体液渗透浓度比较接近且相对稳定, 而其生活的水环境盐度却相差很大, 鱼类为了维持体内一定的渗透浓度必须进行渗透调节, 这样, 鱼类调节渗透能力的大小就决定了它们对水环境盐度变化的耐受力。不同鱼类对于盐度变化的耐受力差异很大:大菱鲆(Scophthalmus maximus)可以忍受较大而快速的环境盐度波动, 但其适应的盐度低限在盐度5左右[1], 而潘鲁青等[2]的研究则表明褐牙鲆(Paralichthys olivaceu)对最低盐度为 6的低渗环境具有较强的适应能力。目前, 国内外对鱼类的渗透调节研究已有许多相关报道, 这些研究中, 大多以血浆渗透压和鳃丝Na+/K+-ATP酶作为评价鱼类渗透调节能力的指标[1-6]。半滑舌鳎(Cynoglossus semilaevis)为中国近海常见的暖温性底栖大型鱼类[7], 主要分布在中国黄海和渤海。半滑舌鳎个体大, 生长速度快, 肉味鲜美, 是一种名贵经济海水鱼类, 由于该鱼具有广温、广盐等特点, 因此是一种理想的增养殖种类。目前, 尽管国已内有半滑舌鳎低盐度养殖的实践, 但国内外关于其渗透调节的研究尚未见报道。本研究设定了不同的突变盐度水平, 通过测定半滑舌鳎幼鱼的血液渗透压和鳃丝 Na+/K+-ATP酶活性, 对其渗透调节能力进行了研究, 初步探讨了半滑舌鳎对盐度的适应性, 从而可为其在不同盐度下的养殖生产实践提供理论依据。
1 材料与方法
1.1 实验鱼的来源
实验用半滑舌鳎幼鱼购自江苏省海洋水产研究所, 体质量 12.67 g±2.87 g, 全长 13.52 cm±1.65 cm,均为健康个体。
1.2 实验鱼的驯化
实验鱼运到后, 在室内24℃±0.5 ℃驯养10 d左右, 使之适应实验室的条件。驯养期间每天于 7:00和17:00各投喂1次, 日换水率50%。
1.3 实验设计与管理
1.3.1 实验设计
本实验设置了 6个不同盐度突变水平, 将驯养的半滑舌鳎幼鱼按照随机抽取的方式, 由盐度30(以S30表示)分别突变到 0、10、20、35和 40(分别以S0、S10、S20、S35和S40表示), 每个处理分别设置3个重复。实验过程中, 按照时间0、1、6、12 h、1、2、3、6、9和12 d的时间间隔取样, 每次每个处理随机取鱼3尾。
1.3.2 实验管理
实验用水族箱为玻璃水族箱(规格为 55 cm×30 cm×35 cm, 50 L), 每箱随机放鱼30尾, 水族箱用纱窗盖住, 防止鱼跳出。实验期间保持正常换水, 换水前一天调至适宜的盐度。低盐度水由经过充分曝气的砂滤海水(盐度 30)和井淡水(盐度为 0)调配而成,高盐度水由砂滤海水加海水素调配而成。
每天7:00和17:00各投喂一次日清红丸配合饲料, 其营养成分见表1。每次投喂1.5 h后, 将残饵和粪便吸出。实验期间, 水温控制在24℃左右, 光照周期为12 L:12 D, 24 h时连续充气。
1.4 血浆的取样和渗透压的测定
用1 mL注射器从半滑舌鳎腹部尾静脉插入抽取血液, 血液抽出后置于冷的 1.5 mL离心管中, 立即取20 μL用FISKE 210型冰点渗透压计测定渗透压。渗透压用渗透浓度(即溶解颗粒数表示的浓度)来表示, 单位为mmol/kg。
1.5 鳃丝Na+/K+-ATP酶活性的测定
酶液的制备: 取鱼两侧鳃丝, 用预冷蒸馏水(0~4℃)洗净、滤纸吸干后置于10 mL冰冷酶提取液(0.25 mmol/L蔗糖, 6 mmol/LEDTA-Na2, 10 mmol/L tris, 0.1%脱氧胆酸钠, pH为7.5)中, 用高速匀浆器在冰水浴中以20 000 r/min转速匀浆5 min, 匀浆液在高速冷冻离心机(0~1℃, 10 000 r/min)中离心30 min,取上清液再离心 10 min, 将所得上清液冷藏(0~2℃)保存, 在8 h内测定Na+/K+-ATP酶活力。
酶蛋白含量采用考马斯亮蓝法测定。Na+/K+-ATP酶活力测定参考Whealty等[8]的方法, 通过测定全酶反应体系和Na+/K+-ATP酶活力被抑制反应体系中底物 ATP-Na2释放出无机磷(Pi)量的差值来计算,酶活力单位采用mmol/(g·h)表示。
1.6 数据处理与分析
所得数据用统计软件SPSS13.0进行分析, 不同处理组间使用单因素方差分析和Duncan多重比较进行分析, 以P<0. 05作为差异显著性水平。

表1 饲料的含能量及营养组成Tab. 1 Energy content and composition of the experimental diet
2 结果
2.1 不同盐度下半滑舌鳎血液的渗透压变动
盐度对半滑舌鳎血液渗透压的影响情况见图 1,盐度突变对半滑舌鳎的血液渗透压有显著影响(P<0.05)。盐度变化后, 高盐处理组下半滑舌鳎血液渗透压显著升高, 低盐处理组的则明显降低, 且变化幅度随盐度突变范围的增大而增大, 在6 d内有峰值变化, 峰值出现在2 d左右。6 d后各处理组半滑舌鳎血液渗透压趋于稳定。实验结束时, 不同盐度下半滑舌鳎血浆渗透压数值呈现出 3个不同的水平,即盐度35和40, 20和30以及0和10, 其数值相互之间差异显著(P<0.05), 盐度为35和40时其酶活性最高, 盐度为0和10时其酶活性最低。
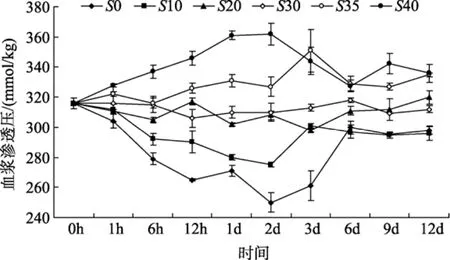
图1 盐度对半滑舌鳎血液渗透压的影响Fig. 1 The effect of salinity on the plasma osmotic pressure ofCynoglossus.semiliaevis
2.2 不同盐度下半滑舌鳎鳃丝Na+/K+-ATP酶的活性变动
由图 2可见, 盐度对半滑舌鳎鳃丝 Na+/K+-ATP酶活性有显著影响(P<0.05), 鳃丝 Na+/K+-ATP酶活性随盐度的升高和降低而相应的升高和降低, 且变化幅度总体上随盐度变化范围的增大而增大。盐度突变9 d内, 各处理组鳃丝Na+/K+-ATP酶活性出现峰值变化, 且高盐处理组和低盐处理组的鳃丝Na+/K+-ATP酶活性在6 d左右时分别出现最大值和最小值, 在9 d之后各处理组半滑舌鳎鳃丝Na+/K+-ATP酶活性趋于稳定。实验结束时, 不同盐度下半滑舌鳎鳃丝Na+/K+-ATP酶活性也呈现出3个不同的水平, 即盐度35和40, 10、20和30以及0, 其数值相互之间差异显著(P<0.05), 盐度为35和40时其酶活性最高, 盐度为0时其酶活性则最低。
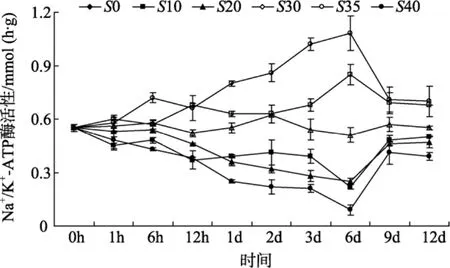
图2 盐度对半滑舌鳎鳃丝Na+/ K+-ATP酶活性的影响Fig. 2 The effect of salinity on gill Na+/ K+-ATPase activity ofCynoglossus semiliaevis
3 讨论
3.1 盐度对半滑舌鳎血液渗透压的影响
为了维持体液离子浓度和渗透压平衡, 鱼类形成了较高级的渗透压调节机制, 渗透压调节主要由鳃、肾和肠对离子和水的转运来完成。在低盐度水体中, 环境渗透压低于鱼体的体液渗透压, 鱼会被动吸收过多的水分并丢失离子, 此时鱼类通过排出低渗尿和增加鳃对离子的摄入来维持体液渗透平衡。而在高盐度水体中, 环境渗透压高于体液渗透压,鱼会通过体表和鳃被动丢失水分, 此时鱼会通过吞食高盐水, 在保存水分的同时, 由鳃排除被动摄入的过多 Na+和 Cl-离子, 肾排除 Mg2+、SO42-、Ca2+离子和少量水分, 从而维持体液的渗透平衡[6,9-10]。在鱼类对盐度的适应过程中, 一般分为两个阶段:一是盐度变化后短期内, 鱼类的血浆渗透压与盐度正相关地迅速升高或降低, 这一变化随即刺激鱼体渗透调节生理机制的改变; 二是渗透压向变化前状态的恢复的过程。但鱼类渗透压变化的程度和恢复所需要的时间受种间差异、盐度变化范围的大小以等多种因素的影响差异较大。如墨西哥湾鲟(Acipenser oxyrinchus)[11], 由淡水向盐度25突变后24 h即开始渗透压的恢复, 96 h后基本达到稳定状态; 将黑棘鲷(Acanthopasgrus butcheri)[12]由盐度 36变化至 12、24、48、60后3个月, 盐度12、24、48组即处于稳定状态, 而盐度为6处理组在6个月时才恢复。而褐牙鲆幼鱼由盐度30向24、18、12、6适应时, 6 d后血浆渗透压达到稳定状态[2]。本实验结果则显示, 盐度突变后2 d内, 半滑舌鳎血液渗透压随盐度的升高和降低而迅速的相应升高和降低, 这可能是其对水环境盐度的被动适应, 之后鱼体自身生理机制的作用下,血液渗透压逐渐恢复, 到6 d左右时则趋于稳定。这一结果说明半滑舌鳎对盐度有较强的适应能力, 在很大范围的盐度突变后仍能调节机体适应外界水环境。
真骨鱼类能够调节体内液体环境的离子浓度使之维持在一个很小的范围内[13], 广盐性鱼类在这方面表现得尤为明显。通常不同种类对内环境渗透压变化范围的要求略有不同, 但普遍符合血浆渗透压与盐度之间呈正相关这一关系[11-14]。本研究结果与这一规律基本相似, 半滑舌鳎血浆渗透压最终数值呈现出3个不同的水平, 即盐度35和40、20和30以及 0和 10。这一结果表明, 尽管半滑舌鳎可以通过机体对血液渗透压的调节来适应外界环境的较大范围的盐度变化, 但其最终的调节程度还是与环境盐度的变化范围直接相关的。
3.2 盐度对半滑舌鳎鳃丝 Na+/K+-ATP酶活性的影响
鳃是鱼类渗透调节和离子运输的主要器官, 鳃上皮的泌氯细胞中含有大量Na+/K+-ATP酶, 该酶的含量和活力一般随环境盐度变化而发生变化[15-16]。无论是淡水鱼还是海水鱼, Na+/K+-ATP酶都是其氯细胞离子转运的关键酶[3]。在环境盐度发生变化时,鱼类鳃丝Na+/K+-ATP酶活力会升高或降低[3-5], 这种变化与鳃氯细胞的变化以及Na+/K+-ATP酶的分泌活动密切相关, 是鳃对体内外 Na+和 Cl-等离子运输需要的适应[3-4,10,17]。本研究结果表明, 半滑舌鳎鳃丝Na+/K+-ATP酶活性也随盐度的变动而相应的升高和降低, 且其升降程度随盐度变化范围的直接相关。盐度突变9 d内, 各处理组鳃丝Na+/K+-ATP酶活性出现峰值变化, 且高盐处理组和低盐处理组的鳃丝Na+/K+-ATP酶活性在6 d左右时分别出现最大值和最小值, 在 9 d之后各处理组半滑舌鳎鳃丝Na+/K+-ATP酶活性趋于稳定。从时间进程上看, 半滑舌鳎鳃丝Na+/K+-ATP酶活性的变化滞后于血浆渗透压的变化。这可能由于半滑舌鳎的渗透调节并不完全是由鳃丝Na+/K+-ATP酶来完成的, 可能还有其他器官对渗透压进行调节。另外, 本研究结果发现,半滑舌鳎鳃丝Na+/K+-ATP酶活性稳定后基本与环境中盐度水平呈正相关, 但呈现出3个不同的水平, 即盐度35和40, 10、20和30以及0, 其数值相互之间差异显著(P<0.05)。其中, 以盐度 35和 40下Na+/K+-ATP酶活性最高, 盐度 0下则为最低, 这一点与褐牙鲆的相关研究不同[2]。褐牙鲆幼鱼在适应相应的盐度后, 其鳃丝Na+-K+-ATP酶活力在高渗环境中与外界盐度大小呈正比, 但在低渗环境中与盐度却呈反比。这一现象的出现可能与不同鱼类的渗透调节能力和调节方式有着不同甚至是很大的种间差异有关, 具体机制则尚待进一步深入研究。
3.3 广盐性鱼类对环境盐度的适应机制
当水环境中盐度升高时, 鱼类面临的主要问题是如何将吞饮海水而吸收的过多盐分排除体外。此时广盐性鱼类对低渗环境的渗透压调节机制被抑制,而对高渗环境的渗透压调节机制被激活。广盐性鱼类进入高渗环境后, 其大量吞饮海水所吸收的 Na+和 Cl-主要通过鳃上皮的氯细胞排出体外, 以维持体内外离子和渗透压平衡。此时氯细胞发生一系列的细胞学变化, 如细胞数量增多, 直径增大, 线粒体数量增加等, 同时, 也包括某些蛋白质种类的合成, 其中最重要的便是Na+/K+-ATP酶。随着水环境中盐度的增加, 伴有 Na+/K+-ATP酶活性的增加, 从而为广盐性鱼类体内大量 Na+和 Cl-的排出提供所需的能量。另外, 广盐性鱼类在海水中对 Na+和 Cl-的外排还受激素的调控。血浆中皮质醇可能是鱼类对海水适应的调节剂, 它可以增加鳃 Na+的转运和Na+/K+-ATP酶的活性[6]。
相反, 当水环境中盐度降低时, 广盐性鱼类对高渗环境的渗透压调节机制受到抑制, 而对低渗环境的调节机制则被激活, 从而维持体内的较高的渗透压。当广盐性鱼类进入低渗环境后, Ca2+、Mg2+、SO42-等的排出迅速减少。同时, 鳃上皮排出的 Na+和Cl-亦迅速下降到较低水平。鱼体的这些反应可能是由某些机体调节机理影响氯细胞排出NaCl所致。同时, 某些激素, 如生长激素能通过提高Na+/K+-ATP酶的活性和泌氯细胞的数目, 抑制血浆渗透压和离子浓度的提高, 从而帮助鱼类适应海水环境[18-19]; 而催乳激素对鱼类适应低盐度环境起关键作用, 它可以抑制 Na+的排出和 Na+/K+-ATP酶的活性[20]。Persson等[21]研究了成熟的大西洋鲑从海洋到江河产卵洄游过程中各阶段的渗透压调节状况,发现河口捕获的鲑鱼鳃丝 Na+/K+-ATP酶活性不高,表明该鱼已经适应了低渗环境, 而在河上游捕获的鲑鱼鳃丝Na+/K+-ATP酶活性则更低, 表明鲑鱼在淡水中鳃丝渗透调节能力已经受到抑制。本研究结果表明, 半滑舌鳎通过机体的一系列生理调节后, 可以很好适应较高盐度(40)和较低盐度(0), 是一种典型的广盐性鱼类。不过, 由于本研究盐度设置所限,关于半滑舌鳎对高盐度耐受的上限尚待进一步研究。
[1] Gaumet F, Boeuf G, Severe A,et al. Effects of salinity of the ionic balance and growth of juvenile turbot[J]. J Fish Biol, 1995, 47: 865-876.
[2] 潘鲁青, 唐贤明, 刘泓宇, 等. 盐度对褐牙鲆(Paralichthys olivaceus)幼鱼血浆渗透压和鳃丝Na+-K+-ATPase活力的影响[J]. 海洋与湖沼, 2006,37(1): 1-5.
[3] McKenzie D J, Cataldi E, Di M. Some aspects of osmotic and ionic regulation in Adriatic sturgeonAcipenser naccarii: II. Morphophysiological adjustments to hyperosmotic environments[J]. J Appl Ichtyol,1999, 15: 61-66.
[4] Mancera J M, McCormic S D. Rapid activation of gill Na+, K+-ATPase in the euryhaline teleostFundulus heteroclitus[J]. J Exp Zool, 2000, 287: 263-274.
[5] Tipsmark C K, Madsem S S, Seidelin M. Dynamics of Na+, K+, 2 Cl-cotransporter and Na+, K+-ATPasee expression in the branchial epithelium of brown trout(Salmo trotta) and Atlantic salmon (Salmo salar)[J]. J Exp Zool, 2002, 293: 106-118.
[6] 陈惠群, 王国良. 硬骨鱼类的渗透压调节[J]. 海洋科学, 2002, 26(l): 24-26.
[7] 李思忠, 王惠民. 中国动物志[M]. 北京: 科学出版社, 1995: 94-98.
[8] Whealty M G, Hentry R P. Branchial and antennal Na+/K+-dependent ATPase and carbonie anhydrase activity during salinity acclimation of the euryhaline crayfishPacifastacus Ieniuscndus[J]. Exp Biol, 1987, 133:73-86.
[9] Wood C M, Shuttle worth T J. Cellular and Molecular A Proaches to Fish lonic Regulation [M]. New York:Academic Press, 1995: 285-315.
[10] Cataldi E, Ciccotti E, Di Marco P. Acclimation trials ofjuvenile Italian sturgeon to different salinities: morphophysiological descriptors[J]. J Fish Biol, 1995, 47:609-618.
[11] Ilhan A, Sara M G, Frank A. ·Ionic and osmotic regulation capabilities of juvenile Gulf of Mexico sturgeon,Acipenser oxyriinchusde sotoi[J]. Comp Bio and Physiology(Part A), 1998, 120: 609-616.
[12] Gavin J P, Greg I J. The effect of salinity on growth and survival of juvenile black bream(Acanthopasgrus butcheri)[J]. Aquaculture, 2002, 210: 219-230.
[13] Van der L A, Vanaudenhove M, Verhoye M. Osmoregulation of the common carp (Cyprinus carpio) when exposed to an osmotic challenge assessed in vivo and noninvasively by diffusion-and T2-weighted magnetic resonance imaging[J]. Comparative Biochemistry and Physiology(Part A), 2002, 124: 343-352.
[14] Handeland S O, Bjornsson B T, Arnesen A M. Seawater adaptation and growth of post-smolt Atlantic salmon(Salmo salar) of wild and farmed strains[J]. Aquaculture, 2003, 220: 367-384.
[15] Karnaky K J, Kinter L B, Kinter W B,et al.Teleost chloride cell II. AutoradiograPhic localization of gill Na+, K+-ATPase in killi fish Fundulus heteroclitus adapted to low and high salinity environments[J]. J Cell Biol, 1976, 70: 157-177.
[16] Evans D H. The Physiology of Fishes[M]. Boca Raton :CRC Press, 1993: 315-341.
[17] Potts W T, Rudy P P. Aspects of osmotic and ionic regulation in the sturgeon[J]. J Exp Biol, 1972, 56:713-715.
[18] Seddiki H V, Maxime V, Maxime. Effects of growth hormone treatment on oxygen consumption and seawater adaptability in Atlantic salmon parr and pre-smolts[J]. Aquaculture, 1996, 148: 49-62.
[19] Mauchline, T and T. Nemoto eds. Marine Biology its Accompolishment and Future Prospect [M]. Amsterdam:Elsevier, 1991: 3-14.
[20] Young G, Bjoemsson B T, et al. Smoltification and seawater adaptation in coho salmon (Oncorhynuchus kistuch): plasma prolation, growth hormone, thyroid homnones, and cortisol[J]. Gen Comp Endocrinol, 1989,74(3): 335-345.
[21] Persson P, Sundell K. Calcium metabolism and osmoregulation during sexual maturation of river running Atlantic salmon[J]. J Fish Biol, 1998, 52(2): 334-349.
Received: Mar., 23, 2010
Key words:Cynoglossus semilaevis; salinity; plasma osmolality; gill Na+/K+-ATPase activity
Abstract:Changes in plasma osmolality and gill Na+/K+-ATPase activity of the juvenile tongue sole (Cynoglossus semilaevis) were studied by abruptly shifting the of salinity from 30 to 0, 10, 20, 35 or 40. The results showed that the effects of the salinity on plasma osmolality and activity of gill Na+/K+-ATPase of the fish were significant(P<0.05). The peak values of plasma osmolality appeared on day 2 after the changes of salinity, and the plasma osmolality in each group was stablized on day 6. The similar trends were observed in the changes of gill Na+/K+-ATPase activity. The peak values of gill Na+/K+-ATPase activity appeared on day 6 after the changes of salinity, and was dimished gradually to the stable leve1 at day 9. The results of this study indicated that the tongue sole might have a great capability of acclimation to different salinities.
(本文编辑:谭雪静)
Effects of salinity on plasma osmolality and gill Na+/K+-ATPase activity of the tongue Sole (Cynoglossus semilaevis)
TIAN Xiang-li1,2, WANG Guo-dong1, DONG Shuang-lin1, FANG Jing-hui1,LIU Ying1
(1. Key Laboratory of Mariculture, Ministry of Education, Ocean University of China, Qingdao 266003, China;2. Panjin Guanghe Fisheries Company Ltd., Panjin 124200, China)
S965.215
A
1000-3096(2011)02-0027-05
2010-03-23;
2010-05-24
国家“十一五”科技支撑计划课题项目(2006BAD09A01);国家 863计划项目(2006AA10Z409); 山东省优秀中青年科学家科研奖励基金项目(2005BS07004); 新世纪优秀人才支持计划项目(NCET-08-0503)
田相利(1971-), 男, 内蒙古赤峰人, 副教授, 主要从事养
殖生态学研究, E-mail: xianglitian@ouc.edu.cn
——2017年渗透压相关高考真题赏析

