多层螺旋CT 薄层扫描对活动性肺结核的诊断价值
赵广成 张健 何燕
活动性肺结核的诊断依赖于痰抗酸杆菌检测及系列X线胸片的改变或抗结核化疗的疗效表现。但抗酸杆菌仅在20%~55%的活动性肺结核患者痰中发现;而结核的支气管内播散仅见于20%继发性肺结核患者的X线胸片中[1],且发现这种X线胸片多数常被归类为不确定;因此,结核活动性的诊断常常很困难。常规CT虽能显示较明显的影像改变,但对细微改变显示欠佳,当据此判定病变是否具有活动性时,常令观察医生处于两难境地。
笔者总结了山东省滨州市结核病防治院200例活动性肺结核患者行多层螺旋CT薄层扫描的资料,旨在揭示肺结核治疗前后薄层CT征象及其基本的病理基础,从而评价薄层CT检查在活动性肺结核诊断中的作用。
资料和方法
一、一般资料
从2007年初到2009年底,本院门诊可疑活动性肺结核患者650例,均行多层螺旋CT检查;经筛选,资料完整患者总计200例,均行薄层扫描,其中男128例,女 72例;年龄范围 16~73岁(平均36岁)。按其为初发或复发分为2组:第1组初诊肺结核132例,此前无结核病史,有其最后(至该研究前5 d至3周)活动性肺结核的影像学和实验室检查结果;第2组可疑复发肺结核68例,之前已接受抗结核药物治疗9个月至6年(平均2年)。痰抗酸杆菌检出(150例),包括痰涂片确定(92例)或痰培养确定(58例);其中114例为初诊肺结核患者,36例为接受过治疗的患者;胸部影像(X线片或CT)征象显示肺部病变依疗程而范围明显缩小和(或)密度明显减淡,边界渐清晰,病灶大部可吸收,其中病灶完全吸收50例,32例为初诊患者,18例为复发患者。
活动性肺结核的诊断依据[2]:(1)痰找抗酸杆菌包括痰涂片和痰培养;(2)胸部影像(X线片或CT)征象及抗结核治疗期间病变的系列变化。
二、检查方法和判读标准
所有200例临床拟诊肺结核患者在诊断后(132例)3周内及怀疑复发(68例)2周内用CT扫描仪(型号Somatom Emotion16)先行常规胸部CT扫描(层厚、层距均为5 mm,137 kVp,125 mA,扫描时间0.7 s,矩阵512×512,标准算法);视野35 cm×35 cm,范围从肺尖至肺底。而后视胸廓大小以18 cm×18 cm~21 cm×21cm的视野在病变区再行薄层CT(1.5 mm准直,1~3 mm层距,137 kVp,195 mA,扫描时间0.7 s,矩阵512×512)回顾性靶扫描。
本组所有患者常规胸部CT扫描及薄层CT扫描均不使用对比剂。
三、解释薄层CT征象的主要术语[3]
(1)小叶中心结节或线状结构:严格限于厚约2~4 mm,并距离胸膜面或叶间隔大于2 mm的病变;(2)“树芽”状结构:多于1个连续分枝点的分枝状线性结构;(3)不确定结节:直径5~8 mm的性质难确定结节。
四、统计学方法
采用 Excel整理数据,SPSS18.0统计软件分析,运用 χ2检验对数据进行统计学检验,P<0.05为有统计学意义。
结 果
一、初次接受抗结核化疗患者的薄层CT征象检出率
患者在诊断之初呈现的CT征象摘要如表1。
132例初次诊断的活动性肺结核中,128例为支气管源性播散;其薄层CT征象中按检出率高低分类:(1)检出率较高(≥70%)者依次为:小叶中心结节或分枝状线性结构(95.5%)、斑片状(77.3%)、支气管壁增厚(72.7%)及空洞性改变(69.7%)(图1)。平均检出率为78.8%;(2)检出率较低(<50%)者依次为:叶间裂增厚(30.3%)、肺气肿(27.3%)、支气管血管扭曲(21.2%)、纤维带(21.2%)、磨玻璃样改变(4.5%),其平均检出率为20.9%;(3)检出率介于50%~70%者分别为:直径5~8 mm的不确定结节(66.7%)、小叶实变(50.0%)及支气管扩张(50.0%),其平均检出率为55.6%(表1)。另4例粟粒性肺结核患者薄层扫描,见多个不连续粟粒样结节弥漫分布于全肺,结节大小相同。
二、复发肺结核患者各种薄层CT征象的检出率
68例可疑复发肺结核患者中:(1)检出率≥70%的薄层CT征象依次为:小叶中心结节或分枝样线性病变(88.2%)、斑片状表现(73.5%),显然,这些征象与伴发的其他部位纤维钙化截然不同,在≥74%的复发肺结核患者中呈现,可作为复发依据。其平均检出率为80.9%;(2)检出率≤50%的征象依次为:肺气肿(50.0%)、空洞性改变(41.2%)、直径5~8 mm的不确定结节(41.2%)、叶间裂增厚(17.6%)、小叶实变(11.8%)及磨玻璃样改变(2.9%)。其平均检出率为20.9%;(3)检出率介于50%~70%的薄层CT征象分别为:支气管壁增厚(64.7%)、支气管扩张(61.8%)、支气管血管扭曲(61.8%)及纤维带(61.8%)。其平均检出率为62.5%(表 1)。
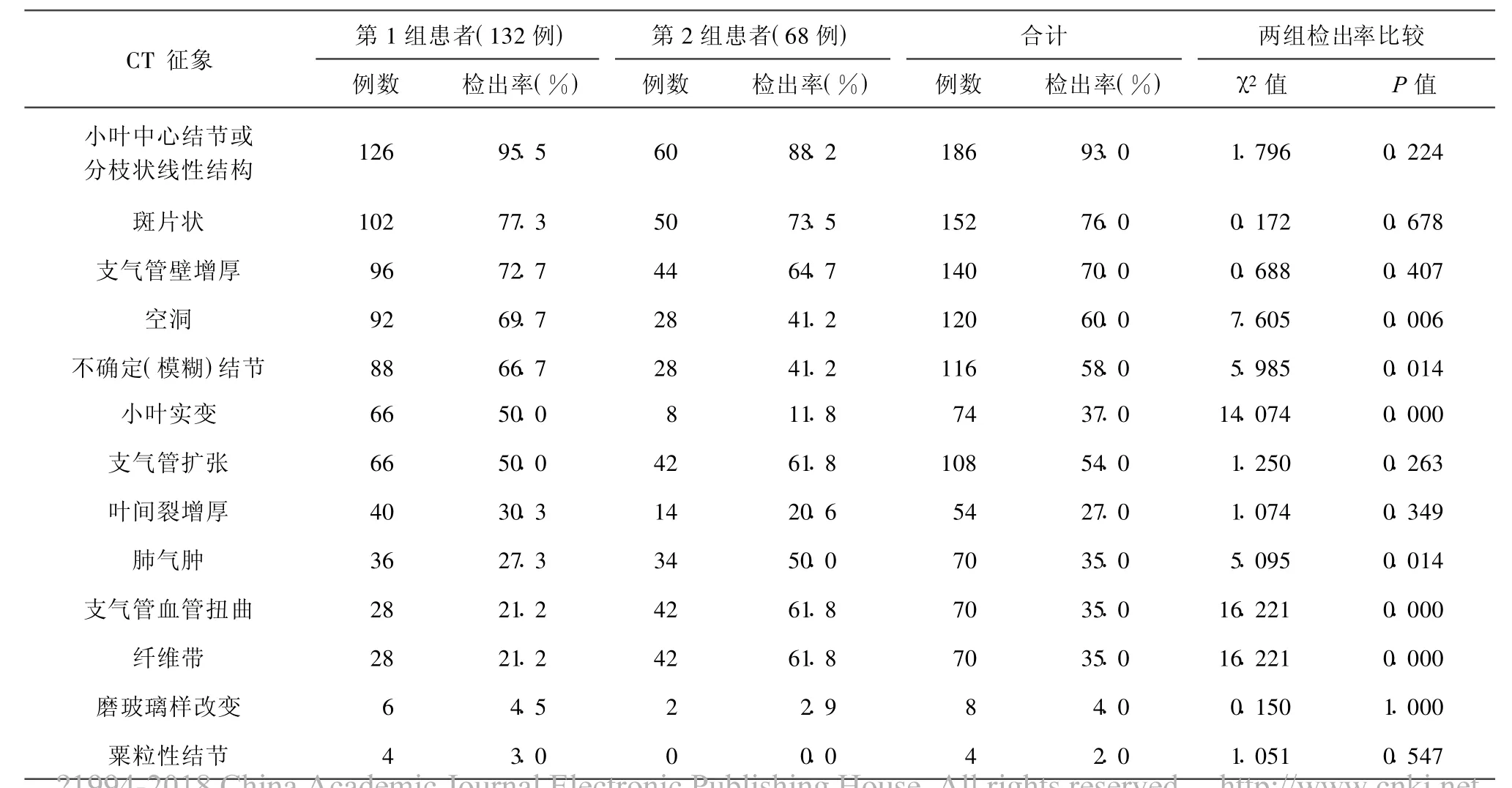
表1 各种薄层CT征象在两组患者中的检出率
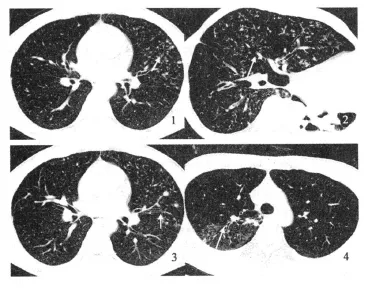
图1 薄层CT扫描结果
讨 论
一、特异性薄层CT征象及其病理基础
(一)小叶中心病变、斑片状表现与支气管壁增厚
在继发性或再感染性肺结核中,支气管源性播散是最常见的结核播散方式;其前提是支气管壁坏死及干酪样物质的软化、液化坏死;其中,干酪样物质在多数病变中非常黏滞,以致不易流入支气管腔,在病理上,小叶中心结节为细支气管和其周围肺泡炎的改变,分枝状结构为干酪样物质占据了细支气管和肺泡管[4]。尽管其体积小,但这种病变边界清楚,相对高密度;这些小叶中心病变由位于终末或呼吸细支气管内及其周围的实质性干酪样物质组成;而斑片状结构终端丛可代表细支气管和肺泡管内的病变。
第1组128例初诊肺结核的薄层CT征象中检出率最高(≥70%)者为:小叶中心结节或分枝样线性结构(95.5%)、斑片状(77.3%)与支气管壁增厚72.7%)。其中,小叶中心结节或分枝样线性结构出现于几乎所有的本组患者中,仅4例粟粒性结核例外。第2组68例可疑复发肺结核的患者中,小叶中心结节或分枝样线性结构(88.2%)、斑片状(73.5%)与支气管壁增厚(64.7%)的检出率虽与第1组中的检出率相比稍低,但在第2组中仍然为最高的检出率。上述薄层扫描CT征象两组间不同检出率相比差异无统计学意义(P值均>0.05),提示无论在初诊抑或复发肺结核中其出现有一定必然性,或称特异(征)性。
Itoh等[5]曾观察到,在多数腺泡结节结核患者中,先是源于外围细支气管而与腺泡无直接关系的小结节增长,融合为直径几乎与肺泡相等的大结节,其后才通过孔氏孔扩展;而最先由Aschoff[6]提出的结核支气管源性播散的典型影像学表现中,则把由结核炎性渗出或肉芽肿形成的单个腺泡实变描述为“肺泡结节“病变。本研究在2个方面支持Itoh等的观察:(1)界限不清的结节常位于次级肺小叶的中央部分;(2)小叶实变区内的空腔出现于小叶中央。据此,笔者认为这些征象提示最初的病变是在细支气管腔及周围区域,病理上应由位于终末或呼吸细支气管内及周围的实质性干酪样物质组成,与充填小支气管的干酪样物及合并干酪坏死的小叶中心气腔实变相对应;之后,若病变进一步发展融合为较大模糊结节,才可如Aschoff[6]称谓的由孔氏孔扩展。
(二)空洞
空洞形成于干酪化坏死物质液化并通过连接气道排空之时,且多开始于小叶中央;几个小空洞可融合成较大的空洞;洞壁可从光滑、薄壁到结节状、厚壁。薄层CT扫描能显示X线胸片上看不到或常规CT难以清晰显示的实变区的小空洞。本研究中,初诊患者薄层CT扫描中小空洞检出率较高(69.7%),而在复发患者中检出率较低(41.2%)。2组间检出率相比,差异有统计意义学(P<0.05)。表明尽管小空洞出现是表明初诊肺结核病变活动性的重要迹象,然而在复发肺结核中其特异(征)性减低。
二、非特异性薄层CT征象的影像分析
初诊与复发肺结核患者其他非特异性薄层CT征象,根据检出率高低其重要性(特异性)也依次减低。(1)在初诊肺结核与可疑复发肺结核患者2组薄层CT征象中,直径5~8 mm的不确定(模糊)结节(66.7%与41.2%)、支气管扩张(50.0%与61.8%)及小叶实变(50.0%与11.8%)的检出率都较高:但不是最高,单一(组)征象应不具诊断意义。(2)与初诊肺结核患者组薄层CT征象中支气管血管扭曲(21.2%)、纤维带(21.2%)和肺气肿(27.3%)较不常见相比,可疑复发肺结核患者组薄层CT征象中支气管血管扭曲(61.8%)、纤维带(61.8%)和肺气肿(50.0%)则更为常见。(3)初诊与复发2组薄层CT征象间的差异在小叶实变(P=0.000)、支气管血管扭曲(P=0.000)、纤维带(P=0.000)及不确定(模糊)结节(P=0.014)等薄层CT征象中差异有显著统计学意义,表明其在复发肺结核中较具诊断意义。
三、多层螺旋CT薄层扫描对活动性肺结核诊断的适应证及其局限性
(一)适应证
X线胸片发现病灶,但不能确定肺结核是否有活动性;抗酸杆菌阴性,临床症状明显,常规CT虽能显示较明显的影像改变,但对细微改变显示欠佳,当据此判定病变是否具有活动性非常困难。多层螺旋CT薄层扫描征象较特异,如支气管壁增厚及小空洞形成共同判读并结合临床资料,将有助于活动性肺结核的诊断。
(二)局限性
扫描方法仅适于高精度多层螺旋CT;小叶中心结节或分枝线样结构仅适用于肺结核播散某一方式(经支气管源)或特定阶段(早期或复发)的诊断或鉴别诊断。在另外一些情况下,凭借 X线胸片和(或)常规CT扫描,当发现肺结核播散或复发的经典影像学征象即可明确诊断为活动或复发。
总之,在诸种肺结核薄层CT征象中,线状、直径2~4 mm的结节状或树芽状小叶中心病变是新的播散性或复发性肺结核患者最常见和具最特异性的影像学征象,多层螺旋CT薄层扫描对活动性肺结核具有可靠的诊断价值。
多层螺旋CT薄层扫描可提供不能见于X线胸片和不能清晰显示于常规CT的活动性肺结核的有价值的影像信息;即使在怀疑疾病为继发性肺结核的患者中也是如此。若进一步与其他较高检出率的薄层CT的征象及临床资料密切结合,则无疑有助于提高活动性肺结核的诊断水平。
[1] Woodring JH,Vandiviere HM,F ried AM,et al.Update:the radiog raphic features of pulmonary tuberculosis.AJR Am J Roentgenol,1986,146(3):497-506.
[2] 曹全明,王晓博.肺结核并存肺癌的影像诊断分析.内蒙古医学院学报,2006,28(6):19-20.
[3] Murata K,Itoh H,Todo G,et al.Centrilobular lesions of the lung:demonstration by high-resolution CT and patologic correlation.Radiology,1986,161(3):641-645.
[4] Heitzman ER.T he Lung:radiologic-pathologic correlations.St Louis:Mobsy,1984:4-9.
[5] Itoh H,Tokunaga S,Asamoto H,et al.Radiologic-pathologic correlations of small lung nodules with special reference to peribronchial nodules.AJR Am J Roentgenol,1978,130(2):223-231.
[6] Aschoff L.Lectures on Pathology. New York:Hoeber,1964:53-57.
[7] Giron J,Lavayssiere J,Fajadet P,et al.High resolution chest CT in tuberculosis:evolutive patterns and sighs of activity.J Comput Assist T omogr,1997,21(4):601-607.
[8] Parks S,Hong YK,Joo SH,et al.CT findings of pulmonary tuberculosis presenting as segmental consolidation.Comput Assist Tomogr,1999,23(5):736-742.
[9] 王成勇,李益荣.3479例肺结核病人痰标本抗酸杆菌检查结果分析.临床肺科杂志,2004,9(6):43-44.

