应用基因芯片方法检测结核分枝杆菌利福平和异烟肼的耐药性
张俊仙 吴雪琼 阳幼荣 梁艳
众所周知,耐多药结核病已经严重影响了全球结核病的控制和治疗。耐多药结核病是指结核患者至少对利福平和异烟肼2种最主要的一线抗结核药物耐受。然而,由于结核分枝杆菌(Mycobacteriu m tuberculosis,Mtb)是慢生长分枝杆菌,常规的药敏试验需4~8周的时间,因此结核患者通常不能得到及时、有效的治疗,导致耐多药结核患者结核菌的增殖和传播。因此,需要建立一种操作简便、快速的药物敏感性试验方法,这对于控制耐多药结核病的传播具有重要的意义。
近年来出现很多耐药性检测的新方法,如PCR-单链构象多态性(PCR-Single Strand Conformation Polymorphism,PCR-SSCP)、PCR-限制性片段长度多态性(PCR-restrition fragment length polymophism,PCR-RFLP)、DNA 测序法、分子灯塔法、噬菌体生物扩增法等,都因为各种各样的问题难以在临床上广泛推广。笔者应用PCR-基因芯片和基因测序方法对30株利福平和异烟肼敏感株和50株利福平和异烟肼耐药株进行检测,以期为耐多药结核病的检测提供简单、快速、有效的方法。
材料与方法
一、菌株来源
80株Mtb临床分离株由本室保存,已按全国结核病细菌学检验标准化规程进行菌种鉴定证实为Mtb,并根据传统药敏试验结果选择30株利福平和异烟肼敏感株、50株耐利福平和异烟肼分离株。Mtb标准株H37Rv来自中国药品生物制品检定所。
二、试剂和仪器
Mtb耐药检测试剂盒(芯片法)购自北京百奥瑞生物技术有限公司。PCR扩增仪和 LuxScan 10K-B微阵列芯片扫描仪等均为博奥生物有限公司提供。
三、细菌DNA的制备
采用本室自制的标本前处理试剂盒提取DNA,置-20℃保存备用[1]。
四、PCR扩增
按试剂盒说明书进行。每管PCR反应体系总体积为20 μ l,其中 Mtb分离株 DNA 模板为2 μ l,PCR扩增试剂1、PCR扩增试剂2和PCR扩增试剂3各 18 μ l。PCR产物1为对照产物,与两种微阵列都进行杂交。PCR产物2为rpoB基因的扩增产物,与利福平微阵列相对应;PCR产物3为katG基因及inhA基因启动子的扩增产物,与异烟肼微阵列相对应。PCR扩增程序为:37℃600 s,94℃600 s;94℃30 s,60℃30 s,72℃40 s,35个循环;然后94℃30 s,72℃60 s,10个循环;最后置 72℃420 s。
五、基因芯片
检测探针和对照探针各重复5个点,每行1~5和6~10分别为同一个探针,利福平相关rpoB基因的探针排布示意见表1。异烟肼相关katG基因和inhA基因启动子的探针排布示意见表2。
六、芯片杂交和结果判读
根据试剂盒说明书进行操作。简而言之,每管含杂交缓冲液9 μ l,分别加入同一样品的PCR产物1和 PCR产物2各 3 μ l,或者加入 PCR产物 1和PCR产物3各3 μ l。置于PCR扩增仪中于95℃变性5 min,然后冰浴 3 min;将13.5μ l杂交反应混合物经盖片的加样孔加入,迅速盖上杂交盒并密封;放入50℃预热的恒温水浴锅中120 min;水平取出杂交盒,拆开取出芯片,洗涤后离心甩干。置LuxScan 10K-B微阵列芯片扫描仪中读取信号、判读结果。

表1 利福平相关rpoB基因的探针排布
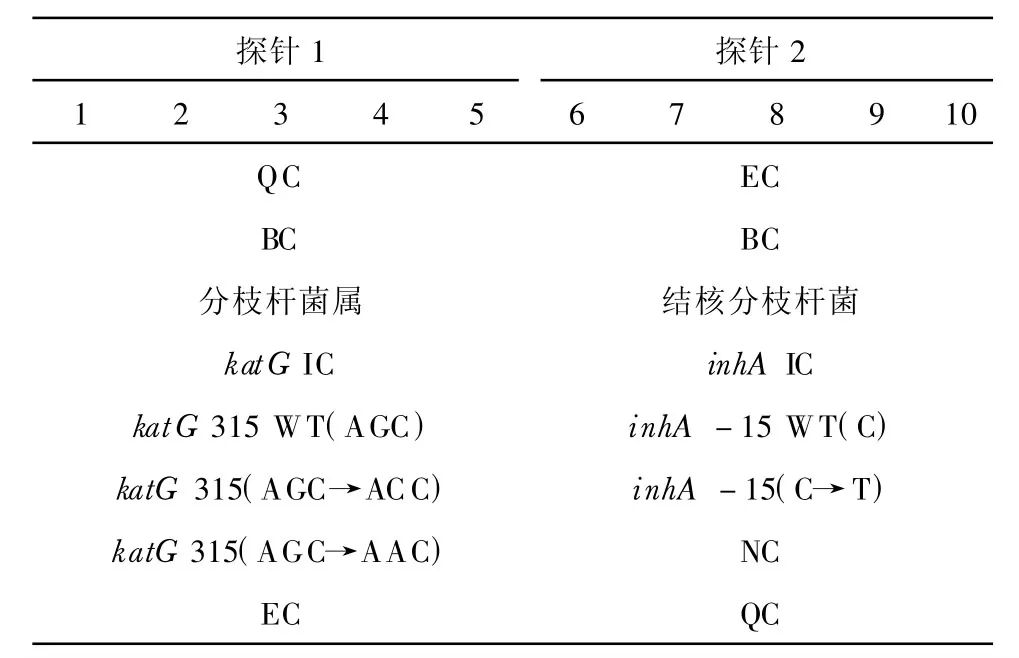
表2 异烟肼相关katG基因和inhA基因启动子的探针排布
七、PCR-直接测序法
根据Mtb序列,用软件Oligo 6.0设计利福平上下游测序引物rpoB3、rpoB4,可扩增rpoB基因产生240 bp片段,其中包括507~533位密码子之间81 bp热点区间的序列。设计异烟肼上下游测序引物 katG 1、katG2和 inhA1、inhA2,可分别扩增katG基因和inhA基因产生273 bp和255 bp片段,分别包括常见的katG基因315位密码子和inhA基因启动子-15位突变。扩增产物经2%琼脂糖电泳,均为阳性,说明没有基因缺失。扩增产物送上海生工生物工程公司进行基因测序。
结 果
一、芯片杂交结果
PCR-芯片杂交结果见表3。30株Mtb利福平敏感株rpoB基因、异烟肼敏感株katG基因和inhA基因芯片杂交结果与Mtb标准株结果一致,均为Mtb野生型。
50株Mtb耐利福平分离株中,7株芯片杂交为野生型;42株有单位点突变,1株有双位点突变。以80株Mtb临床分离株药敏检测结果为判断标准,芯片检测的灵敏度、特异度、阳性预测值、阴性预测值、准确率分别是 86.00%(43/50)、100.00%(30/30)、100.00%(43/43)、81.08%(30/37)、91.25%(73/80)。43株耐药突变株中,28株(65.12%)为 rpoB基因 531位突变,其中 26株TCG→T TG突变,2株 TCG→TGG突变;6株(13.95%)为526位突变,其中4株CAC→TAC突变,1株CAC→CGC突变,1株CAC→GAC突变;4株(9.30%)516位突变,2株GAC→GTC突变,2株GAC→TAC突变;3株(6.97%)511位突变,均为CTG→CCG突变;1株(2.33%)513位CAA→AAA突变;1株(2.33%)双位点突变为 511位CTG→CCG和516位GAC→GGC突变。部分芯片杂交结果见图1。

表3 50株利福平和异烟肼耐药株PCR-基因芯片检测与基因测序结果

图1 Mtb利福平rpoB基因部分芯片杂交图
50株Mtb异烟肼耐药株中,14株芯片杂交均为野生型,36株有katG和/或inhA突变,芯片检测的灵敏度、特异度、阳性预测值、阴性预测值、准确率分别.72.00%(36/50)、100.00%(30/30)、100.00%(36/36)、68.18%(30/44)、82.50%(66/80)。31株芯片检测有katG突变的分离株中,30株315位AGC→ACC突变和1株315位AGC→AAC突变;7株芯片检测有inhA突变的分离株均为-15位C→T突变;其中2株既有katG突变又有inhA突变。部分芯片杂交结果见图2。
二、PCR-直接测序结果
结果见表3。30株Mtb利福平和异烟肼敏感株DNA测序结果与基因芯片检测结果一致,均为Mtb野生型。

图2.tb异烟肼katG基因和inhA启动子芯片杂交图
50株Mtb耐利福平分离株中,44株基因测序结果与PCR-基因芯片检测结果一致,其中3株均为rpoB野生型,41株均为突变型。6株基因测序结果与PCR-基因芯片检测结果不一致,其中4株为单位点突变,芯片上无相应的探针(分别是531位TCG→TAG、515位 ATG→ATA、513位 CAA→CAT和522位TCG→CAG);2株测序结果为双位点突变,其中各有1个突变位点芯片上无相应的探针,分别是516位GAC→AAC、526位CAC→CAG 突变。
50株Mtb耐异烟肼分离株中,47株katG基因测序结果与 PCR-基因芯片检测结果一致,其中16株均为野生型,31株均为315位密码子突变;3株katG基因测序结果与 PCR-基因芯片不一致,芯片上无相应的探针,分别为299位GGC→GTC突变、322位ACG→GCG突变和 291位 GCT→GAT突变。37株inhA基因测序结果与PCR-基因芯片检测结果一致,其中30株均为野生型,7株均为-15位突变型;13株inhA基因测序结果与PCR-基因芯片检测结果不一致,芯片上无相应的探针,其中10株为68位G→A突变,3株分别为-8位T→C、-21位G→C和-17位G→T突变。
讨 论
目前的研究表明,大约95%以上的Mtb耐利福平分离株在RNA聚合酶β亚单位编码基因rpoB的507-533位密码子的81bp热点区域有突变[2],90%的点突变发生在该区域11个氨基酸密码子之一的部位,其中最常见的突变位点是531位、526位和516位,并且531>526>516[3-5]。而Mtb耐异烟肼主要与katG基因和inhA启动子突变有关,katG基因最常见的突变是315位密码子AGC→ACC的突变,该突变引起过氧化氢酶活性降低,导致异烟肼耐药[6]。InhA基因编码脂肪酸转运蛋白(NADH依赖的enoyl-ACP还原酶),是分枝菌酸细胞壁合成的必需成分,活化的异烟肼结合到NADH上抑制了依赖NADH酶的活性,抑制了分枝菌酸的合成而导致了细胞的死亡。inhA基因的突变修改了该酶,使它失去了和NADH的亲和力,导致异烟肼耐药[7-8]。因此,这些区域是利福平和异烟肼耐药株分子检测的主要靶位[9-11]。
基因芯片技术是目前分子诊断的先进方法。国内外很多专家分别报道用基因芯片检测耐利福平Mtb标本,其检测结果与测序结果大多数相符[12-13]。因此,应用基因芯片快速检出rpoB基因、katG基因和inhA基因突变可以作为耐多药结核病的诊断指标。
本研究应用已商品化的基因芯片分析Mtb rpoB基因的6个野生型和13个突变型位点,分析katG基因315位密码子的1个野生型和2个突变型及inhA基因启动子区-15位的野生型和突变型,因此,可检出耐多药结核病常见的基因突变位点。
本实验中30株Mtb利福平和异烟肼敏感株中,DNA芯片杂交结果也均为野生型,特异度为100.00%。50株耐利福平临床分离株中43株可检测到rpoB基因突变,灵敏度为86.00%,与郭乃洲等[14]报道的一致。这是因为该基因阵列探针只包括最常见的13种突变,基因测序结果证明4株突变株芯片上无相应的突变探针,因此,基因芯片检测的灵敏度低于基因测序。此外,3株在分析的部位未发现基因突变,有可能在本检测范围外的其他位点存在突变,或者是存在其他耐药机制,或者传统药敏实验误差所致。本试验中,检测到的最常见的突变位点也是531位、526位和516位密码子,与报道一致。
50株Mtb耐异烟肼分离株中,36株有katG和(或)inhA突变,灵敏度为 72.00%,其中katG 基因突变率为62%,与袁瑛等[15]、菅记涌等[16]报道的一致;inhA-15位基因突变率仅为 14%,与Morris等[17]报道的一致。由于芯片只能检测到常见的野生型和突变型,因此,katG基因测序显示的3株少见的突变基因型芯片未能检出。此外,16株在分析的部位未发现基因突变,笔者将进一步分析,查找原因。
在耐异烟肼分离株中,通过PCR-基因芯片只检出7株inhA-15位C→T突变,但基因测序发现10株芯片检测敏感的菌株存在inhA 68位G→A突变,该突变为首次报道,它在异烟肼敏感菌株中不存在,但在测序证实的20株inhA基因突变株中,该突变基因型占了50%,高于inhA-15位突变,该突变是否与异烟肼耐受相关尚需进一步研究证实。
总之,用PCR-基因芯片可快速、特异地检测出大多数Mtb耐多药分离株,用于临床耐药性检测,可指导临床治疗。
[1] 张敦熔.现代结核病学.北京:人民军医出版社,2000:96-98.
[2] Musser JM.Antimicrobial agent resistance in mycobacteria:molecular genetic insights(Review). Clin Microbiol Rev,1995,8(4):496-514.
[3] Nachamkin I,Kang C,Weinstein MP.Detection of resistance to isoniazid,rifampin,and streptomycin in clinical isolates of Mycobacterium tuberculosis by molecular methods.Clin Infect Dis,1997,24(5):894-900.
[4] Jou R,Chen HY,Chiang CY,et al.Genetic diversity of multidrug-resistant Mycobacterium tuberculosis isolates and identification of 11 novel rpoB alleles in Taiwan.J Clin Microbiol,2005,43(3):1390-1394.
[5] Bolotin S,Alexander DC,Chedore P,et al.M olecular characterization of drug-resistant Mycobacterium tuberculosis isolates from Ontario,Canada.J Antimicrob Chemother,2009,64(2):263-266.
[6].usser JM,Kapur V,Williams DL,et al.Characterization of the catalase-peroxidase gene(katG)and inhA locus in isoniazid-resistant and-susceptible strains of Mycobacterium tuberculosis by automated DNA sequencing:restricted array of mutations associated with drug resistance.J Infect Dis,1996,173(1):196-202.
[7] Luckner SR,Liu N,am Ende CW,et al.A slow,tight binding inhibitor of InhA,the enoyl-acyl carrier protein reductase from Mycobacterium tuberculosis.J Biol Chem,2010,285(19):14330-14337.
[8] Dessen A,Quémard A,Blanchard JS,et al.Crystal structure and function of the isoniazid target of Mycobacterium tuberculosis.Science,1995,267(5204):1638-1641.
[9] Drobniewski FA,Watterson SA,Wilson SM,et al.A clinical,microbiological and economic analysis of a national service for the rapid molecular diagnosis of tuberculosis and rifampicin resistance in Mycobacterium tuberculosis.J Med Microbiol,2000,49(3):271-278.
[10] Chaoui I,Sabouni R,Kourout M,et al.Analysis of isoniazid,streptomycin and ethambutol resistance in Mycobacterium tuberculosis isolates from Morocco.J Infect Dev Ctries,2009,3(4):278-284.
[11] Banerjee A,Dubnau E,Quemard A,et al.Inh A,a gene encoding a target for isoniazid and ethionamide in Mycobacterium tuberculosis.Science,1994,263(5144):227-230.
[12] 梁莉,乐军,李瑶,等.利用基因芯片技术检测结核分支杆菌耐利福平分离株rpoB基因突变的研究.中华医院感染学杂志,2005,15(8):841-844.
[13] Aragón LM,Navarro F,Heiser V,et al.Rapid detection of specific gene mutations associated with isoniazid or rifampicin resistance in Mycobacterium tuberculosis clinical isolates using non-fluorescent low-density DNA microarrays.J Antimicrob Chemother,2006,57(5):825-831.
[14] 郭乃洲,王万相,严爱华,等.显色法芯片检测结核分枝杆菌利福平和异烟肼耐药基因.中华微生物学和免疫学杂志,2006,26(6):567-570.
[15] 袁瑛,顾德林,顾红艳.耐多药结核分枝杆菌 KatG及rpoB基因变异的研究.临床荟萃,2006,21(12):863-864.
[16] 菅记涌,王嫩寒,易俊莉,等.M TBDR plus方法快速检测北京地区临床结核分枝杆菌分离株利福平和异烟肼耐药性效果评价.中国防痨杂志,2010,32(10):611-614.
[17] Morris S,Bai GH,Suffys P,et al.M olecular mechanisms of multiple drug resistance in clinical isolates of Mycobacterium tuberculosis.J Infect Dis,1995,171(4):954-960.

