EDTA提高Microtox检测有机化合物毒性灵敏度的研究
郝春慧 石长华 郭寅生 刘红艳 黄正
(1.华中科技大学同济医学院公共卫生学院教育部环境与健康重点实验室 湖北武汉 430030;2.湖北出入境检验检疫局)
1 前言
Microtox利用污染物毒性大小与细菌发光强度变化存在相关关系进行急性毒性评价,应用于环境污染物毒性检测已有30年历史,在对重金属、简单有机污染物的毒性检测中优势十分突出[1],且已被我国(GB/T 15441-1995)和国际标准化组织(ISO11348-2007)列为急性毒性检测标准方法。
Microtox所采用的明亮发光杆菌为革兰氏阴性,现有研究已表明革兰氏阴性细菌因其外膜上脂多糖分子的存在导致其对疏水性物质进入细胞具有屏障作用[2,3],由于 Microtox 标准方法中受试物与细胞作用的时间只有15min[4],受试物短时间充分进入细胞受到脂多糖分子的屏障致使对结构复杂毒物检测灵敏度呈现一定程度限制。但通过采用提高细胞通透性技术可望改善上述局限,目前国内外还没有这方面的报道。常见的用于增加细菌细胞通透性的物质有:螯合剂(如EDTA)、多聚阳离子(如多粘菌素B和庆大霉素)、大分子的有机一价阳离子(如tris)及溶菌酶等。通过与细胞壁离子结合、去除肽聚糖结构等方式提高细胞膜通透性[5],比如 I.M.Helander和 T.Mattila-Sandholm 2000年用荧光探针NPN检测EDTA及Na-HMP对绿脓杆菌、大肠杆菌及沙门氏菌细胞外膜上脂多糖的释放来研究细胞通透性的改变,发现EDTA能引起细胞外膜高达40%脂多糖的释放[2]。
检测通透性改变的方法有以产色的头孢硝噻吩为底物检测细胞内β-内酰胺酶的活性、用疏水荧光探针NPN检测荧光强度、以放射性的14C标记脂多糖(LPS)及电镜下形态观察[2]等。本研究采用EDTA去掉细菌外膜脂多糖、提高细胞通透性,用疏水荧光探针NPN(在含水环境中荧光微弱,而进入细胞内等非极性或疏水环境中荧光增强[2,3])来检测荧光强度的变化,证实细胞通透性的改变。最终通过提高明亮发光杆菌通透性来改善Microtox检测有机化合物毒性灵敏度,并采用高通量分析手段提高检测效率。
2 材料与方法
2.1 材料
2.1.1 菌种
明亮发光杆菌(Photobacterium phosphoreum T3变种)冻干粉,由中国科学院南京土壤所提供,-80℃超低温冰箱保存。
2.1.2 主要仪器及试剂
Perkin Elmer-LS55型荧光分光光度计;TECAN-F200型多功能酶标仪;Fluotrac200 96孔板,;HQ-45B型恒温摇床;WH-2型微型漩涡混合仪;722型分光光度计;IKA-KSBO型振荡器;Eppendorf 5702 R型离心机。
N-苯基-1-萘胺(NPN,分析纯):在棕色瓶中配溶解于丙酮(分析纯)中的0.5mM NPN储备液[3],使用前用3%NaCl溶液稀释;乙二胺四乙酸二钠(EDTA-Na2,分析纯),200mM;支持缓冲液:NaCl 3%、Na2HPO40.5%、KH2PO40.1%、甘油0.3%,此缓冲液含 3%NaCl和 0.3%甘油,可以稳定渗透压和发光反应时间,后面统称其为lumis缓冲液;供试化合物1,10-二氮杂菲、1,4-对位苯醌、双酚A(BPA)、4-异丙基苯酚均为分析纯,测试前除1,10-二氮杂菲用3%NaCl溶解,其余均用助溶剂二甲亚砜(DMSO,分析纯,购自Sigma公司)配成一定浓度储备液,然后分别取不同量溶解的有机物于3%NaCl溶液中配制成系列浓度测试液[6]。
2.2 方法
2.2.1 发光菌的培养
发光菌冻干粉用1mL3%NaCl复苏,接入20mL液体培养基内,25℃摇床培养12h(转速约140r/min),取10uL接入斜面培养基,经25℃培养24h于暗室内观察可见明显蓝绿色发光后,放4℃冰箱备用。
2.2.2 菌悬液的准备
将4℃保存的上述斜面菌种转接到20mL液体培养基,25℃振荡增菌至暗室内观察有明亮发光,转移到15mL离心管,3000rpm 10min离心,收集菌体并用lumis缓冲液制成菌悬液,调整菌液浓度至722-分光光度计于600nm处测得此菌悬液A=0.4左右为止[6]。
2.2.3 EDTA处理及通透性改变的检测
检测体系中菌悬液、EDTA及NPN的体积比为2:1:1,用3%NaCl稀释EDTA梯度系列的终浓度至10、20、30、40、50mM,NPN 的终浓度为10uM,阴性对照组中EDTA及NPN的比例用lumis缓冲液补足。用Perkin Elmer-LS55型荧光分光光度计检测荧光强度,且每个系列做三个平行样。根据NPN的特性设定检测的激发波长340nm,发射波长宽度300-500nm,狭缝宽度10nm。
NPN吸收系数=扣除阴性对照的菌液组荧光值/扣除阴性对照的缓冲液组荧光值。
2.2.4 EDTA对发光与菌数的影响
黑色96孔板为反应板,按1:1的比例先后加入菌悬液和40mM的EDTA,每组三个平行,振荡反应15min后检测发光。100uL菌悬液和100uL 80mM的EDTA混合涂布发光杆菌平板,以等量的菌悬液和lumis缓冲液为阴性对照,每组三个平行,25℃培养24h后菌落计数。
2.2.5 毒性检测
用全黑平底96孔板,于1-6列的每孔中加60μL发光菌的菌悬液,多功能酶标仪检测发光,并保证相同孔内发光的标准偏差低于5%,然后于1-3和4-6列的每孔分别加80uL的lumis缓冲液和100mM EDTA,并迅速于B-H行按照浓度梯度由低到高的顺序每行顺次加入60μL的标准毒物,IKA-KSBO型振荡器25℃恒温准确振荡15min,保证毒物与菌液充分结合,立即用多功能酶标仪检测发光,A行为阴性对照。
2.2.6 发光细菌半数发光抑制浓度 EC50的计算[4]
抑制率=1-(样品发光平均值/对照发光平均值)×100%
利用线性回归分析建立化合物浓度(C)与抑制率(T)%之间的相关方程,计算对应发光抑制浓度EC50。
3 结果
3.1 通透性改变的检测
各浓度的EDTA对荧光强度及发光细菌NPN吸收系数的影响见图1及表1。从图1及表1可见加入EDTA后,细菌对NPN的吸收系数明显增加,其中浓度为40mM的EDTA对其影响最大,相对于不加EDTA的检测系列,NPN吸收系数由8.8增加到13.0,最大增幅为47.7%,而过高浓度(50mM)的EDTA反而会抑制荧光物质的吸收。
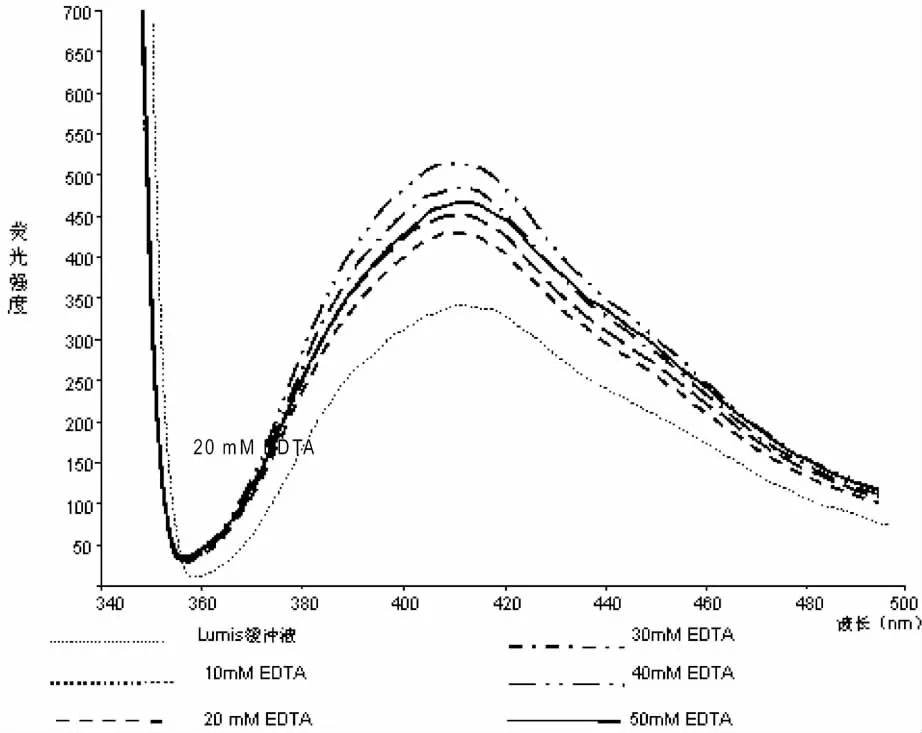
图1 不同浓度EDTA对NPN荧光强度的影响

表1 EDTA浓度对发光细菌NPN吸收的影响
故后续实验中均采用40mM EDTA处理明亮发光杆菌。
3.2 EDTA对发光与菌数的影响
40mM EDTA对菌体发光强度及菌落计数的影响示意图见图2,未加EDTA时每100uL A=0.4的菌悬液的发光强度及菌落计数的均数分别为8.3×105和6.34×106cfu/mL,加入 40mM EDTA 后分别为7.9×105和 6.35 ×106cfu/mL,经配对设计的 t检验,均有P<0.05,因而40mM EDTA对菌体发光强度及菌落计数的影响均没有显著性差异。

图2 40mM EDTA对菌体发光强度及菌落计数的影响
3.3 化合物对发光菌的毒性
实验所用4种供试化合物中,1,4-对位苯醌、双酚A、4-异丙基苯酚均为水溶性极低的有机毒物。实验中采用DMSO作为非水溶性毒物的助溶剂,并以DMSO对发光菌生物毒性效应的影响不超过1%所对应的浓度作为实际操作中允许加入的界限浓度[6]。实验研究表明,在 DMS0浓度不超过10mM时,其对发光细菌发光强度的抑制率不超过1%[6],满足毒性测定要求。
化合物对发光菌的抑制作用见图3。从图3可见化合物对发光细菌的抑制反应的相关系数在加入EDTA前后均在0.99左右,其浓度与发光细菌的发光抑制效应呈显著的负相关关系。4种化合物急性毒性由大到小的顺序是1,4-对位苯醌、4-异丙基苯酚、双酚A、1,10-二氮杂菲,加入40mM EDTA作用15min后,毒物的EC50值分别有不同程度的降低,依次为 36.48%、30.29%、23.96%、23.94%(表2),且毒性顺序没有改变。

图3 加入EDTA前后各化合物对发光菌的剂量-效应关系

表2 各化合物的EC50值(mg/L)
4 讨论
早在1974年LORETTA LEIVE就曾做过利用EDTA来增加大肠类细菌细胞壁的通透性,使大分子药物能更好的进入细胞提高药效的研究[7],随后开始广泛应用于临床用药研究[2,5]。本研究利用EDTA来改变明亮发光杆菌的通透性,效果显著,用于Microtox,从而可以降低检测限,提高检测灵敏度。
本研究采用黑色96孔板[8,9],每孔毒物和菌液的总量为200uL,整板的用量也不超过20mL,大大降低了检测成本,可以同时检测多个系列样品,且便于多次平行测定从而提高准确度[10],而且全部96孔的扫描时间也不足2min。
由于日益严重的环境污染和治理评价工作的需要,导致目前生物毒性分析的待测样本量大,传统毒性检测方法成本高、工作量大、耗时长,无法快速判定多种有毒化合物的相互影响。将改变细菌细胞的通透性及利用微孔板的高通量检测技术应用于污染物的微生物检测,使微生物急性毒性试验更为快速、灵敏、高效、准确,符合环境污染物毒性分析技术的发展趋势,在大范围污染物筛查、优先污染物筛选、联合作用分析等方面有广泛应用前景。
[1] 阎鹏,孙礼.利用发光菌快速检测环境污染物急性毒性的研究概况[J].环境与健康杂志,2001,18(4):250 -252.
[2] I.M.Helander and T.Mattila - Sandholm.Fluorometric assessment of Gram-negative bacterial permeabilization.Journal of Applied Microbiology,2000,88:213 –219.
[3] H – L Alakomi,1 M Saarela1 ,IM Helander.Effect of EDTA on Salmonella enterica serovar Typhimurium involves a component not assignable to lipopolysaccharide release[J].Microbiology,2003,149:2015–2021.
[4] GB/T15441-1995水质急性毒性的测定-发光细菌法[S].
[5] Martiti Vaara.Agents That increase the permeability of the outer membrane,microbiological reviews[J].Microbiological Reviews,1992,56(3):395 -411.
[6] 张金丽,袁建军.Microtox技术检测多环芳烃生物毒性的研究[J].中国生态农业学报,2004,12(4):68 -71.
[7] L.Loretta.The barrier function of the gram -negative envelope.Annals Of The New York Academy Of Sciences,1974,235(1):109-129.
[8] G Gellert ,A Stommel.Influence of Microplate Material on the Sensitivityof Growth Inhibition Tests with Bacteria Assessing Toxic Organic Substances in Water and Waste Water[J].Environmental Toxicology,1999,14(4):424-428.
[9] D Hirmann,Andreas P Loibner,Rudolf Braun,et al.Applicability of the bioluminescence inhibition test in the 96-well microplate format for PAH-solutions and elutriates of PAH-contaminated soils[J].Journal of Chemosphere,2007,67:1236 – 1242.
[10] 刘保奇,葛会林.测定环境污染物对青海弧茵发光强度抑制的微板发光法研究[J].生态毒理学报,2006,1(2):186-191.

