参附注射液对大鼠心室肌细胞L型钙通道的影响
吴晓丹,孟红旭,张林,白晶,杨勇
(1.北京中医药大学,北京 100029;2.中国中医科学院西苑医院,北京 100091)
参附注射液是在传统益气温阳固脱名方参附汤基础上经过剂型和工艺改造研制而成,主要成分为人参皂苷和乌头碱类生物碱。参附注射液对多种心律失常都有较好的临床疗效,但治疗心律失常的机制还不清楚,研究表明,心律失常和心肌细胞的离子通道关系密切。因此,我们观察了参附注射液对大鼠心室肌细胞L型钙通道的影响,以初步探讨参附注射液的离子通道调控机制。
1 材料和方法
1.1 心室肌细胞的分离
SD大鼠,雄性,体质量(180±10)g,由北京维通利华实验动物养殖场提供。10%乌拉坦腹腔麻醉,迅速开胸取出心脏,在零度无钙台式液中剥离出主动脉,悬挂于Langendorff心脏灌流装置上,确保管口不超过主动脉的心脏入口,棉线固定,行主动脉逆行灌流,流量为7~8ml/min。先用无钙台氏液灌流5min,接着用含0.4mg/ml胶原酶Ⅱ(worthington)、0.03mg/ml蛋白酶ⅩⅣ(sigma)、0.9mg/ml牛血清白蛋白(sigma)低钙台氏液(CaCl20.05mmol/L)灌流 19~24min,最后用含氯化钙低钙台式液(CaCl20.4mmol/L)灌流5min,剪取心室组织在KB液中剪碎,吹打,用100目筛网过滤,最后将细胞保存在KB液中,4℃低温可保存36h。整个过程灌流液维持温度在(37±1)℃,灌流液中充纯氧气。
1.2 膜片钳技术
通过电极拉制仪(PULL-100,美国)拉制电极,使玻璃电极充电极内液后阻抗达到2~4MΩ。吸几滴细胞悬液加入细胞池中,细胞贴壁后选择杆状、表面光滑、纹理清晰的心肌细胞,利用三维操纵器移动电极贴近目标细胞,并轻压在细胞表面,稍加负压即可形成1GΩ水平以上的高阻抗封接,再用较大负压吸破细胞膜,形成全细胞记录形式。实验过程由刺激采集软件Pulse控制,经膜片钳放大器 (EPC10,德国),通过模数转换采集数据,存放于计算机硬盘。
1.3 药物和配制液体
1.3.1 药物
参附注射液(四川雅安制药公司);配液所需药品除指定外皆由英国Alfa Aesar公司购置。
1.3.2 配制液体(mmol/L)
无钙台式液:NaCl 140,KCl 5.4,NaH2PO40.33,MgCl21,Glucose 10,Hepes 10(pH7.4 NaOH);KB 液:KOH 70,KCl 40,KH2PO420,Glutamic acid 50,MgCl23,Taurine 20,EGTA 0.5,Hepes 10,Glucose 10(pH7.4 KOH);细胞外液:台式液(无钙台式液+CaCl21.8);电极内液:CsCl 140,MgCl22,CaCl21,EGTA 11,Na2ATP 5,Hepes 10(pH 7.2 CsOH)。
1.4 统计学处理
2 结果
2.1 参附注射液对L型钙通道电流浓度依赖性的抑制作用
原液采用台式液进行稀释,给予不同稀释浓度的参附注射液后L型钙通道电流幅度随浓度升高呈现不断减小趋势(见图1A),经统计,参附注射液(1%;3%;10%)对电流峰值的抑制率分别为(13.6±1.4)(n=4);(28.4 ±7.5)(n=6);(41.10 ±19)(n=5),显示出明显的量效关系。制作量效曲线,通过Boltzmann方程拟合(图1B),IC50大约为稀释浓度至2.5%。

图1 参附注射液对L型钙通道电流浓度依赖性的抑制作用
2.2 参附注射液对L型钙通道I-V曲线的影响
刺激脉冲从保持电压-40mV开始,每隔10mV连续去极化至+70mV,持续时间200ms,频率0.5Hz,可诱导出一系列 L型钙通道电流,反转电压大约为60mV。给予参附注射液(0.3%,3%)后各钙通道电流峰值都出现下降(图2A),取各个电流峰值及对应的刺激电压制作电流电压曲线,给药后,I-U曲线上移,但不改变I-U曲线的形状和反转电位(图2B)。
2.3 参附注射液对L型钙通道稳态激活曲线和失活曲线的影响
稳态激活曲线的全部数据皆来自I-V曲线,将记录到的给药前后的电流电压值按Boltzmann方程进行拟合:G/Gmax=1/[1+exp(V -V1/2/κ)]G=I/(V -Vrev),式中G为电导率,V为刺激电压,V1/2为半激活电压,κ为曲线倾斜系数,I为电流峰值,Vrev为反转电压。给药前后稳态激活曲线无明显变化(图3A),给药前V1/2和κ分别为-(18.8±1.8)mV和(3.97±0.62);给于3%参附注射液后,V1/2和κ分别为-(18.3±3.3)mV和(4.32±1.55),两组参数差异无统计学意义(P>0.05)。稳态失活曲线应用双脉冲刺激参数获得,保持电压-40mV,条件脉冲从-70mV,每隔10mV连续去极化至20mV,持续时间1s,然后再给一去极化至0mV,持续时间200ms的测试脉冲。失活曲线用BoltzmannI/Imax=1/{1+exp[(VVh)/κ]}方程进行拟合,V h为半失活电压,κ为斜率因子。给药前后稳态激活曲线无明显变化(图3B),给药前V1/2和κ分别为-(28.3±3.37)mV和(4.02±0.77);给与3%参附注射液后,V1/2和κ分别为 -(28.3±2.53)mV和(4.73±0.71),两组参数差异无统计学意义(P>0.05)。以上结果说明参附注射液对L型钙通道稳态激活和失活曲线无明显影响。

图2 参附注射液对L型钙通道I-V曲线的影响

图3 3%参附注射液对L型钙通道稳态激活曲线和失活曲线的影响
2.4 参附注射液对L型钙通道失活后恢复的影响
失活后恢复曲线测定:采用双脉冲刺激,保持电压-40mV,条件脉冲去极化至0mV,持续时间200ms,再给一同样刺激脉冲,两脉冲的间隔时间逐渐增加,每次增家上一次间隔的1倍,共7次刺激,最长间隔至1 280ms。将记录到的电流值按单指数方程进行拟合I(%)=A+Bexp( -t/τ),式中 I(%)为第2刺激脉冲引出的电流与第1刺激脉冲引出电流的比值,t为两脉冲之间间隔的时间,τ为失活后再激活的时间常数。给药(3%参附注射液)后失活后恢复曲线右移(图4),时间常数τ值由给药前(82.1±32.7)ms增加至(139±27.3)ms,差异显著,具有统计学意义(P<0.05),表明参附注射液能够延长L型钙通道失活后恢复时间。
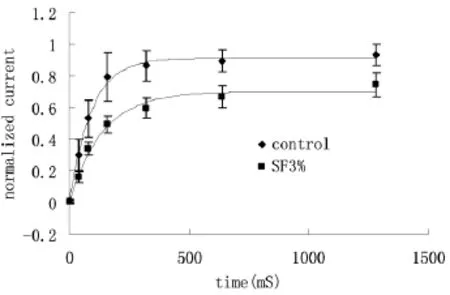
图4 3%参附注射液对L型钙通道失活后恢复的影响
3 讨论
参附注射液的传统剂型是参附汤,源自《济生续方》,由人参、附子两味药物组成,主治元气大亏,阳气暴脱,手足厥冷,气微欲绝。药理研究显示,参附注射液对心律具有双向调节作用,既能治疗快速心律失常,也能治疗慢性心律失常[1]。对乌头碱致大鼠心律失常模型,参附注射液可以有效缓解乌头碱所致室性及室上性心律失常及房室传导阻滞;对冠状动脉结扎致犬心肌缺血致心律失常模型,参附注射液可以明显改善模型动物心肌缺血的血流动力学指标,并能有效控制乌头碱所致室早和室速及心得安所致的心动过缓[2]。目前,关于参附注射液治疗各种心律失常的机制还不十分清楚,由于心肌离子通道的功能异常与发生心率失常有直接影响,因此心律失常发生本质是心肌离子通道的功能异常,而目前临床使用的4类抗心律失常药物主要机制是抑制了不同种类的离子通道功能。因此,观察参附注射液对心肌离子通道的影响对揭示参附注射液治疗各种心律失常的机制有重要意义。本研究结果显示,参附注射液对心肌细胞L型钙通道电流有抑制作用。对钙通道有阻滞效应的药物可以参与缩短心肌细胞动作电位平台期的时程,降低细胞内钙离子浓度,从而降低由钙超载引起的各种心律失常[3]。受体调节学说认为,L型钙通道具静息、激动和失活3种状态,参附注射液具有减慢通道从失活状态恢复速率的特点,使通道恢复到静息态的量减少,有可能是针对快速型心律失常有效的机制之一。进年来有报道,参附注射液对豚鼠心室肌细胞动作电位和快钠通道电流有抑制作用[4],抑制对异常的钠内流的抑制可纠正电流动作电位时程(APD)异常延长,减少因早期后除极诱发严重的室性心律失常-尖端扭转型室速(Tdp),这一证据提示,参附注射液抗心律失常的作用机制可能通过作用多种离子通道实现的。因此只有通过对参附注射液有效成分对离子通道的作用进行深入探讨才能进一步说明参附注射液对心律失常的双相调节的作用机制。
[1] 杨芳炬,尹华虎,林代平,等.参附注射液对动物心律失常的影响[J].华西药学杂志,2001,16(5):345 -347.
[2] 贾红慧,吴向东.参附注射液研究进展[J].中成药,1993,15(2):35-36.
[3] 闫福曼,周乐全,康亚丽.参附注射液对阿霉素致心肌细胞钙超载的影响[J].广州中医药大学学报,2008,25(4):339 -342.
[4] 罗洁,闵苏.参附注射液对豚鼠心室肌细胞动作电位和快钠通道电流的影响[J].中华麻醉医学杂志,2008,28(1):32 -35.

