胡黄连苦苷Ⅰ大鼠在体肠吸收动力学研究
高宏伟,匡海学,阎雪莹
(1.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040;2.黑龙江中医药大学,黑龙江 哈尔滨 150040)
Picroliv为印度胡黄连活性成分胡黄连苦苷Ⅰ(picrosideⅠ,P-Ⅰ)、胡黄连苷制成的标准化制剂。对四氯化碳、硫代乙酰胺、单响尾蛇毒蛋白、土霉素及半乳糖胺等物质引起的肝损伤具有明显的保护作用,其中P-Ⅰ既可以对抗补体介导的肝细胞毒,又可对抗四氯化碳引导的肝细胞毒性[1]。
本实验采用大鼠在体肠吸收模型,建立了HPLC法测定肠循环液中P-Ⅰ的经时浓度,对其在大鼠各肠段的吸收动力学特征进行初步研究,为其提供生物药剂学依据。
1 试验材料
1.1 药品与试剂
胡黄连苦苷Ⅰ(含量97.96%,本实验室提取分离制得,经光谱及核磁共振图谱鉴定结构);乌拉坦(中国上海曹阳第二中学化工厂);苯酚红(天津市新精细化工开发中心);甲醇(色谱纯,美国Dikma公司);其余试剂均为分析纯。
1.2 实验仪器
LC-2010AHT型高效液相色谱仪(岛津公司);Class-VP 6.0工作站(岛津公司);Sartorius BT25S电子天平(德国Sartorius公司);HJ-6A型数显恒温磁力搅拌器(江苏省金坛市荣华仪器制造有限公司);HL-3恒流泵(上海精科实业有限公司);pH计(梅特勒-托利多仪器上海有限公司);722型spectrum可见分光光度计(上海光谱仪器有限公司)。
1.3 实验动物
清洁级Wistar大鼠,雌雄各半,体质量(200±20)g,由黑龙江中医药大学药物安全性评价中心提供(许可证号:SCXK(黑)2008004)。
2 实验方法
2.1 Krebs-Ringers肠循环灌流液的配制
NaCl(6.75g/L),KCl(0.31g/L),CaCl2(0.37g/L),NaH2PO4(0.22g/L),MgSO4·7H2O(0.29g/L),NaHCO3(1.83g/L),Glucose(2.2g/L),上述物质溶解在双蒸水中,调溶液pH值为7.4。
2.2 肠循环灌流液中酚红的含量测定
2.2.1 专属性考察
取肠循环灌流液 0.5mL,加 4.5mLNaOH(0.2mol/L),以不加酚红的灌流液为空白,使用756型可见分光光度计,分别于200nm~700nm波长范围内进行扫描,酚红在558nm处有最大吸收,P-Ⅰ的最大吸收波长为282nm,表明酚红与P-Ⅰ不产生干扰。见图1。

图1 肠循环灌流液光谱扫描图
2.2.2 酚红标准曲线的制备
精密称定酚红6.25mg,用空白循环灌流液定容至25mL,分别取 0.5,1.0,2.0,4.0,6.0,8.0mL 定容至25mL,使酚红的终浓度为 5、10、20、40、60、80μg/mL,取上述不同浓度的酚红溶液各0.5mL,加入4.5mL NaOH(0.2mol/L)溶液显色,立即于558nm处测定吸光度,以吸光度A与酚红浓度C(μg/mL)进行回归,得酚红测定的线性标准曲线为:A=0.017 5C+0.042 2,相关系数 r=0.999 3。
2.3 肠循环灌流液中P-Ⅰ的含量测定
2.3.1 色谱条件
色谱柱:Diamonsil C18(5μm,250mm ×4.6mm);偶联Dikma EasyGuard II C18保护柱;流动相:甲醇:水(45∶55);检测波长:282nm;流速:1.0mL/min;进样量:20μL;柱温:35℃;灵敏度:0.2AUFS。
2.3.2 P - Ⅰ标准曲线的制备
精密称定P-Ⅰ2.52mg,用经过肠循环2h的K氏液定容至 25mL,按倍数稀释成 0.504、5.04、25.2、50.4、75.6、100.8μg/mL 一系列浓度的标准溶液,0.45μm微孔滤膜过滤,在上述条件下进样20μL,所得峰面积与浓度进行线性回归,得到P-Ⅰ标准曲线方程y=22 213x-12 576,相关系数r=0.999 6。
2.3.3 P-Ⅰ在空白K氏液中的稳定性考察
分别取P-Ⅰ适量,用空白灌流液稀释至不同浓度,置37℃水浴中,并不断搅拌,分别于不同时间点取样,测定峰面积,根据标准曲线方程计算浓度,考察其在空白灌流液中的稳定性,表明对照品溶液在配制后3h内测定是稳定的。结果见表1。
2.4 大鼠在体肠循环灌流实验
选取健康合格Wistar大鼠,实验前禁食不禁水12h,实验时10%乌拉坦10mL/kg腹腔注射麻醉,仰卧,固定于小动物手术台上,沿腹中线打开腹腔,结扎胆总管。分别选取十二指肠(距离胃的幽门1.5cm处开始 15cm),空肠(距离胃的幽门 25cm处开始15cm)、回肠部位(距离盲肠上行长15cm)作为肠循环灌流部位。在选定肠段两端剪开小口,分别插入软管,扎紧,连接蠕动泵,使“肠段-软管-泵”形成一个闭合回路。开启恒流蠕动泵,用空白的Krebs-Ringers灌流液(不加酚红和测试药物)清洗肠腔至流出液清澈无脏物,泵入空气排净管中液体,然后泵入药液(37℃水浴并搅拌),灌流速度为2mL/min,循环10min后从储液灌中取样3ml开始计时定为0点,以后每30min取肠循环灌流液,按照“2.2项及2.3项”,测定酚红和P-Ⅰ浓度,分析药物的吸收情况。
3 实验结果
根据胡黄连苦苷Ⅰ肠循环灌流十二指肠、空肠、回肠的实验数值,计算剩余药量,见表2。

表1 P-Ⅰ在空白灌流液中的稳定性考察(n=7)

表2 P-Ⅰ肠循环灌流的剩余药量(M±SD,n=5,mg)
剩余药量对数值与取样时间进行回归,得到线性方程,该方程斜率的绝对值即为吸收速率常数Ka(h-1)[2],各方程及相关系数见表3。

表3 胡黄连苦苷Ⅰ小肠吸收速率常数(n=5)
由表3可以看出,P-Ⅰ在大鼠小肠吸收速率大小顺序为:空肠>十二指肠>回肠,对数据进行方差齐性检验及两两组间t检验,结果十二指肠、空肠、回肠的吸收速率均无显著性差异,表明P-Ⅰ在大鼠小肠中并无特异的吸收部位;根据以剩余药量的对数对取样时间进行线性回归方程中的相关系数r均大于0.9,表明药物浓度在肠道各部位的下降与循环时问呈线性关系,提示P-Ⅰ在大鼠小肠中吸收属于动力学为一级吸收。
胡黄连苦苷Ⅰ大鼠肠吸收动力学的相关参数见表4。
根据文献报道[3],大鼠表观渗透系数 Papp<0.03×10-4cm/s和 >0.2×10-4cm/s时,分别表示药物难以吸收和易于吸收,由表4可以看出,P-Ⅰ在十二指肠、空肠、回肠中的Papp分别为4.97×10-7cm/s,6.29 ×10-7cm/s,3.24 ×10-7cm/s,提示 P - Ⅰ在肠道中难以被吸收。
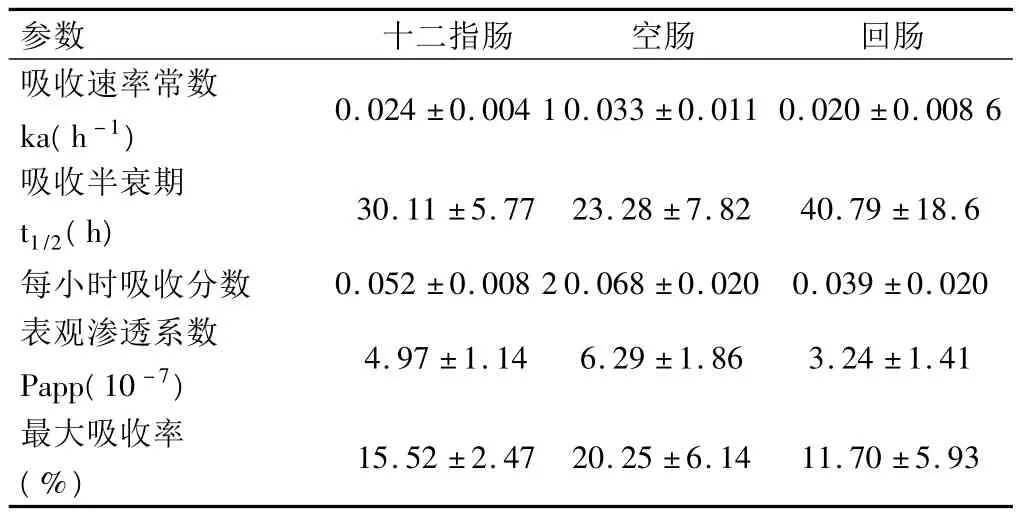
表4 胡黄连苦苷Ⅰ大鼠肠吸收动力学的参数(M±SD,n=5)
4 讨论
小肠是口服制剂的主要部位,研究表明,鼠小肠吸收模型与人类小肠吸收模型相似,用大鼠小肠吸收模型所得的数据能够有效应用于人类小肠的预测[4]。
本文采用单向灌流对P-Ⅰ的肠吸收进行了研究,肠段的灌流方法基于灌流前后肠腔内药物浓度的变化,由于小肠不仅吸收药物,同时也吸收或分泌水分导致灌流液的体积变化,本实验通过测定苯酚红的浓度进行校正。
P-Ⅰ在结构上属于环烯醚萜糖苷类化合物,性质不稳定,但其确有保肝利胆的药理作用。实验显示其几乎不被吸收,这就提示我们P-Ⅰ起效的可能不是原型药物,而可能是其在肠道中的代谢产物,具体其在体内的代谢行为还有待于进一步研究。
[1] 阎雪莹,刁磊,唐晓飞,高宏伟,等.胡黄连提取物的含量测定及其肝保护作用[J].中医药学报,2009,37(6):13 -15.
[2] 唐灿.中药肠吸收动力学的研究-灯盏花素肠吸收动力学的研究[D].成都:成都中医药大学博士学位论文,2004:29-31.
[3] Fagerholm U,Johansson M,Lennernas H.Comparison between permeability coefficients in rat and human jejunum[J].Pharmes,1996,13(9):336-342.
[4] 程锦,狄留庆.在体肠段灌流模型在中药吸收研究中的应用[J].中国中医药信息杂志,2008,15(2):98-100.

