自噬在创伤性脑损伤中的作用
洪 远, 郭松雪, 张建民
(浙江大学医学院附属第二医院神经外科,浙江杭州310009)
自噬(autophagy)是真核细胞在营养与能量缺乏情况下,通过分解亚细胞成分提供生物合成原料,使蛋白质和细胞器得以循环利用的一种降解代谢途径,同时调控线粒体更新及过氧化物酶体等,从而维持细胞稳态。近年对于自噬现象与疾病相互联系的研究逐渐增多,现就自噬在创伤性脑损伤中的作用做一综述,以期为创伤性脑损伤的治疗提供新的途径及思路。
1 自噬
1.1 概述 自噬可以分为大自噬(macroautophagy)、小自噬(microautophagy)及分子伴侣介导的自噬(chaperone-mediated autophagy)。通常意义上,重点集中于大自噬,作为典型普遍的自噬。自噬在形态学上的过程变化可归纳为,即将发生自噬的细胞胞浆中首先出现大量膜型结构称为前自噬体或前自噬泡(pre-autophagosomal structure),前自噬体进而形成孤立膜结构(isolation membrane),进一步延伸包裹细胞胞质及变性坏死细胞器,形成双层膜结构的空泡结构,即自噬体或自噬空泡(autophagosome)。自噬体再通过与溶酶体(lysosome)相融合,形成自噬溶酶体(autophagolysosome),在此过程中,溶酶体中的水解酶水解进入溶酶体腔的自噬体内膜及其包裹物质,最终自噬溶酶体破裂,分解后释放的物质成分得以降解及循环再利用,见图1[1]。
1.2 程序性细胞死亡 程序性细胞死亡(programmed cell death,PCD)是机体维持内环境稳态,清除损伤或病变细胞等的重要机制,主要由基因控制,是细胞自主的有序性的死亡。程序性细胞死亡主要有2种,第1种是I型程序性细胞死亡即凋亡,其典型特征为细胞皱缩、染色质聚集、核片段化、细胞质致密化、最终细胞片段化形成许多凋亡小体,被其它细胞吞入;第2种则是II型程序性细胞死亡,也称为自噬性程序性细胞死亡,其典型特征为形成双层膜结构的自噬泡,将细胞内的蛋白质或细胞器包裹其中,最终与溶酶体相结合形成自噬溶酶体,完成降解[2]。
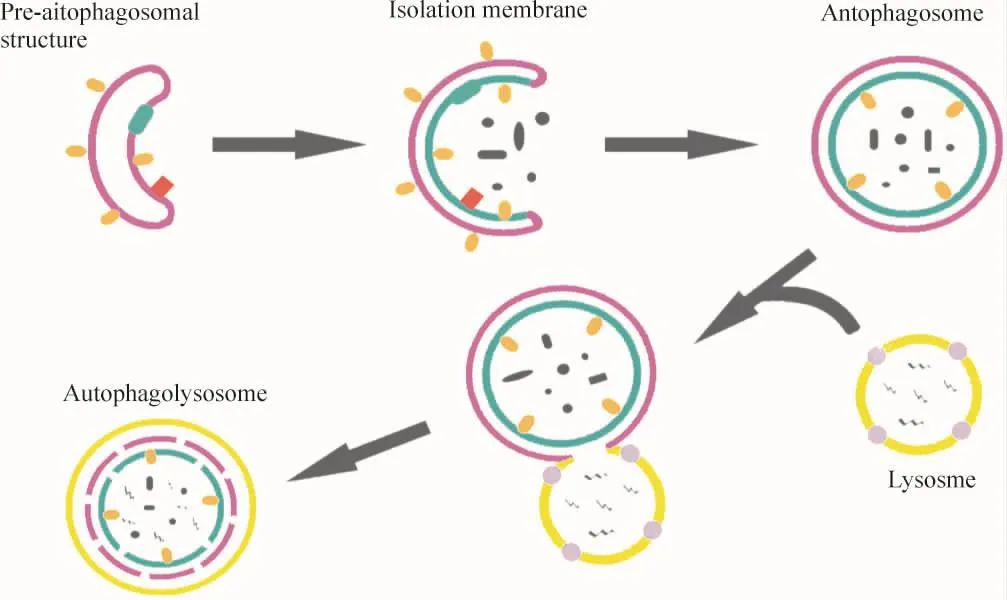
Figure 1.The route to the formation of autophagosome.The pre-autophagosomal structure results in a sequestering membrane termed isolation membrane,and then it enwraps cytosol and organelles to form a double- membrane vesicle,the autophagosome.Lastly,fusing with the lysosome,the autophagosome acquires hydrolytic enzymes to generate an autophagolysosome,which is an important access to degradate and recycle organelles and cytoplasm.图1 自噬溶酶体形成途径
以上2种细胞死亡方式均是维持细胞稳态的重要方式,它们之间存在着相互调节的关系。半胱氨酸蛋白酶 caspase在细胞凋亡中起重要作用,而caspase抑制物则可以诱导自噬性细胞死亡,同时利用RNA干扰(RNA interference,RNAi)特异性抑制自噬相关基因(autophagy associated gene,ATG)及beclin-1两种基因的表达又可影响caspase抑制物诱发的自噬[3]。因此通过调节caspase这一靶点,可以调控细胞不同死亡方式的趋向。控制程序性细胞死亡的关键分子均来源于细胞死亡相关蛋白激酶(death-associated protein kinase,DAPK)家族。DAPK和DAPK相关蛋白激酶-1(DAPK-related protein kinase-1,DRP-1)利用它们的激酶活性来促使细胞死亡。一般意义上,DAPK主要通过依赖caspase途径激活凋亡[4]。但据报道,通过持续转染活性DAPK ΔCaM 和DRP-1 Δ73至人肾 293细胞发现,DAPK和DRP-1主要引发细胞膜出泡生长,及自噬泡的形成,而非诱发凋亡的特征性改变,这一现象在MCF-7乳腺癌细胞、SV80成纤维细胞也有相似的验证结果[5]。在小鼠L929成纤维细胞中,应用caspase非选择性抑制剂zVAD-FMK抑制caspase的活性并不会阻止细胞死亡,这表明还存在着不依赖caspase的自噬性程序性细胞死亡[6]。在程序性细胞死亡中,自噬结构的出现与细胞死亡相关,但自噬并不必然导致细胞死亡。自噬性细胞死亡的激活和抑制均可发生于凋亡被抑制的条件下,也均可伴有自噬基因被抑制的情况。自噬不仅可能是导致细胞死亡的一个原因,也可能是先于细胞凋亡的一种保护机制。当刺激水平较低时,自噬可以作为维持细胞稳态的机制,而当刺激超出自噬调节能力时,则会引发细胞凋亡[7]。Caspase可以通过水解自噬调节因子来抑制自噬,抑制特定的caspase活性则可能诱发自噬[3,8]。总之,自噬与凋亡之间通过共享着一系列的调节因子而相互联系,相互影响。
2 创伤性脑损伤与自噬
创伤性脑损伤(traumatic brain injury,TBI)也称脑外伤,主要由外界机械力因素造成,伤后常并发一系列病理生理及生化改变,如蛛网膜下腔出血、脑血管痉挛、脑循环障碍、脑水肿等,上述继发性改变与原发性改变一起造成脑的多次严重损伤,进而导致较高的死亡率。
现有的研究结果表明,参与神经细胞损伤和死亡的病理机制,主要包括线粒体损伤、激活炎症反应、生成氧化自由基、激活caspase等[9]。保护神经元是脑外伤后重要的治疗目标,而治疗目标则集中于细胞死亡程序中的相应靶点。除了直接机械性损伤引发的细胞死亡外,细胞凋亡与自噬性细胞死亡均占有相当比例,而自噬对于受损细胞既存在保护作用也可加剧细胞损伤,主要取决于自噬在损伤后所处的作用倾向及阶段。自噬参与创伤性脑损伤后细胞生存死亡机制的调节,因此,在研究脑外伤后神经损伤和修复中有重要意义[10]。
已知的一些文献,已经从不同角度证实创伤性脑损伤后,都会出现不同程度的自噬增加现象。而这种现象的判定,主要可以依据以下几个标志物。
2.1 Beclin-1 Beclin-1是酵母 Apg96/Vps30基因的同源表达产物,Bcl-2的相互作用蛋白,可与3型磷脂酰肌醇3激酶[class III phosphatidylinositol(PtdIns)3-kinase,class III PI3K]形成复合物参与自噬体的形成[11]。以往对beclin-1基因敲除小鼠的胚胎干细胞研究已经发现,beclin-1-/-小鼠自噬缺陷,细胞凋亡正常,因此beclin-1是自噬的调控基因[12]。此外,其它相关研究表明,beclin-1蛋白发挥对自噬的正调节作用,需要beclin-1从beclin-1/Bcl-2中解聚并与class III PI3K结合启动自噬相关蛋白,而beclin-1/Bcl-2的比值也作为反映调节自噬的指标[13]。所以,可以通过免疫印迹蛋白电泳(western blotting)检测其在特定组织中的表达水平,从而对待测组织中细胞的自噬活性进行监测并判断其水平。Diskin等[14]通过对闭合性头部损伤小鼠模型的研究发现,在受损位置附近的神经元与星形胶质细胞中都会出现beclin-1蛋白表达上调,此外,相当一部分beclin-1过度表达的神经元细胞在TUNEL染色中表现出核TUNEL阳性,表明这些细胞正经历某种程度的自噬。
2.2 微管相关蛋白1轻链3(microtubule associated protein 1 light chain 3,LC3)LC3是酵母Atg8的同源类似物,存在于大多数的哺乳动物真核细胞中,是自噬体形成及胞浆到空泡靶向途径(cytosol to vacuole targeting pathway,CVT)的必需蛋白[15,16]。LC3 位于前自噬泡和自噬泡膜表面,通常作为细胞自噬泡膜的标记物。LC3-II是LC3羧基末端加工修饰后的产物,通常由LC3-I转变而来。LC3-II可共价结合在磷脂酰乙醇胺(phosphatidyl-ethanolamine,PE)的羧基端,且牢固地结合在自噬体膜上,其量正相关于自噬体的量现在广泛用于检测哺乳动物细胞中自噬活性[17]。
据报道,可控性脑皮质外伤小鼠模型的研究中,发现创伤性脑损伤发生后2-48 h,单侧损伤部位附近的皮质与海马中可以出现自噬体空泡,片层小体和次级溶酶体,此外,他们还证实,外伤后损伤侧鼠脑LC3-II蛋白的量,相对于未损伤侧增加近1倍[18]。另外,其他研究者在大鼠模型实验中也得到相似的结果,对比阴性对照组,损伤组鼠脑中LC3-II相对量增加了100% -200%[19,20]。且相关研究报道LC3的免疫反应性在大鼠脑外伤后成倍增加,约在8 d 时达到顶峰[21]。
此外,还有研究探讨了创伤性脑损伤后自噬发生的发育差异和性别差异,通过利用模拟1-4岁儿童脑代谢、神经发育及突触形成的年幼大鼠模型(生后17 d大鼠),Smith等[22]证实 LC3-II在创伤后24和48 h幼年大鼠中也存在表达增加,即创伤引发的自噬并不局限于成熟的哺乳动物大脑,发育差异并不存在;但是,雄性大鼠中LC3-II的表达明显高于雌性,即存在性别差异。
综上所述,不同的动物模型都证实在创伤性脑损伤后自噬增加,也有相关报道指出人脑外伤后也会出现这种现象[23]。但自噬在创伤性脑损伤中的作用还存在争议,一方面,自噬可以通过清除损伤蛋白及细胞器,减少线粒体能量消耗等有利于组织修复,另一方面,自噬也可以表现出一些不良效应,如损伤、减少功能性大分子和细胞器,加重细胞应激等。
3 创伤性脑损伤后自噬的保护或损伤作用
3.1 保护作用 很多机制都参与自噬的调节,其中哺乳动物雷帕霉素靶蛋白(mTOR,一种丝/苏氨基酸激酶)及3型PI3K就是两条重要的信号转导途径(图2)[24]。如图所示,胞膜上的胰岛素受体与1型PI3K依次激活后,生成相应磷脂酰肌醇产物3,4-二磷酸磷脂酰肌醇[PtdIns(3,4)P2]和 3,4,5 - 三磷酸磷脂酰肌醇[PtdIns(3,4,5)P3],进而活化 Akt/PKB及其激活物PDK-1。继而通过Akt途径与氨基酸一起激活mTOR,mTOR则可以拮抗自噬相关基因产物(Atg)诱导自噬的作用。此外,3型PI3K与beclin-1共同形成3型 PI3K复合体,生成PtdIns(3)P,进而促使自噬的发生。雷帕霉素(rapamycin)作用于mTOR,而渥曼青霉素(wortmannin)、3-甲基腺嘌呤(3-methyladenine,3-MA)抑制3型 PI3K,均可抑制自噬的发生,这些靶点都是已知的调控自噬重要途径,也是自噬神经保护作用的重要研究方向。
雷帕霉素是一种已知的免疫抑制药物,具有抗炎作用,并且可以抑制细胞增殖[25]。在自噬相关研究中,雷帕霉素被用于阻断哺乳动物mTOR进而解抑制并活化3型PI3K,最终引发自噬增加。Erlich等[26]在小鼠脑创伤CHI模型中,于损伤4 h后腹腔注射雷帕霉素(0.5和1.0 mg/kg),发现其可以明显改善小鼠损伤后的神经功能恢复。试验中也发现雷帕霉素可以抑制p70S6K90磷酸化,进而解除TOR p70S6激酶通路对自噬的抑制,诱导自噬,并观察到其可以减少小胶质细胞/巨噬细胞活化,抑制损伤引发的炎症反应及胶质增生,增加损伤部位幸存神经元的数量[26]。此外,研究者通过利用 Western blotting发现,在雷帕霉素治疗的损伤小鼠模型中,损伤小鼠会出现beclin-1表达上调,进而证实自噬增加,结合以上试验结果,可以间接推断自噬在创伤性脑损伤后的保护作用。

Figure 2.Schematic model of autophagic regulation.By stimulating of the class I PtdIns 3-kinase at the plasma membrane through the insulin receptor,PtdIns(3,4)P2 and PtdIns(3,4,5)P3 are produced,which allow binding and activation of Akt/PKB and its activator PDK - 1.With amino acids,Akt/PKB activates mTOR,which may be analogous to Atg1 or other ATG gene products and then inhibit autophagy.A class III PtdIns 3-kinase complex,which includes beclin 1/Atg6,generates PtdIns(3)P to cause autophagosome formation.Rapamycin can inhibit mTOR causing the induction of autophagy.In addition,wortmannin and 3-MA inhibit the class III PtdIns 3-kinase to inhibit autophagy.PDK -1:pyruvate dehydrogenase kinase-1;mTOR:mammalian target of rapamycin;Akt/PKB:Akt/protein kinase B;PtdIns:phosphatidylinositol;Atg:autophagy-specific gene;3-MA:3-methyladenine.图2 自噬主要信号调控途径
哺乳动物细胞处于营养物质丰富环境中时,胰岛素受体和氨基酸激活的mTOR及3型PI3K通路可显著抑制细胞自噬,而禁食在以往的研究中被认为可以弱化这种抑制作用,进而诱导自噬增加[27]。虽然对于禁食引发自噬增加的时限仍存在争议,但一些研究利用其这一效应为自噬在创伤性脑损伤后潜在保护作用,提供了一些支持证据[28]。Davis等[29]通过对可控性脑皮质外伤模型大鼠采取禁食24 h后,发现禁食可以改善脑组织损伤,并提高损伤后大鼠在莫瑞斯水迷宫试验(Morris water maze,一种空间记忆能力测试)中的表现,尽管其机制中未涉及自噬在其中的作用,但考虑到前文提及禁食可以弱化mTOR及3型PI3K通路激活对细胞自噬的抑制作用,我们间接推断禁食可能可以通过增加自噬,减少脑组织损伤细胞,从而在脑外伤后发挥一定的保护作用。这一机制有待进一步实验证实。
3.2 损伤作用 与前述研究结果矛盾的实验证据表明,自噬在创伤性脑损伤后表现出一种损伤作用,而非保护作用[30]。据报道,氧化应激及氧自由基均可诱发自噬,因此抗氧化剂可以影响自噬作用[18,31]。半胱氨酸供体γ-谷胱甘肽乙酯(γ-glutamylcysteinyl ethyl ester,GCEE,一种抗氧化剂)用于腹腔注射可控性脑皮质外伤小鼠模型后,发现小鼠受损部位脑皮质组织中LC3II的表达减少,进而证实组织中自噬减少,同时损伤小鼠在给药后在莫瑞斯水迷宫试验中的表现提高,这与上述自噬改善小鼠表现的结果相矛盾[18]。另外,还发现GCEE可以减少损伤小鼠受损半球海马CA1和CA3区域神经元的死亡,减轻脑组织丢失[18]。尽管仍需要考虑其它因素的干扰,但仍可根据以上结果推断,自噬性神经退化作用是小鼠创伤性脑损伤后神经元死亡及脑组织丢失的重要原因,并进一步显示了自噬可能的损伤作用。
3.3 应用展望 基于自噬在创伤性脑损伤中不同作用,根据自噬启动与延续时间,治疗的靶点也不同。免疫抑制剂雷帕霉素和抗躁狂药锂盐可以分别作用于mTOR和肌醇单磷酸酶(inositol monophosphatase,IMPase)诱导自噬激活,从而通过自噬的正性作用,清除损伤蛋白与细胞器,减轻组织损伤[26]。而3-MA等则是通过抑制自噬性细胞死亡而发挥保护作用。以上几种药物均已临床上应用于其它疾病,若应用于创伤性脑损伤的治疗,则需确定创伤后不同时点自噬的具体作用倾向,再给予相应药物,以期获得合理的治疗效果。此外,药物应用于错误时机,也可能造成相反效应,如不当的自噬激活可能会导致神经元死亡,加重脑损伤。因此,对于自噬在不同时点的具体作用,仍需进一步研究明确。
综上所述,各种研究证据表明在创伤性脑损伤后的受损脑组织中自噬增加,其对于损伤组织的作用仍存在争议,结果大多仍属于推定,缺乏直接证据,需要对其作用的准确机制及调控途径进行进一步的研究,从而明确自噬对受损脑组织的作用,为改善创伤性脑损伤病人的预后提供新的治疗靶点。
[1]Mizushirna N,Ohsumi Y,Yoshimori T.Autophagosome formatìon in manmaian cells[J]. Cell Struct Funct,2002,27(6):421-429.
[2]Clarke PG.Developmental cell death:morphological diversity and multiple mechanisms[J].Anat Embryol(Berl),1990,181(3):195-213.
[3]Yu L,Alva A,Su H,et al.Regulation of an ATG7-beclin 1 program of autophagic cell death by caspase -8[J].Science,2004,304(5676):1500-1502.
[4]Allan LA,Clarke PR.Apoptosis and autophagy:Regulation of caspase - 9 by phosphorylation[J].FEBS J,2009,276(21):6063-6073.
[5]Inbal B,Bialik S,Sabanay I,et al.DAP kinase and DRP-1 mediate membrane blebbing and the formation of autophagic vesicles during programmed cell death[J].J Cell Biol,2002,157(3):455 -468.
[6]Wu YT,Tan HL,Huang Q,et al.Autophagy plays a protective role during zVAD-induced necrotic cell death[J].Autophagy,2008,4(4):457-466.
[7]Eisenberg-Lerner A,Bialik S,Simon HU,et al.Life and death partners:apoptosis,autophagy and the crosstalk between them[J].Cell Death Differ,2009,16(7):966-975.
[8]Djavaheri- Mergny M,Maiuri MC,Kroemer G.Cross talk between apoptosis and autophagy by caspase-mediated cleavage of Beclin 1[J].Oncogene,2010,29(12):1717-1719.
[9]Raghupathi R.Cell death mechanisms following traumatic brain injury[J].Brain Pathol,2004,14(2):215 -222.
[10]Rubinsztein DC,DiFiglia M,Heintz N,et al.Autophagy and its possible roles in nervous system diseases,damage and repair[J].Autophagy,2005,1(1):11 -22.
[11]Meijer AJ,Codogno P.Regulation and role of autophagy in mammalian cells[J].Int J Biochem Cell Biol,2004,36(12):2445-2462.
[12]Yue Z,Jin S,Yang C,et al.Beclin-1,an autophagy gene essential for early embryonic development,is a haploinsufficient tumor suppressor[J].Proc Natl Acad Sci USA,2003,100(25):15077-15082.
[13]Pattingre S,Levine B.Bcl-2 inhibition of autophagy:A new route to cancer?[J].Cancer Res,2006,66(6):2885-2888.
[14]Diskin T,Tal-Or P,Erlich S,et al.Closed head injury induces upregulation of Beclin 1 at the cortical site of injury[J].J Neurotrauma,2005,22(7):750 -762.
[15]Suzanne SM,James AH.Molecular characterization of light chain 3.A microtubule binding subunit of MAP1A and MAP1B[J].J Biol Chem,1994,269(15):11492-11497.
[16]Kabeya Y,Mizushima N,Yamamoto A,et al.LC3,GABARAP and GATE16 localize to autophagosomal membrane depending on form - II formation[J].J Cell Sci,2004,117(13):2805-2812.
[17]Mizushima N.Methods for monitoring autophagy[J].Int J Biochem Cell Biol,2004,36(12):2491 -2502.
[18]Lai Y,Hickey RW,Chen Y,et al.Autophagy is increased after traumatic brain injury in mice and is partially inhibited by the antioxidant γ-glutamylcysteinyl ethyl ester[J].J Cereb Blood Flow Metab,2008,28(3):540 -550.
[19]Liu CL,Chen S,Dietrich D,et al.Changes in autophagy after traumatic brain injury[J].J Cereb Blood Flow Metab,2008,28(4):674-683.
[20]Sadasivan S,Dunn WA Jr,Hayes RL,et al.Changes in autophagy proteins in a rat model of controlled cortical impact induced brain injury[J].Biochem Biophys Res Commun,2008,373(4):478-481.
[21]Zhang YB,Li SX,Chen XP,et al.Autophagy is activated and might protect neurons from degeneration after traumatic brain injury[J].Neurosci Bull,2008,24(3):143-149.
[22]Smith CM,Chen Y,Sullivan ML,et al.Autophagy in acute brain injury:feast,famine,or folly?[J].Neurobiol Dis,2011,43(1):52 -59.
[23]Clark RS,Bayir H,Chu CT,et al.Autophagy is increased in mice after traumatic brain injury and is detectable in human brain after trauma and critical illness[J].Autophagy,2008,4(1):88-90.
[24]Shintani T,Klionsky DJ.Autophagy in health and disease:A double - edged sword[J].Science,2004,306(5698):990-995.
[25]Sehgal SN,Baker H,Vézina C.Rapamycin(AY -22,989),a new antifungal antibiotic.II.Fermentation,isolation and characterization[J].J Antibiot(Tokyo),1975,28(10):727-732.
[26]Erlich S,Alexandrovich A,Shohami E,et al.Rapamycin is a neuroprotective treatment for traumatic brain injury[J].Neurobiol Dis,2007,26(1):86 -93.
[27]Sadasivan S.Amino acid starvation induced autophagic cell death in PC-12 cells:evidence for activation of caspase-3 but not calpain-1[J].Apoptosis,2006,11(9):1573-1582.
[28]Alirezaei M,Kemball CC,Flynn CT,et al.Short-term fasting induces profound neuronal autophagy[J].Autophagy,2010,6(6):702 -710.
[29]Davis LM,Pauly JR,Readnower RD,et al.Fasting is neuroprotective following traumatic brain injury[J].J Neurosci Res,2008,86(8):1812-1822.
[30]曹丽丽,董 艳,徐婧婧,等.Wortmannin通过抑制癫痫大鼠海马自噬活性发挥神经保护作用[J].中国病理生理杂志,2010,26(8):1584 -1588.
[31]Scherz- Shouval R,Shvets E,Fass E,et al.Reactive oxygen species are essential for autophagy and specifically regulate the activity of Atg4[J].EMBO J,2007,26(7):1749-1760.
——雷帕霉素

