久效磷和林丹共同作用下对细小色矛线虫种群动态的毒性效应
王 摆,汝少国,康亦珂,田 雨
(中国海洋大学海洋生命学院,山东青岛266003)
久效磷和林丹共同作用下对细小色矛线虫种群动态的毒性效应
王 摆,汝少国**,康亦珂,田 雨
(中国海洋大学海洋生命学院,山东青岛266003)
采用联合暴露的方法研究久效磷和林丹共同作用下对细小色矛线虫种群动态的毒性效应。结果表明:久效磷和林丹联合暴露极显著降低了细小色矛线虫子一代和子二代种群增长率,具有剂量-效应关系;并导致子一代种群偏雌性化。与对照相比,Ⅰ(0.1μg/L久效磷和0.005μg/L林丹)、Ⅱ(1.0μg/L久效磷和0.05μg/L林丹)、Ⅲ(10.0μg/L久效磷和0.5μg/L林丹)联合暴露组子一代种群增长率分别降低了64.82%、74.90%、78.28%,联合暴露组Ⅳ(100.0μg/L久效磷和5.0μg/L林丹)子一代种群呈负增长;Ⅰ、Ⅱ联合暴露组子二代种群呈负增长。Ⅰ、Ⅱ、Ⅲ、Ⅳ联合暴露组的亲代总产卵量分别降低了68.27%、72.88%、80.81%和83.76%;Ⅰ、Ⅱ、Ⅲ联合暴露组的子代总产卵量分别降低了73.66%、78.67%和85.66%。此外,细小色矛线虫子一代和子二代卵的受精率和胚胎孵化率的降低、胚胎发育持续时间时间的延长、L1幼虫畸形率的升高与种群动态的变化密切相关。久效磷和林丹共同作用下对细小色矛线虫种群动态具有较强的毒性效应。
久效磷;林丹;细小色矛线虫;种群动态;毒性效应
农药种类和数量繁多,由于多种农药的同时使用,造成了水域严重的农药复合污染。如我国地表水中林丹的检出率高达83.9%[1],甚至水源地也检测到林丹、久效磷超标现象[2-3]。水域环境中的农药通过生物富集和食物链传递,对水生生物和人类的健康构成威胁。久效磷对金鱼和孔雀鱼精巢结构的损伤,可能影响其生殖能力[4-5]。林丹对绿虾(Neocaridina denticulata)的生殖力具有抑制作用[6]。林丹还可以抑制人类精子的顶体反应,影响精子受精作用[7]。农药对生物个体的生殖毒性作用可能对生物的种群动态产生不利的影响。大量的研究发现多种野生物种群数量的降低与农药污染有关。美国Apopka湖的DDE污染曾导致美洲短吻鳄的幼体数量在4年内降低了90%,迄今为止其种群数量还未恢复[8]。加利福利亚两栖类生物量的下降与该州农药的历史用量具有正相关关系[9]。英国水獭(L utra lutra)种群数量因有机氯农药污染而下降[10]。为了在个体、种群水平上综合探讨农药对生物种群动态的影响,本文选择具有个体小、生活史短、易于培养的细小色矛线虫(Chromadorina germanica)[11]为实验材料,研究久效磷和林丹共同作用下对细小色矛线虫子一代和子二代种群动态的毒性效应,为评价农药复合污染对水生生物种群动态的影响提供科学依据。
1 材料与方法
1.1 实验动物与培养
细小色矛线虫取自青岛栈桥潮间带(36°03′37.72″N;120°19′12.79″E)底泥,分离培养及培养基制作参照作者先期工作[11]。连续培养80个世代后用于实验,成虫体长(638.9±64.8)μm。
1.2 实验药品
久效磷纯品(Monocrotophos,MCP)为97.5%标准品(Labor Dr.Ehrenstorfer,Germany)。林丹纯品(Lindane,γ-BHC)为98.5%的标准品(Dr.Ehrenstorfer,GmbH上海梅特勒)。二甲基亚砜(DMSO)购自天津化学试剂有限公司生产的分析纯,用作林丹的助溶剂。
1.3 联合暴露实验方法
联合暴露实验参照Tominaga等的方法[12],实验采用6 cm的玻璃培养皿,每个皿15~20 mL培养基。设置4个久效磷和林丹联合暴露组:(Ⅰ)0.1μg/L久效磷和0.005μg/L林丹;(Ⅱ)1.0μg/L久效磷和0.05μg/L林丹;(Ⅲ)10.0μg/L久效磷和0.5μg/L林丹;(Ⅳ)100.0μg/L久效磷和5.0μg/L林丹。同时设置对照组和助溶剂对照组,以二甲基亚砜为助溶剂,浓度为0.1%(体积比)。每个组设置3个平行样,每个平行样各接入20条线虫的性成熟个体,雌雄各10条。解剖镜下定期(2 d一次)观察并记录总产卵量、受精卵的个数、畸形L1幼虫的数量、子一代幼虫和成虫数量、雌雄个体数量;每个组选取45个1细胞的卵,观察并记录胚胎发育持续时间和胚胎孵化率(见表1)。实验开始20 d后,挑取20条子一代性成熟个体,进行子二代暴露实验,观察指标同上。以上实验均在(20± 0.5)℃,避光条件下进行,实验重复1次。
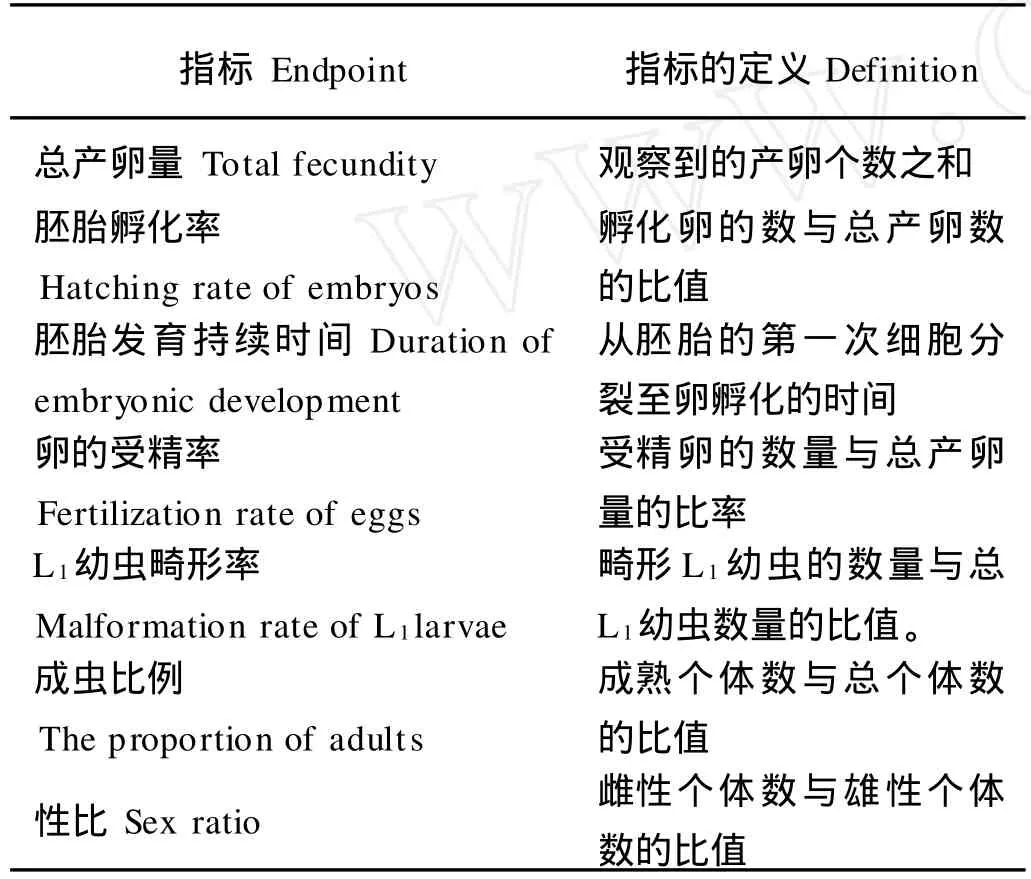
表1 种群动态变化指标与定义Table 1 The endpoints of population dynamics
受精率:受精卵的判断依据Tominaga的方法[12],是否受精根据形态判断:未受精的卵因细胞极性而呈圆形,受精的卵呈椭圆形。
内禀增长率(rm):根据内禀增长率的近似计算公式[13]。rm=(1/Tmin)ln(pNe)计算;其中,Tmin为最短世代时间,14 d;p为成体种群中雌性个体的比率;Ne每个雌体的平均总产卵量。
种群增长率(r):r=(lnNt-lnN0)/t,N0和Nt分别为实验开始和实验结束时种群密度,t=14 d。
1.4 数据处理
实验结果表示为:平均值±标准差。实验数据采用SPSS统计软件进行单因素方差分析,P<0.05为差异显著*,P<0.01为差异极显著**。
2 结果与分析
单因素方差分析表明,0.1%二甲基亚砜对照组所有观察指标与空白对照组的相比,均无显著差异(P> 0.05),表明助溶剂对实验结果没有影响。
2.1 久效磷和林丹对细小色矛线虫子一代种群动态的毒性效应
2.1.1 久效磷和林丹对细小色矛线虫繁殖的影响由图1a可见,久效磷和林丹联合暴露极显著降低了细小色矛线虫的总产卵量,与对照组相比Ⅰ、Ⅱ、Ⅲ、Ⅳ联合暴露组分别降低了68.27%、72.88%、80.81%和83.76%。同时久效磷和林丹联合暴露极显著降低了细小色矛线虫卵的受精率,Ⅰ、Ⅱ、Ⅲ、Ⅳ联合暴露组卵的受精率分别降低了20.42%、32.98%、29.44%、52.60%(见图1b)。
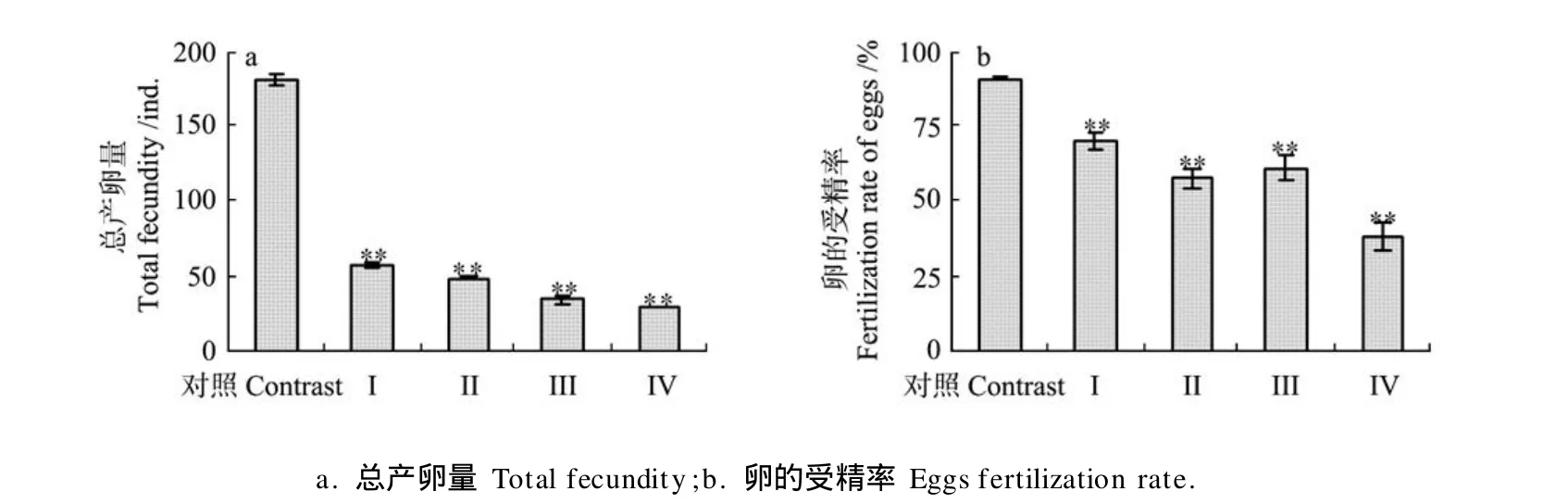
图1 久效磷和林丹对细小色矛线虫总产卵量和卵的受精率的影响Fig.1 Effect of MCP andγ-BHC on the total fecundity and fertilization rate of eggs ofC.germanica
2.1.2 久效磷和林丹对细小色矛线虫子一代发育的影响 单因素方差(P<0.01)分析表明,久效磷和林丹联合暴露极显著地影响了细小色矛线虫子一代胚胎的孵化,随着联合暴露浓度的升高,子一代胚胎孵化率逐渐降低,具有剂量-效应关系(见图2a),且极显著地延长了细小色矛线虫子一代胚胎发育时间,与对照组相比,Ⅰ、Ⅱ、Ⅲ、Ⅳ联合暴露组子一代胚胎发育时间分别延长了1.54、1.77、2.40和2.82 h(见图2b)。
此外,久效磷和林丹联合暴露导致了细小色矛线虫子一代幼虫畸形率的增加,其中与对照组相比联合暴露组Ⅱ、Ⅲ差异显著,Ⅳ差异极显著(见表2)。
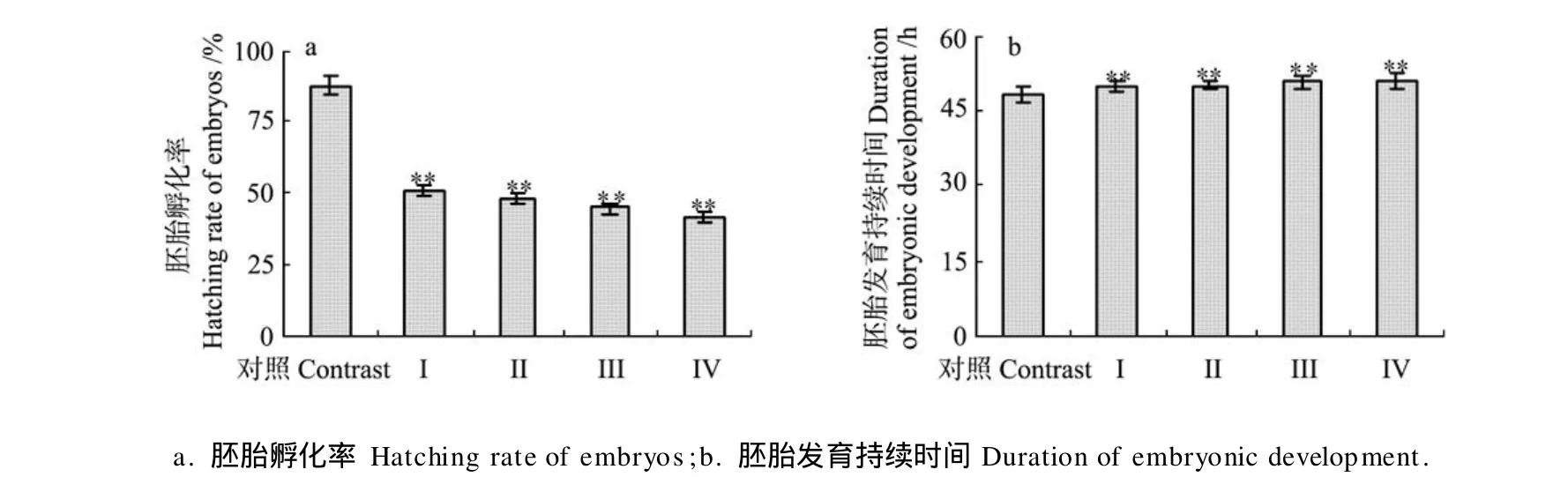
图2 久效磷和林丹对细小色矛线虫子一代胚胎孵化率和胚胎发育持续时间的影响Fig.2 Effect of MCP andγ-BHC on the hatching rate of embryos and duration of embryonic development ofC.germanicafirst offspring
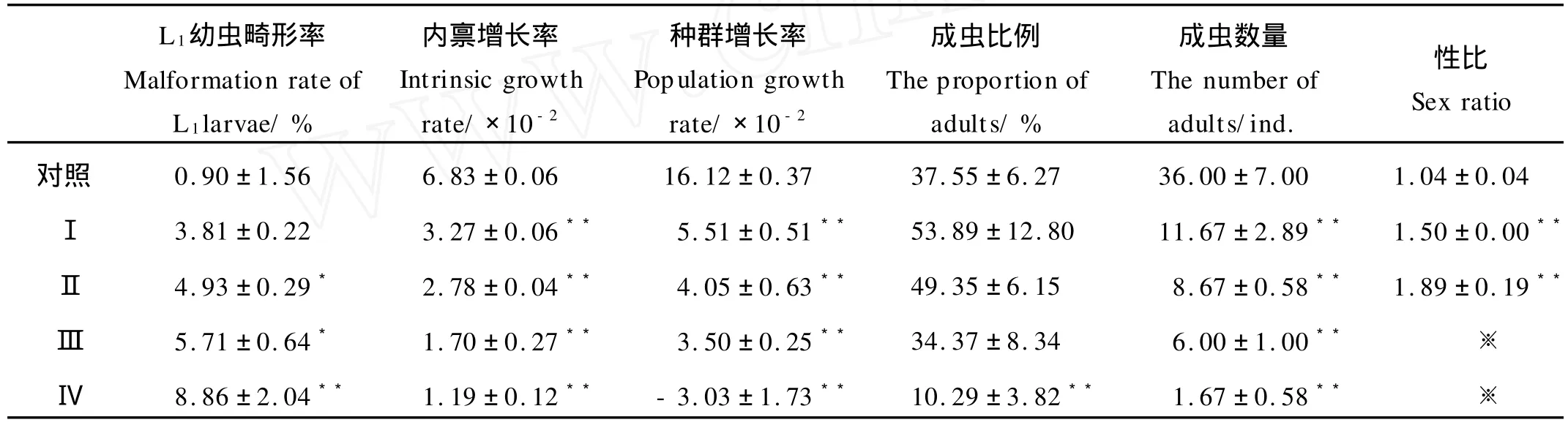
表2 久效磷和林丹对细小色矛线虫子一代种群生态学指标的影响Table 2 Effects of MCP andγ-BHC on ecological parameters ofC.germanicafirst offspring
2.1.3 久效磷和林丹对细小色矛线虫子一代种群动态的影响 单因素方差分析表明,随着久效磷和林丹联合暴露浓度的升高,细小色矛线虫子一代内禀增长率和种群增长率逐渐降低,与对照组相比差异极显著,其中联合暴露组Ⅳ子一代种群出现了负增长(见表2);子一代平均成虫数量显著降低,且有偏雌性化的趋势,但是Ⅰ、Ⅱ、Ⅲ联合暴露组对子一代成虫比例没有影响,而联合暴露组Ⅳ极显著降低了子一代成虫比例。
2.2 久效磷和林丹对细小色矛线虫子二代种群动态的毒性效应
2.2.1 久效磷和林丹对细小色矛线虫子代繁殖的影响
久效磷和林丹联合暴露极显著降低了细小色矛线虫子代的总产卵量和卵的受精率,与对照组相比,Ⅰ、Ⅱ、Ⅲ联合暴露组总产卵量和卵的受精率分别降低了73.66%、78.67%和85.66%;40.28%、53.57%、65.79%(见图3a,b)。Ⅳ子二代样本量少,无统计学意义。
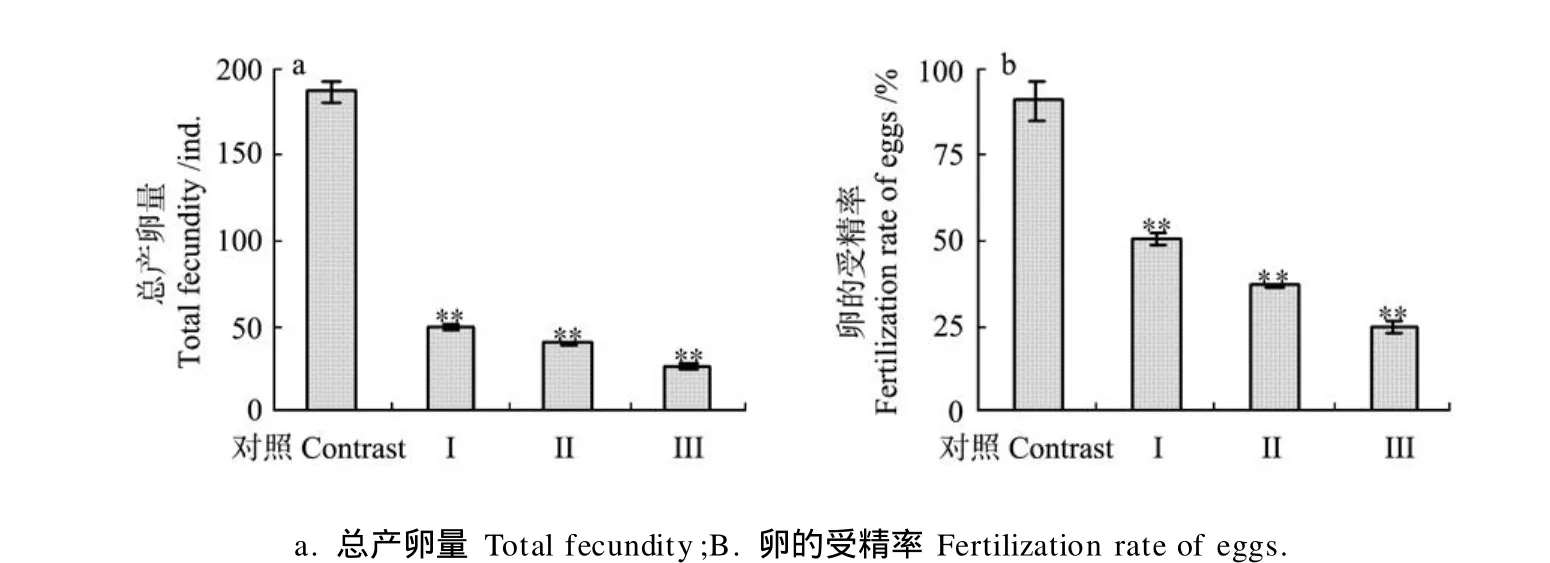
图3 久效磷和林丹对细小色矛线虫子代总产卵量和卵的受精率的影响Fig.3 Effect of MCP andγ-BHC on the total fecundity and fertilization rate ofC.germanicaoffspring
2.2.2 久效磷和林丹对细小色矛线虫子二代发育的影响 单因素方差分析表明,久效磷和林丹联合暴露极显著抑制了细小色矛线虫子二代胚胎的孵化(P< 0.01),与对照组相比Ⅰ、Ⅱ、Ⅲ联合暴露组的子二代胚胎孵化率分别降低了39.13%、40.34%、48.61%(见图4a);久效磷和林丹联合暴露极显著延长了细小色矛线虫子二代胚胎发育时间(见图4b),子二代幼虫的畸形率增加(见表3),Ⅰ、Ⅱ、Ⅲ联合暴露组胚胎发育时间分别延长了1.58、2.26和2.81 h。
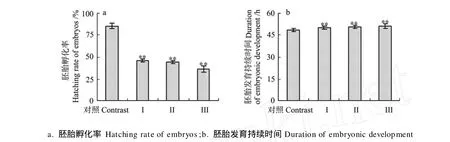
图4 久效磷和林丹对细小色矛线虫子二代胚胎孵化率和胚胎发育持续时间的影响Fig.4 Effect of MCP andγ-BHC on the hatching rate of embyros and duration of embryonic development of second generation offspring ofC.germanica
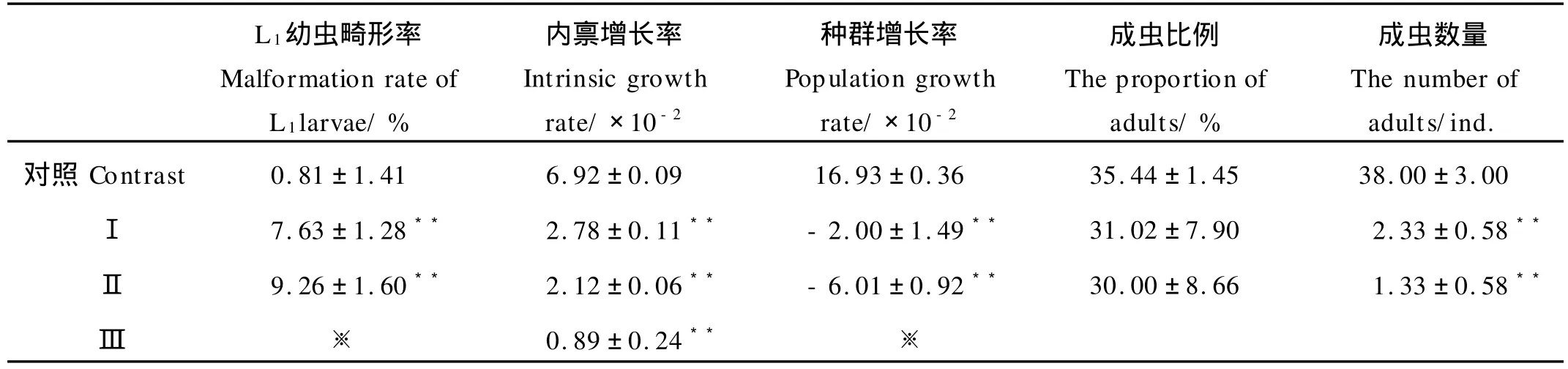
表3 久效磷和林丹对细小色矛线虫子二代种群生态学指标的影响Table 3 Effects of MCP andγ-BHC on ecological parameters of second generation offspring ofC.germanica
2.2.3 久效磷和林丹对细小色矛线虫子二代种群动态的影响 随着久效磷和林丹联合暴露浓度的升高,细小色矛线虫子二代内禀增长率和种群增长率呈极显著降低趋势,Ⅰ、Ⅱ联合暴露组的种群出现负增长(见表3),子二代平均成虫数量分别为2.33、1.33,呈极显著降低趋势,但是对子二代成虫比例却没有影响(见表3)。
3 讨论
久效磷具有潜在的环境激素活性,能够诱导金鱼卵黄原蛋白的合成与分泌[4],0.1 mg/L久效磷对斑马鱼具有世代繁殖毒性[14]。而BHCs已被美国EPA确认为1种环境雌激素,其中林丹可以诱导绿虾体内雌激素含量的增加和卵黄原蛋白的合成[7]。林丹的同系物β-BHC可以诱导孔雀鱼(Poecilia reticulata)和青鳉(Oryzias latipes)出现兼性现象[15]。Huang等发现0.1μg/L林丹可以造成雌性绿虾产卵量的显著降低[6]。由此可见,久效磷和林丹对水生生物具有较强的生殖毒性。
久效磷和林丹对生物个体的生殖毒性作用,可能对生物的种群动态产生不利的影响。久效磷和林丹联合暴露对细小色矛线虫种群动态的毒性效应,主要表现为生殖力、受精率、胚胎孵化率和发育等个体指标和种群增长率、内禀增长率和性比等种群指标的变化。而个体指标(生殖力、卵的受精率、胚胎孵化率、胚后发育等)与种群动态密切相关。Tominaga等报道NP、Bis A对秀丽隐杆线虫(Caenorhabditis elegans)生殖力的抑制作用,导致子代种群数量的降低[12];0.1 μmol/L有机锡类化合物对秀丽隐杆线虫卵的孵化的毒性作用,导致子代的数量下降至对照的20%~50%,并出现不正常的雄性[16]。由此可见,生殖力的降低是导致种群数量降低的主要原因之一。而种群数量的变化,又会影响个体指标的变化。Clark和Ghiselin等报道秀丽隐杆线虫种群密度的降低,雄性成虫数量减少,行动能力减弱[17-18],会减少两性成虫相遇的几率,最终可能导致线虫繁殖方式的改变,即从两性生殖变为孤雌生殖,繁殖方式的改变虽然可以使线虫更好的适应环境变化,但会导致卵的受精率和胚胎孵化率降低[19],幼虫畸形率升高,性别比例失衡,进而导致内禀增长率和种群增长率降低。内禀增长率综合考虑了各年龄段的存活率和一些生殖参数,例如第一次生殖时间、生殖频率、生殖力和生殖期历时等,可以用来检测污染物的毒性作用。Tietjen等发现海洋线虫细小色矛线虫和Diplolaimella puniceay的内禀增长率对河口沉积物的PCBs、PAH和重金属比较敏感,提出将海洋线虫的内禀增长率用作评价沉积物环境质量的指标[20]。Vranken和Heip发现铜显著抑制Diplolaimellaspec1的内禀增长率和净生殖力[21]。久效磷和林丹联合暴露后,细小色矛线虫的内禀增长率受到极显著的抑制。由此可见,海洋线虫的内禀增长率对污染物毒性作用比较敏感,可用于筛选污染物的种群毒性。
此外,欧共体饮水标准(EEC80/778)规定单个农药在饮水中的含量不得超过0.1μg/L[3]。我国生活饮用水卫生标准也规定林丹的浓度不得超过0.002 mg· L-1[22]。而本文研究发现0.1μg/L久效磷和0.005μg ·L-1林丹联合暴露使子一代和子二代的内禀增长率分别下降了52.15%,59.83%;子一代种群增长率下降了64.82%,子二代种群出现负增长。在低于欧共体和我国饮水标准规定的浓度下,久效磷和林丹对细小色矛线虫种群动态具有较强的毒性作用。由此可见,有必要通过更多的研究,来进一步确定我国生活饮用水中农药的卫生标准和海湾中农药的安全浓度。
综上所述,本文首次采用细小色矛线虫为实验材料研究久效磷和林丹共同作用下对细小色矛线虫种群动态的毒性效应。发现在接近环境浓度的久效磷和林丹联合暴露极显著降低了细小色矛线虫子一代和子二代的内禀增长率、种群增长率和成虫数量,并导致子一代种群偏雌性化。表明久效磷和林丹共同作用下对细小色矛线虫种群动态具有较强的毒性效应。
[1] Gao J J,Liu L H,Liu X R,et al.Occurrence and distribution of organochlorine pesticides-lindane,p,p’-DDT,and heptachlor epoxide-in surface water of China[J].Environment International, 2008,34:1097-1103.
[2] 杨超,佟延功,崔国权,等.西泉眼水库及周围地区林丹环境污染调查[J].中国公共卫生,2005,21(2):236.
[3] 康跃惠,张干,盛国英,等.固相萃取法测定水源地中的有机磷农药[J].中国环境科学,2000,20(1):1-4.
[4] 邴欣,汝少国,姜明,等久效磷对雄性金鱼的生殖毒性研究[J].中国海洋大学学报:自然科学版,2004,34(1):69-74.
[5] 史清毅,汝少国,邴欣.久效磷对雄性孔雀鱼生殖毒性研究[J].安全与环境学报,2007,7(3):4-9.
[6] Huang D J,Chen H C,Wu J P,et al.Reproduction obstacles for the female green neon shrimp(Neocaridina denticulata)[J]. Chemosphere,2006,64:11-16.
[7] Silvestroni L,Fiorini R,Palleschi S.Partition of the organochlorine insecticide lindane into the human sperm surface induces membrane depolarization and Ca2+influx[J].Biochem J,1997,321: 691-698.
[8] Semenza J C,Tolbert P E,Rubin C H,et al.Reproductive toxins and alligator abnormalities at Lake Apopka,Florida[J].Environmmental Health Perspectives,1997,105(10):1030-1032.
[9] Davidson C.Declining downwind:amphibian population declines in california and historical pesticide use[J].Ecological Applications,2004,14(6):1892-1902.
[10] Simpson V R,Bain M S,Brown R,et al.A long-term study of vitamin A and polychlorinated hydrocarbon levels in otters(L utra lutra)in south west England[J].Environmental Pollution, 2000,110(2):267-275.
[11] 王摆,汝少国,于子山,等.自由生活海洋线虫Chromadorina sp.的生活史研究[J].水生生物学报,2007,31(5):751-754.
[12] Tominaga N,Shiya K,Taisen I,et al.A mlti-gneration slblethal asay of penols uing the nematodeCaenorhabditis elegans[J]. Journal of Health Science,2003,49(6):459-463.
[13] Vrank G,Heip C.Calculation of the intrinsic rate of natural increase rm withRhabditis marina[J].Nematologica,1983,29: 468-477.
[14] 史清毅.久效磷对斑马鱼(Danio rerio)2世代繁殖的影响[D].青岛:中国海洋大学,2007.
[15] Wester P W.Histopathological effects of environmental pollutantsβ-HCH and methyl mercury on reproductive organs in freshwater fish[J].Comparative Biochemistry and Physiology Part C: Comparative Pharmacology,1991,100(1-2):237-239.
[16] Tominaga N,Mineko T,Shiya K,et al.A convenient sublethal assay of alkylphenol and organotin compounds using the nematode Caenorhabditis elegans[J].Journal of Health Science,2002,48 (6):555-559.
[17] Clark W C.Hermaphroditism as a reproductive strategy for metazoans some correlated benefits[J].N Z J Zool,1978,5(4): 769-780.
[18] Ghiselin M T.The evolution of hermaphroditism among animals [J].Q Rev Biol,1969,44(2):189-208.
[19] Andre P S.Evolution of the control of sexual identity in nematodes[J].Seminars in Cell&Developmental Biology,2007,18: 362-370.
[20] Tietjen J H,Lee J J.The use of free-living nematodes as a bioassay for estuarine sediments[J].Marine Environmental Research, 1984,11:233-251.
[21] Vranken G,Heip C.Toxicity of copper,mercury and lead to a marine nematode[J].Marine Pollution Bulletin,1986,17(10): 453-457.
[22] 国家环境保护总局环境工程评估中心.环境影响评价技术导则与标准汇编,地表水环境质量标准(GB 3838-2002)[S].北京:中国环境科学出版社,2005.
Abstract: Toxic effects of monocrotophos and lindane on the population dynamics ofChromaidorina germanicawere studied by usinga joint exposure method.It was found that the intrinsic growth rate and population growth rate of the first and second generation offsprings ofC.germanicawere decreased,even the population growth rate of the second offspring ofC.germanicawas below zero;after joint exposure to monocrotophos and lindane;the fecundity of parental and offsprings was significantly inhibited;the duration of the embryonic development of the first and second offsprings was extended;the hatching rate of embyros and the fertilization rate of the eggs of the first and second offsprings were decreased;malformation rate of L1larvae of the first and second offsprings was increased.The number of adults sharply declind.A feminization of the population of the first and second offsprings occurred after joint exposure to monocrotophos and lindane.The results suggested that monocrotophos and lindane had high toxicity to the population dynamics ofC.germanica,thus laying an experimental foundation for ecological risk assessment of monocrotophos and lindane.
Key words: monocrotophos;lindane;Chromaidorina germanica;population dynamics;toxic effect
责任编辑 于 卫
Toxic Effect of Monocrotophos and Lindane on the Population Dynamics of Chromaidorina germanica
WANGBai,RU Shao-Guo,KANG Yi-Ke,TIAN Yu
(College of Marine Life Sciences,Ocean University of China,Qingdao 266003,China)
X171.5
A
1672-5174(2011)06-055-06
国家自然科学基金项目(30671618)资助
2010-03-01;
2010-08-09
王 摆(1981-),男,博士生。研究方向:海洋生态毒理学。E-mail:william_turnur@hotmail.com
E-mail:rusg@ouc.edu.cn

