基于聚硫堇/纳米金固定酶的过氧化氢生物传感器
黄小梅,邓 祥,吴 狄
(四川文理学院化学与化学工程系,四川 达州 635000)
过氧化氢(H2O2)是许多生化反应的产物或中间产物,与许多生物过程有关,而且又是工业、生物、环境、临床诊断和食品检测分析中的重要组份,因此对H2O2含量的测定具有非常重要的意义.目前,对其进行定性或定量检测的常用方法有化学发光法[1]、荧光法[2]和电化学法[3-4]等方法.其中电化学方法,特别是酶电化学生物传感器,由于其方法简单、灵敏度高、专一性强等特点而被广泛应用于H2O2的测定.然而在酶电化学传感器的研制中,由于酶本身易失活且酶分子量大,酶的活性中心深埋在多肽结构内部,很难发生直接电子传递,因此如何有效地利用生物分子固定技术及固定材料来保持酶的活性、提高酶的固载量以及加速电子传递速率是制备性能优良的酶电化学传感器的关键问题.近年来的研究表明,电子媒介体以及纳米金属材料的引入能显著加速电子传输速率、增大生物分子的固载量以及提高传感器的灵敏度[5-7].
本实验首先在玻碳电极表面电聚合一层电子媒介体硫堇(PTH),再利用其表面的-NH2,通过静电作用和共价结合,吸附带负电的纳米金,从而形成具有比表面积大、吸附力强、生物相容好等优点的纳米金层[8-9],最后利用纳米金吸附带正电荷的过氧化物酶(HRP),从而制得HRP/nano-Au/PTH/GC传感器.
1 实验部分
1.1 仪器与试剂
仪器:CHI660C电化学工作站(上海辰华仪器公司);BRANSONIC200超声清洗仪(德国BRANSONICULTRASCHALL公司);FA1004N电子天平(上海菁海仪器公司);pHS-4C型酸度计(成都方舟科技开发公司).
试剂:硫堇(Thi,上海化学试剂公司);氯金酸(HAuCl4,Sigma公司);过氧化氢酶(HRP,Sigma公司);H2O2(浓度30%,分析纯),精确浓度经高锰酸钾标准溶液滴定,0.1 molL磷酸盐缓冲溶液(PBS),Na2HPO4-KH2PO4配制;其余试剂均为分析纯,实验用水均为二次蒸馏水.
1.2 纳米金的制备
金溶胶的制备参见文献[10]:取100 mL质量分数为1%的氯金酸,在剧烈搅拌下加热至沸腾后,迅速加入2.5 mL质量分数为1%的柠檬酸钠,继续搅拌,微沸15 min即可.所得金溶胶呈亮红色,于棕色瓶中4℃条件下保存.
1.3 传感器的制备
首先将玻碳电极(GC)依次用0.3 μm、0.05 μm的Al2O3粉末抛光成镜面,并依次用丙酮、NaOH 溶液(10%)、HNO3(1∶1)、二次蒸馏水超声清洗各5 min.将处理好的电极放入含0.05 molL硫堇(Thi)、0.1 molL的磷酸缓冲溶液(PBS,pH 6.0)中,先在1.5 V 下电沉积 10 min,再在-0.40 ~0.12 V(vs.SCE)的电位范围内,以50 mVs的速度循环扫描20圈后取出,在室温下放置晾干即得PTH/GCE电极[11].硫堇薄膜的沉积过程如图1所示.然后将电极侵入1.0 mL的纳米金溶胶中6 h,最后将该电极置于10 mgmL HRP溶液中在4℃条件下浸泡过夜,即制得HRP/nano-Au/PTH/GCE传感器.
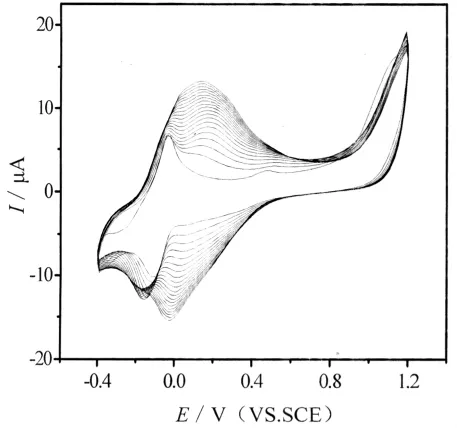
图1 玻碳电极上电沉积硫堇薄膜过程图
1.4 检测方法
采用三电极检测装置:饱和甘汞电极为参比电极,铂丝电极为对比电极,修饰电极为工作电极,在优化的实验条件下,于0.1 molL PBS(pH=6.0)缓冲溶液中,进行循环伏安和计时电流测试,记录该传感器对H2O2的安培响应.
2 结果与讨论
2.1 传感器的电化学表征
采用循环伏安法(CV)对电极的修饰过程进行表征,图2是电极在电位区间为 -0.4~0.0 V,0.1molLPBS(pH=6.0)的缓冲溶液中的循环伏安图.由图2可知,当裸玻碳电极(a)修饰上PTH后,可观察到一对Thi的氧化还原峰(b),说明Thi成功聚合于电极表面,形成良好的导电膜,并能发生较好的可逆反应.当纳米金修饰到PTH/GC表面后,电极的氧化还原峰电流进一步增大(c),这是因为纳米金有良好的导电性,同时也能很好地传递电子.最后当HRP被吸附到纳米金上,氧化还原峰电流明显降低(d),这是由于HRP是生物大分子,阻碍了电子的传递.

图2 不同修饰电极的循环伏安表征图
2.2 传感器的电化学特性
图3是该生物传感器对H2O2的循环伏安响应.由图3可见,当向空白底液中加入0.7 mmolL H2O2时,还原电流明显增加,氧化电流略微降低(如图3曲线b),显示出明显的电催化特征.然而,没有HRP存在的修饰电极对H2O2几乎没有电化学响应.这就说明对H2O2有明显电催化还原作用的是固定在修饰电极上的HRP,而Thi只是该反应体系的有效电子转移介体.该生物传感器的反应机理如下[12]:
H2O2+HRP(Red)→HRP(Ox)+H2O2,
HRP(Ox)+Thi(Red)→HRP(Red)+Thi(Ox),
Thi(Ox)+H++2e→Thi(Red).
其中HRP(Red)和 HRP(Ox)分别表示 HRP的还原态和氧化态;Thi(Red)和Thi(Ox)分别表示硫堇的还原态和氧化态.
2.3 实验条件的优化
为获得性能优良的生物传感器,我们对pH值和工作电位进行了优化.pH值不仅会影响生物酶的催化活性和稳定性,而且也会影响硫堇的电化学行为.因此对pH值的优化显得尤为重要.当pH值为6.0时,该生物传感器对H2O2的响应出现最大值.因此,我们选用pH值为6.0的PBS作为支持电解质.
生物传感器工作电位确定在-0.5~0.0 V之间进行.实验表明,随着工作电位的负向增大,响应电流逐渐增大,但考虑到在过高的负电位下,溶液中共存的其它电活性物质也越容易在电极上直接被还原而产生干扰,且硫堇的还原峰电位也在-0.25 V左右,所以本实验选择-0.25 V作为工作电位.

图3 传感器对H2 O2响应的循环伏安图
2.4 传感器的计时电流响应
在优化后的最佳实验条件下,该传感器对不同浓度H2O2的计时电流曲线如图4所示.从图4中可看出,随着H2O2浓度的增大,响应电流也不断增大,响应电流与H2O2浓度在1.4×10-6~4.26 ×10-3molL范围内呈现良好的线性关系.线性回归方程为:Ip(μA)=0.9818[H2O2](mmolL)– 1.6901,相关系数 R=0.9993(n=23),检测下线为4.0 ×10-7molL(SN=3).该传感器对H2O2响应迅速,在5 s内可达到稳态电流的95%,这是由于实验采用层层自组装技术组装的膜层厚度相当薄,有利于电子的传输.另外是因为酶的氧化还原中心被深埋在酶蛋白分子里面,它与电极表面直接的电子传递进行困难,电子传递速率缓慢,而硫堇的引入则为酶的活性中心和电极之间的电子传递架起了桥梁,起到了加速电子传递的作用,因而大大地缩短了响应时间.

图4 传感器对H2 O2的计时电流响应曲线
2.5 干扰实验
在含3.5 ×10-4molL H2O2的 PBS 中,分别加入7.0 ×10-4molL的6种干扰物质,测定其对传感器响应信号的干扰结果如表1所示.实验结果表明,这些物质对传感器的测定干扰电流信号均在±3%之内,没有明显的干扰.这主要归因于我们选择了较低的工作电位(-0.25 V)来检测H2O2.

表1 干扰实验的测定
2.6 传感器的重现性及稳定性
该生物传感器对浓度为3.5×10-4molL的H2O2平行测定10次,所得相对标准偏差为4.6%,说明该生物传感器具有较好的重现性.
3 结语
本实验以电聚合、静电吸附和共价结合制得一种过氧化氢传感器.该传感器以硫堇作为过氧化物酶催化还原过氧化氢中的电子媒介体,加速催化还原过程中的电子传递,减少了催化还原过程中的其它氧化物的干扰,且提高了传感器的灵敏度和响应速率.
[1]Hanaoka S,Lin JM,Yamada M.Chemiluminescent flow sensor for H2O2based on the decomposition of H2O2catalyzed by cobalt(II)-ethanolamine complex immobilized on resin[J].Anal.Chim.Acta,2001,426:57-64.
[2]Czochra M P,Wideňska A.Spectrofluorimetric determination of hydrogen peroxide scavenging activity[J].A-nal.Chim.Acta,2002,452(2):177-184.
[3]Wang L,Wang E K.A novel hydrogen peroxide sensor based on horseradish peroxidase immobilized on colloidal Au modified ITO electrode[J].Electrochem.Commun,2004,6:225 -229.
[4]Zhao G,Xu J J,Chen H Y.Fabrication characterization of Fe3O4multilayer film and its application in promoting direct electron transfer of hemoglobin[J].Electrochem.Commun,2006,8:148-154.
[5]Mehmet S,Emre C,Abasiyanik M F.Amperometric hydrogen peroxide biosensor based on covalent immobilization of horseradish peroxidase on ferrocene containing polymeric mediator[J].Sensors and Actuators B.2010,145:444-450.
[6]Wu SA,LiQ F,Hui Y M,etal.Amperometric H2O2biosensor based on poly-thionine nanowire/HRP/nano-Au - modified glassy carbon electrode[J].Sensors and Actuators B,2008,129:779 -783.
[7]Meral T S,Gokdogan O Z,Ahmet G,et al.Amperometric glucose biosensor based on gold-deposited polyvinylferrocene film on Pt electrode[J].Biosensors and Bioelectronics,2006,21:1719 -1726.
[8]Daniel M C,Astruc D.Gold Nanoparticles:assembly,supramolecular chemistry,quantum-size-related properties,and applications toward biology,catalysis,and nanotechnology[J].Chem.Rev,2004,104:293 -346.
[9]赵红秋,林琳,唐季安,等.利用纳米金颗粒增强DNA探针在传感器上的固定程度和识别能力[J].科学通报,2001,46(4):5-7.
[10]Frens G.Controlled nucleation for the regulatio of the particle size in monodisperse gold suspensions[J].Nature Physci,1993,241:20 -22.
[11]安海珍,袁若,柴雅琴,等.基于聚硫堇、DNA/纳米银复合物共修饰癌胚抗原免疫传感器的研究[J].化学学报,2008,66(6):633 -638.
[12]Durliat H,Courteix A,ComtatM.Reactions of horseradish peroxidase on a Platinum cathode[J].Bioelectrochem Bioenerg,1989,22(3):197 -209.

