大鼠白念珠菌支气管肺感染时肺组织Toll样受体2的表达及意义
林莉 王莉 周洋洋 陈耀华 孟新丽 康健
(中国医科大学第一临床医院呼吸内科呼吸疾病研究所,沈阳 110001)
支气管肺念珠菌感染常发生在免疫功能低下的患者,近年来,随着免疫功能低下的患者的增多,支气管肺念珠菌感染的患病率和死亡率也不断升高。念珠菌感染的发生及加重与机体的免疫功能有着密切关系,作为天然免疫受体中的Toll样受体2(Toll like receptor2,TLR2)在白念珠菌感染中的作用受到关注。有研究显示TLR2基因缺陷鼠具有抵御播散性白念珠菌感染的发生[1]。也有研究认为TLR2的表达,能够激活针对白念珠菌感染的免疫反应,对抗感染[2]。TLR2在支气管肺念珠菌感染的发生中可能起到较重要的调节作用,对此,本研究通过建立白念珠菌支气管肺感染大鼠模型,观察白念珠菌支气管肺感染后肺组织中TLR2水平的表达及变化,探讨TLR2在白念珠菌支气管肺感染发生和发展中可能的作用,为研究念珠菌肺部感染的发病机制及防治提供依据。
1 材料和方法
1.1 材料
6周龄SD大鼠36只,雌雄不拘,体重 (250±50)g,由中国医科大学动物部提供。标准白念珠菌菌株(编号070908853)由中国医科大学第一附属医院检验科微生物室提供。TLR2抗体试剂盒购自北京中杉金桥生物技术有限公司。
1.2 方法
实验动物分组 大鼠随机分为对照组 (指免疫功能正常,用生理盐水进行支气管肺灌注)、免疫低下组(指免疫功能受抑制后,用生理盐水进行支气管肺灌注)和感染组 (指免疫功能受抑制后,用白色念珠菌悬液进行支气管肺灌注),每组各12只。
白念珠菌混悬液的制备[3]取标准白念珠菌菌株,使用沙堡培养基在28℃真菌培养箱传代培养一代,使用浊度法将白念珠菌混合配制成混悬液,使用浊度计调整菌量约为 (1~5)×108CFU/mL。
免疫功能低下动物模型建立 参照文献描述的方法[4-5]用醋酸氢化可的松80 mg/kg,隔日1次,共7次给与大鼠皮下注射,成功制成免疫低下模型;正常组于相同时间给予同等剂量的生理盐水皮下注射。
感染动物模型建立 参照文献描述方法[5]。成功建立动物免疫功能低下模型后的第2天开始,用4%水合氯醛 (0.3 mL/100 g)腹腔注射麻醉动物,麻醉成功后,感染组经气管插管注射白色念珠菌混悬液0.2 mL,正常组及免疫低下组经气管插管注射同等剂量的生理盐水。每天观察大鼠的运动、进食、饮水、毛发、呼吸、精神状态等。感染组表现为倦怠、萎靡、不嗜食水、毛发蓬乱、呼吸急促。
分离肺组织 接种后第3天和第7天分别随机选取各组6只大鼠,解剖胸腔,摘取肺组织,约取0.5 cm ×0.5 cm ×0.4 cm 右肺下叶置于 4%多聚甲醛固定液中,脱水,固定,制成切片,待免疫组织化学染色。
观察指标 ①肺组织肉眼和显微镜下变化:分离肺组织后,首先肉眼观察各叶肺组织的大体变化。取右下叶肺组织,生理盐水冲洗5次,经固定、脱水、透明、浸腊、包埋、切片等过程制成石蜡切片,行常规HE染色及PAS染色,显微镜下观察肺组织炎症反应。②免疫组织化学法检测肺组织TLR2的表达:应用免疫组织化学染色法检测肺组织TLR2蛋白表达,Image-pro plus 6.0图像分析系统测定肺组织TLR-2阳性细胞的积分光密度 (integral optical density,IOD)值,以IOD值反映肺组织切片中相应阳性物质的表达程度。
1.3 统计学分析
计量资料均以(±s)表示,使用SPSS 13.0统计软件进行分析,组内比较采用独立样本的t检验,组间的比较应用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 肺组织病理学结果
大体观察 对照组肉眼观察肺组织形态正常,表面光滑呈粉红色,边缘锐薄,触之质地均匀无硬结。免疫低下组肉眼观察肺组织表面光滑,粉红色,边缘锐薄,触之质地均匀,无硬结。感染组肉眼观察肺组织充血,表面可见多个凸凹不平、大小不一的灰白色病灶,质韧,第7天较第3天严重。
HE染色观察(见图1~6) 对照组HE染色显微镜下见肺泡结构清晰完整,无炎症细胞浸润,第3天和第7天肺组织没有明显的区别。免疫功能低下组HE染色显微镜下见肺泡结构清晰完整,无炎症细胞浸润,第3天和第7天肺组织没有明显的区别。感染组HE染色显微镜下见肺组织内多个坏死区域,界限欠清晰,病灶之间有融合,肺泡结构消失,肺泡腔及间质可见大量炎症细胞浸润。
2.2 肺组织PAS染色结果
对照组和免疫低下组第3天和第7天肺组织内均未观察到念珠菌孢子和菌丝;感染组第3天和第7天肺组织内可见大量念珠菌孢子(见图7)。
2.3三组肺组织TLR2蛋白表达及比较(见图8~13)
①感染组第3天:肺组织TLR2蛋白表达的IOD值 (3.84±0.87)×104与其他两组比较明显增高,具有统计学差异 (P<0.05),免疫低下组肺组织TLR2蛋白表达的IOD值(2.30±0.35)×104与对照组 (2.39±0.16)×104无统计学差异 (P>0.05)。②感染组第7天:肺组织TLR2蛋白表达的IOD值 (5.06±1.32)×104与其他两组比较明显增高,具有统计学差异 (P<0.05),免疫低下组肺组织TLR2蛋白表达的IOD值 (2.17±0.48)×104与对照组 (2.30 ±0.27)×104比较无统计学差异 (P>0.05)。③对照组、免疫低下组第3天与第7天组内比较均无统计学差异 (P>0.05);感染组第7天TLR2表达与第3天比较,无统计学差异 (P>0.05)(见表1)。④三组不同时间肺组织TLR2蛋白表达的免疫组织化学染色结果:TLR2的表达以细胞膜或细胞浆内出现棕黄色颗粒为阳性,对照组和免疫功能低下组大鼠肺巨噬细胞、支气管上皮细胞和少量肺泡间隔细胞胞浆有TLR2轻度表达,呈棕黄或浅黄细线型染色,局灶性散在分布。感染组肺组织内棕褐色颗粒明显增加。
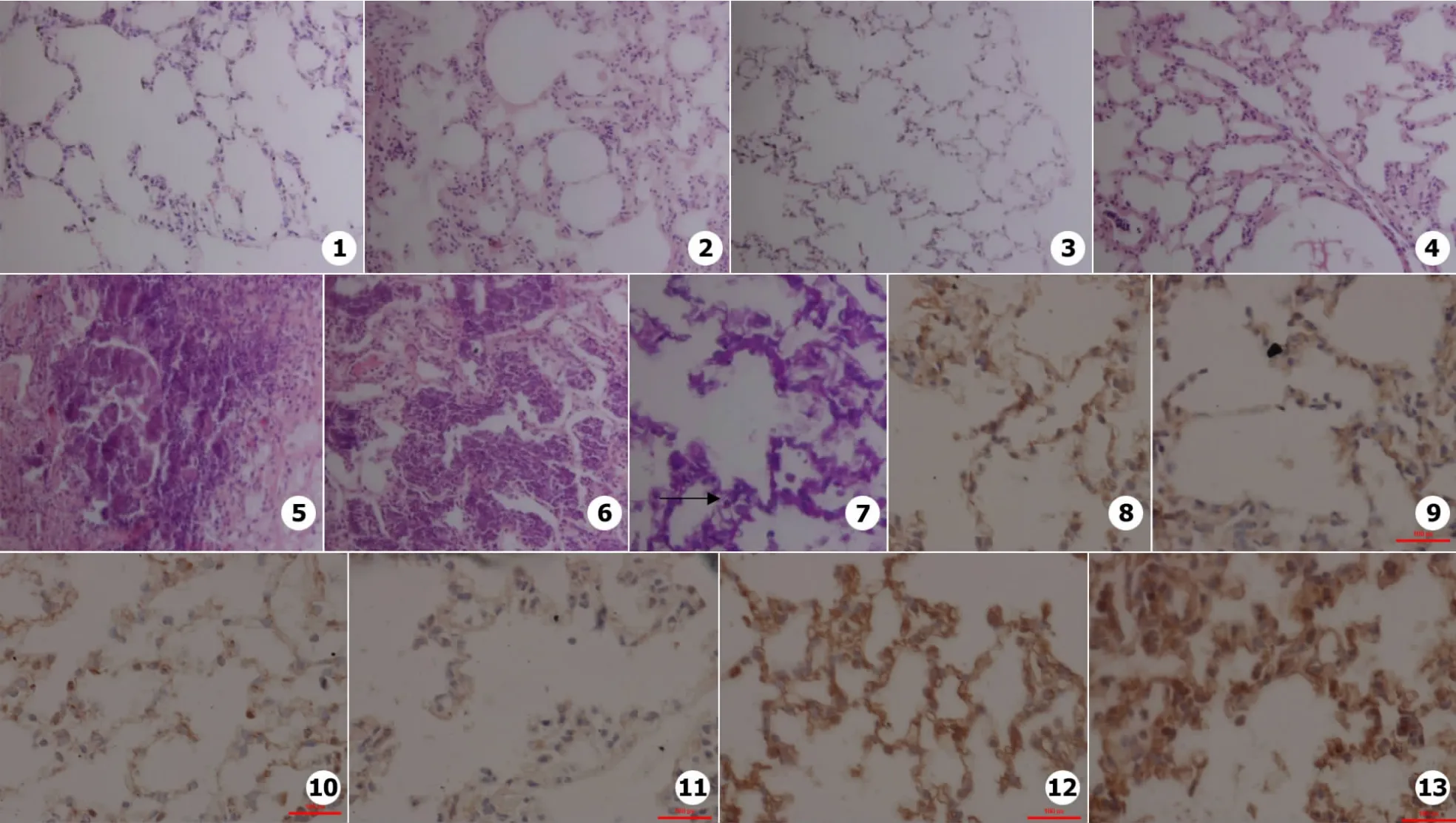
图1 正常组第3天HE染色(×40) 图2 正常组第7天HE染色(×40) 图3 免疫功能低下组第3天HE染色(×40) 图4 免疫功能低下组第7天HE染色(×40) 图5 感染组第3天HE染色(×40) 图6 感染组第7天HE染色(×40) 图7 感染组肺组织PAS染色(×200) 图8 正常组第3天免疫组化(×40) 图9 正常组第7天免疫组化(×40) 图10 免疫功能低下组第3天免疫组化(×40)图11 免疫功能低下组第7天免疫组化(×40) 图12 感染组第3天免疫组化(×40) 图13 感染组第7天免疫组化(×40)Fig.1 HE-stained tissue in the control group on day 3(×40)Fig.2 HE-stained tissue in the control group on day 7(×40) Fig.3 HE-stained tissue in the immunodeficiency group on day 3(×40)Fig.4 HE-stained tissue in the immunodeficiency group on day 7(×40)Fig.5 HE-stained tissue in the infected group on day 3(×40)Fig.6 HE-stained tissue in the infected group on day 7(×40) Fig.7 PAS-stained tissue in the infected group(×200)Fig.8 Immunohistochemistry-stained tissue in the control group on day 3(×40) Fig.9 Immunohistochemistry-stained tissue in the control group on day 7(×40)Fig.10 Immunohistochemistry-stained tissue in immunodeficency group on day 3(×40)Fig.11 Immunohistochemistry-stained tissue in immunodeficency group on day 7(× 40)Fig.12 Immunohistochemistry-stained tissue in the infected group on day 3(×40)Fig.13 Immunohistochemistry-stained tissue in the infected group on day 7(×40)
表1各组TLR2表达的IOD值(×104)(±s)Tab.1The IOD of TLR2 in each group(×104)(x珋±s)
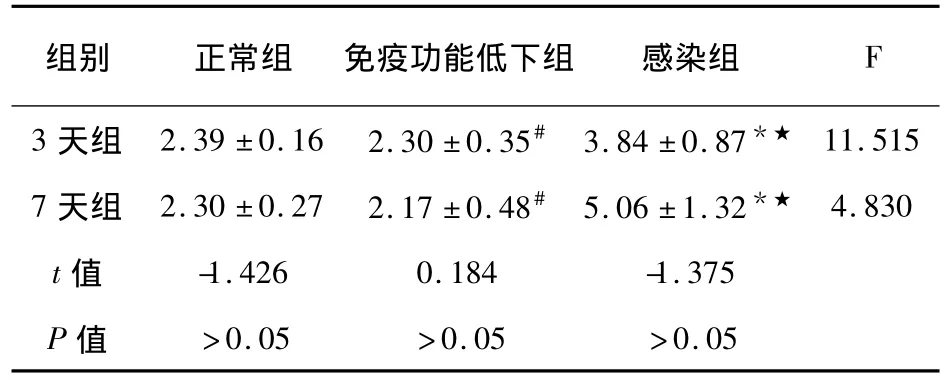
表1各组TLR2表达的IOD值(×104)(±s)Tab.1The IOD of TLR2 in each group(×104)(x珋±s)
注:#.与正常组比较P >0.05;*.与正常组比较 P <0.05;★.与免疫功能低下组比较各组比较P<0.05
组别 正常组 免疫功能低下组 感染组F 3 天组 2.39 ±0.16 2.30 ±0.35# 3.84 ±0.87*★>0.05 >0.05 >0.05 11.515 7 天组 2.30 ±0.27 2.17 ±0.48# 5.06 ±1.32*★ 4.830 t值 -1.426 0.184 -1.375 P值
3 讨 论
Toll样受体 (Toll-like receptors,TLRs)是重要的天然免疫模式识别受体 (Pattern recognition receptors,PPRs)。TLRs是Johnston等学者早在1984年由果蝇体内发现的一种信号转导蛋白质,当时研究结果发现,当果蝇缺失TLRs功能时,明显表现出对真菌感染的易感性,研究证明了TLRs具有介导抗真菌感染的重要作用[6-7]。TLRs是细胞膜表面Ⅰ型跨膜蛋白的受体,可以识别多种病原相关分子模 式 (Pathogen-associated molecular patlems,PAMPs),通过跨膜结构将病原相关分子刺激信号转入细胞内,经由髓样分化因子88(Myeloid differentiation factor 88,MyD88)依赖信号传导途径和MyD88非依赖信号转导途径产生复杂的级联信号反应导致核因子-κB(Nuclear factor-κB,NF-κB)等转录因子活化,引起多种炎症介质的合成和释放,启动针对病原微生物的天然免疫和获得性免疫。目前已发现TLRs家族至少有13个成员,其中TLR4和TLR2是人类TLRs家族成员中表达范围最广、识别病原微生物及其产物种类最多的分子,在真菌等多种微生物所致的感染中起到重要的免疫防御等作用。
白念珠菌是寄殖人体皮肤、黏膜表面的寄生菌,一般不致病。当机体免疫功能低下时,口鼻咽部黏膜的定植念珠菌可以侵入支气管或肺内引起感染,因此念珠菌常常被称为条件致病性真菌。念珠菌是目前院内感染性疾病中重要的一种条件致病性真菌,念珠菌引起的深部感染,特别是肺部感染,死亡率较高。
机体免疫功能降低是导致念珠菌侵袭深部感染的关键因素,天然免疫具有监视、识别和清除病原微生物入侵作用,是保护宿主免除感染侵害的第一道屏障。TLRs作为重要的PPRs在支气管肺念珠菌感染时的表达以及在炎症的发生和发展中的作用值得探讨。TLRs中以TLR4和 TLR2在抗真菌感染免疫的作用最为重要。TLR4在抵御真菌感染方面的作用尚有争议。TLR2具有介导致炎因子和抑炎因子分泌的双重作用,在对念珠菌感染的免疫调节作用还存在着广泛的争议。
本研究通过对免疫功能低下大鼠支气管肺念珠菌感染的动物模型的研究,观察念珠菌支气管肺感染时肺组织TLR2表达及其变化情况。研究结果首先看到,在感染后的第3天,大鼠肺组织无论大体肉眼外观,还是病理切片HE染色均看到肺组织炎症明显,并随着感染时间的延长,炎症程度也在加重(感染的第7天)。在感染的第3天,肺组织的TLR2表达明显增高,与对照组和免疫低下非感染组比较,具有统计学意义;感染的第7天,肺组织的TLR2表达也随着炎症程度的加重而表达增高,与对照组和免疫低下非感染组比较有统计学差异。本研究结果显示支气管肺念珠菌感染时肺组织TLR2高表达,并随着感染程度的加重而增高,提示了TLR2参与了支气管肺念珠菌感染的炎症反应,推测TLR2的高表达可能在引起炎症和放大炎症中起到免疫介导作用。
TLR2在感染性疾病,特别在肺部感染时表达水平如何以及高表达在感染中起到保护作用还是介导炎症的放大等,其研究结果不尽相同。有研究显示:在肺炎链球菌脑膜炎小鼠模型中,TLR2受体缺失,可见到脑内链球菌清除能力明显下降,结果导致脑膜炎感染的加重和提早死亡,提示TLR2高表达可以通过免疫功能杀灭链球菌,抵御链球菌感染的加重[8-9]。还有在肺炎链球菌肺炎的鼠模型研究中TLR2受体的缺失减弱了早期肺内炎症反应,但是并没有影响肺内肺炎链球菌的清除,推测肺炎链球菌的肺内感染可能存在TLR2以外的受体介导的免疫反应[10]。鲍曼不动杆菌肺炎的鼠模型,TLR2基因缺失时,在炎症的早期炎症介质明显增高,之后肺内鲍曼不动杆菌明显减少,推测TLR2高表达,可能消弱肺部早期的炎症反应,但是阻碍肺内细菌的清除[10]。Alves-Filho等[11]研究揭示了TLR2的高表达在细菌感染中起到负面作用。这项研究结果显示:在脓毒血症小鼠模型,将TLR2基因敲除后,能够增强宿主的抗感染免疫功能,延长小鼠的存活时间。研究认为,在脓毒血症时,抑制或下调TLR-2的表达可以增强宿主的抗感染免疫能力,增加脓毒血症的存活率[12]。TLR2在念珠菌感染时的表达和抗感染中的作用研究结果也不尽一致,有些研究认为白念珠菌诱导的TLR2信号转入,是通过介导白介素10(infection-10,IL-10)产生增加和CD4+CD25+调整 T 细胞 (regulatory T cell,Treg)的增殖作用增强[13],而抑制机体对于念珠菌吞噬和杀伤等免疫反应,结果使感染加重。Treg细胞水平的增强可以促使播散性白念珠菌感染加重,敲除Treg细胞能够减弱念珠菌感染的播散[14-15]。有些研究显示,TLR2基因缺陷鼠更能够抵御播散性白念珠菌感染,这与TLR2基因缺陷后,IL-10分泌明显减少,Treg水平明显降低,从而使巨噬细胞的趋化功能明显增强有关[1]。Netea 等[14]研究发现白念珠菌菌丝被TLR2识别后通过诱导IL-10的高分泌来抑制免疫反应,使条件致病性念珠菌逃避机体免疫杀伤而致病。
TLR2能够识别白念珠菌细胞壁上的β-葡聚糖,通过跨膜结构将刺激信号转导入细胞内,激活NF-κB等转录因子,导致炎症和抗炎症细胞因子、趋化因子等释放,参与免疫炎症反应[1,15]。本研究显示白念珠菌支气管肺感染后,肺组织TLR2呈现高表达,并随着炎症程度的加重而增高。提示在念珠菌引起的支气管肺感染时,肺组织TLR2呈现高表达,TLR2的高表达可能参与念珠菌感染的炎症反应,在炎症的发生和加重中起到一定的促进作用。但是本研究仅仅局限于几只动物实验,其研究结果并不能反映人体复杂条件下真正TLR2的表达水平,而且TLR2在白念珠菌引起的支气管肺感染中的炎症反应中介导的信号传导径路,和诸多炎症因子或致炎因子表达特点是相当复杂的免疫调控过程,并且受许多因素和个体差异的影响,这些有待于今后的不断探究。相信,随着对于TLR2在念珠菌感染中作为非特异性免疫反应的重要受体的作用被明确,可能成为将来治疗深部念珠菌感染的新靶点。
[1]Netea MG,Sutmuller R,Hermann C,et al.Toll-like receptor 2 suppresses immunity againstCandida albicansthrough induction of IL-10 and regulatory T cells[J].J Immunol,2004,172(6):3712-3718.
[2]Villamon E,Gozaibo D,Roig P,et al.Toll-like receptor 2 is dispensable foracquired hostimmuneresistancetoCandida albicansin a murine model of disseminated candidiasis[J].Microbes Infect,2004,6(6):542-548.
[3]Selsted ME,Szklarek D,Ganz T,et al.Activity of rabbit leukocyte peptides againstCandida albicans[J].Infect Immun,1985,49(1):202-206.
[4]马壮,钱桂生,黄桂君,等.免疫功能低下Wistar大鼠白念珠菌肺炎模的建立[J].中华微生物学和免疫学杂志,2001,21(5):569-573.
[5]van der Graaf CA,Netea MG,Verschueren I ,et al.Differential cytokine production and Toll-Like receptor signaling pathways byCandida albicansblastoconidia and hyphae[J].Infect Immun,2005,73(11):7458-7464.
[6]St Johnston D,Nusslein-Volhard C.The origin of pattern and polarity in the drosophila embryo[J].Cell,1992,68(2):201-219.
[7]Lemaitre B,Nicolas E,Michaut L,et al.The dorsoventral regulatory gene cassette spatzle/toll/cactus controls the potent antifungal response in drosophila adults[J].Cell,1996,86(6):973-983.
[8]Tessarolli V,Gasparoto TH,Lima HR,et al.Absence of TLR2 influences survival of neutrophils after infection withCandida albicans[J].Med Mycol,2010,48(1):129-140.
[9]Gil ML,Gozalbo D.Role of Toll-like receptors in systemicCandida albicansinfections[J].Front Biosci,2009,14:570-582.
[10]Knapp S ,Wieland CW,Florguin S,et al.Differential roles of CD14 and Toll-like receptors4 and 2 in murine acinetobacter pneumonia[J].Am J Respir Crit Care Med,2006,173(1):122-129.
[11]Alves-Filho JC,Freitasa A,Souto FO,et al.Regulation of chemokine receptor by Toll-like receptor 2 is critical to neutrophil migration and resistance to polymicrobial sepsis[J].Proc Natl Acad Sci USA,2009,106(10):1018-1023.
[12]Netea MG,Van der Meer JW,Kullberg BJ.Toll-like receptors as an escape mechanism from the host defense[J].Trends Microbiol,2004,12(11):484-488.
[13]Ferreira KS,Bastos KR,Russo M,et al.Interaction between Paracocciioides brasiliensis and Pulmonary dendritic cells induces interleukin-10 production and Toll-like receptor-2 expression:possible mechanisms of susceptibility[J].Infect Dis,2007,196(7):1108-1115.
[14]Netea MG,Gow NA,Munro CA,et al.Immune sensing ofCandida albicansrequires cooperative recognition of mannans and glucans by lectin and Toll-like receptors[J].J Clin Invest,2006,116(6):1642-1650.
[15]Li X,Qin J.Modulation of Toll-interleukin 1 receptor mediated signaling[J].J Mol Med,2005,83(4):258-266.

