骨髓间充质干细胞移植大鼠缺血心肌后GATA-4 mRNA的表达
黄献平,郑景辉,袁肇凯*,李勇华,王丽萍,简维雄,孙贵香
(湖南中医药大学中医诊断学国家重点学科,国家中医药管理局病理生理实验室,湖南省高校重点实验室,湖南 长沙 410208)
心肌缺血性疾病一直是临床治疗的难点。心肌缺血引起心肌细胞坏死、凋亡,造成心肌数目减少,心室重构促使心力衰竭发生。通常认为心肌细胞是终末分化细胞,缺乏增殖分化能力,损伤后不能再生。近年来研究表明,通过MSCs移植改善缺血心肌功能,重建梗死心肌丧失的心肌细胞以治疗缺血性心脏病,显示有良好的临床应用前景,已成为国内外心血管病研究领域的热点[1-3]。 GATA-4 基因是心脏前体细胞的最早期标志之一,调节心肌细胞的发生、分化及心脏前体细胞形成线状肌管。本研究通过观察MSCs移植于大鼠缺血心肌后,心脏早发基因GATA-4 mRNA的表达,探讨干细胞向心肌细胞分化的分子基础,并为深入研究干细胞移植机制提供实验依据。现将实验方法及结果报道如下。
1 材料与方法
1.1 材料
1.1.1 动物 清洁级雄性SD大鼠,体质量 (130±20)g,造模大鼠体质量(240±20) g,均购自湖南中医药大学动物实验中心。实验过程中对动物处置符合动物伦理学标准。动物许可证号:SCXK (湘)2009-0004。
1.1.2 试剂 培养基 L-DMEM,美国 GIBCO 公司;特级胎牛血清,北京Hyclone公司;5-氮胞苷,美国Sigma公司; FITC 标记 CD11b、CD45、CD90抗体,美国SERANTEC公司;Trizol,美国 Invitrogen公司;逆转录聚合酶链反应试剂盒,加拿大Fermentas公司;聚合酶链反应(PCR)引物,Invitrogen公司。
1.1.3 引物 在NCBIGenbank公布的引物序列,使用Primer Premier5.0进行设计。由Invitrogen公司合成。见表1。
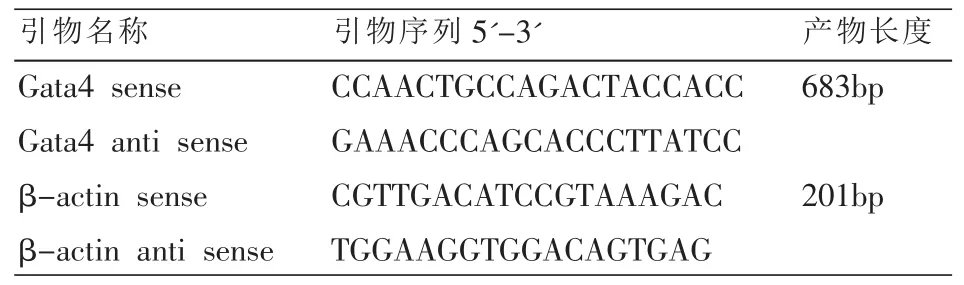
表1 PCR引物序列及扩增目的片段大小
1.2 方法
1.2.1 MSCs的分离与培养 雄性SD大鼠颈椎脱臼法处死,在75%乙醇中浸泡10 min。在无菌条件下快速取胫骨和股骨,去除周围组织,切除胫骨和股骨两端,用DMEM液反复冲洗骨髓腔,将冲洗液收集于离心管中,1 500 r/min离心5 min,弃上清液。加入含10%胎牛血清DMEM培养基,反复吹打,细胞计数后以109/mL密度接种于50 cm2培养瓶中,37℃、饱和湿度、含体积分数为0.05的CO2孵育箱中培养。48 h后弃悬浮液,首次换液。以后每2 d换液1次。
1.2.2 MSCs的传代及纯化 待原代培养的细胞增殖在瓶底融合基本达到80%左右时,用0.25%胰酶消化细胞后,加培养液终止消化并反复吹打贴壁细胞,制成单细胞悬液,按1∶2传代培养,并标记为P2,以后每天观察细胞的生长情况,直至贴壁细胞彼此融合达到80%左右时,重复上述操作,反复传至第4代。
1.2.3 MSCs 的鉴定 取第 4 代 MSCs,0.25%胰酶消化后配制成细胞悬液,1%BSA封闭液10 min,PBS洗涤3次,加入FITC荧光标记的抗CD11b、CD45、CD90抗体,对照组加 PBS,4 ℃孵育 30 min,1 500 r/min离心 5 min,PBS冲洗 3次,以 1%多聚甲醛固定,采用FACScan流式细胞仪检查细胞表面抗原。
1.2.4 大鼠MSCs细胞悬液配制 用胰蛋白酶消化后离心收集细胞,计数,加入无血清的DMEM培养基,配制成3×106/100μL浓度的细胞悬液,4℃保存备用。
1.2.5 动物造模 取健康清洁级雄性SD大鼠30只,适应性饲养观察1周。随机取8只作为空白组,取8只作为假手术组,其余作为模型组。参考文献方法[4]将缺血心肌组大鼠腹腔麻醉,仰卧位固定,呼吸机呼吸,行心电监测,左胸纵切口分层开胸,在肺动脉圆锥和左心耳之间,距左冠状动脉起始2 mm处5~0号无创伤丝线结扎左冠脉前降支,使左室前壁失去原有光泽而变苍白,出现搏动减弱,心电监测见肢体导联R波振幅明显升高,随后出现I导联和aVL导联J点明显抬高,提示大鼠AMI造模成功。
1.2.6 分组处理 ①模型组 将造模成功的大鼠结扎30 min后,于梗死区边缘心肌组织的3个位点直接注入共100μL的MSCs细胞悬液 (含细胞数3×106),常规关闭胸腔。术后腹腔注射青霉素预防感染,单笼饲养。②假手术组 给大鼠开胸后,只穿线不做结扎。30 min后,与模型组相同注射部位的3个位点直接注入共100μL的MSCs细胞悬液,随后的处理同模型组。③空白对照组 给大鼠开胸后,与模型组相同注射部位的3个位点直接注入共100μL的MSCs细胞悬液,随后的处理同模型组。各组28 d后处死,取出心脏切下约100 mg放入冷冻管保存在液氮中备用。
1.2.7 检测GATA-4mRNA的表达 ①组织总RNA的提取,整个提取操作过程要在低温无菌进行。取100 mg组织剪碎,加Trizol试剂1 mL,抽吸混匀,室温静置10 min;加三氯甲烷0.2 mL,混匀,室温静置 10 min;4 ℃,12 000 r/min 离心 10 min;仔细吸取上层水相,移入另一管中,加0.5 mL异丙醇,置室温 10 min;4 ℃,12 000 r/min 离心 10 min;加 75%乙醇1 mL混匀,充分洗涤沉淀;4℃,7 500 r/min离心5 min;弃去上清液,室温静置5 min,用40μL水重悬,贮存于-70℃备用。②经电泳鉴定其完整性后,利用紫外分光光度计测定A260与A280的比值,并计算其浓度。③mRNA的反转录cDNA合成,在 EP 管中加入模板 RNA3μg,oligo (dT)18 primer 1μL加至11μL,离心30 s;65℃水浴5 min后,立刻0℃冰水浴1 min;短暂离心后,冰上操作:加入 4 μL 5×First-Strand Reaction Buffer,1uL MMuLV逆转录酶;离心30 s,37℃水浴60 min进行逆转录;70℃水浴5 min灭活逆转录酶,-20℃保存,或立即进行PCR。④PCR扩增逆转录产物,采用的引物同前述所用引物,25μL反应体系。反应条件为:94℃预变性5 min,进入PCR循环,94℃变性30 s,54 ℃退火60 s,72 ℃延伸60 s,35个循环,72℃延伸10 min,结束反应。⑤PCR产物电泳鉴定,用2%琼脂糖凝胶为载体,上样量为12μL,电压为60 mV,电泳60 min后,置凝胶扫描仪呈像系统下用图像分析系统进行图像采集,每幅图像使用Image-Pro Plus 6.0软件编制宏按统一原则进行分析测量。扫描分析GATA-4、内参β-actin的光吸收差值。
1.3 统计学分析
2 结果
2.1 MSCs表面抗原的鉴定结果
应用FACScan流式细胞仪检查细胞表面抗原CD11b和CD45阳性细胞率均达到98%以上,CD90阳性率小于2%。结果显示细胞均一性较好,纯度较高。见图1。

图1 大鼠MSCs细胞CD11d,CD45和CD90表达流式细胞记录图
2.2 RNA的鉴定
提取的心肌组织总RNA,经紫外分光光度计检测,所有样品OD260/OD280值均在1.7以上,表明其纯度符合要求。
2.3 MSCs移植缺血心肌后GATA-4 mRNA的表达
用GATA-4 mRNA基因序列设计的特异性引物进行的RT-PCR产物,经电泳分离表明,MSCs移植AMI模型组和模型对照组心肌后28 d的大鼠心肌中存在GATA-4 mRNA的表达,电泳图上见一683 bp条带;而空白对照组的心肌中未检出GATA-4 mRNA的表达,对其IOD值半定量分析,模型组高于其他两组,差异有统计学意义(P<0.05),见图2和表2。
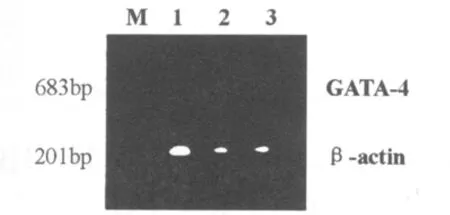
图2 MSCs移植缺血心肌后GATA-4 mRNA-RT-PCR电泳图谱

表2 MSCs移植缺血心肌后GATA-4 mRNA的表达(n=8,x±s)
3 讨论
MSCs具有保持未分化特性无限增殖的能力,并且能够分化为包括心肌细胞在内的各种类型的细胞[5]。GATA-4是GATA基因家族的重要成员之一,含有高度保守的DNA结合域,此结构域由2个锌指结构序列构成。GATA-4在心脏早期便开始表达,并在心肌和心脏其他组织中持续表达。生物学的研究表明GATA-4基因在心肌发生中扮演重要角色,是MSCs向心肌细胞分化的重要启动基因和心脏前体细胞的最早标志之一。
心脏的发育是具有时间和空间协调一致性的复杂遗传过程,主要由细胞之间的信号转导及基因表达进行精确调控。干细胞横向分化的机制与诱导心脏发生的分子调控机制密切相关。本研究应用RT-PCR检测技术定量分析了心脏转录因子GATA-4 mRNA基因在MSCs移植后的表达差异。结果显示,空白对照组的心肌中未检出GATA-4 mRNA的表达,模型组高于其他两组。说明MSCs在进入缺血心肌环境后,细胞内的心肌特异转录过程被再次激活,确立了向心肌细胞分化的方向,GATA-4活化后会导致下游调控基因级联式激活,最终合成特异靶蛋白。因此GATA-4在心脏发育过程中的作用可能是通过调控许多心脏结构基因的表达,包括心脏肌球蛋白重链、心肌钙蛋白C等,以及通过其锌指结构与其他心脏特异性的转录因子等相互作用形成复合物发挥转录调控作用,从而调节心脏发育[6-7]。
[1] Keller G.Embryonic stem cell differentiation:emergence of a new eta in biology and medicien [J].Genes Dev,2005,19:1 129-1 155.
[2] Wang JS, Sham Tim D, Chedrawy E,et al.The coronary delivery of marrow stromal cells for myocardial regeneration:Pathophysiologic and therapeutic implications [J].J Thorac Cardiovasc Surg,2001,122(4):699-705.
[3]郭 艳,史大卓,陈可冀.中医药结合干细胞移植治疗心肌损伤性疾病的前景[J].新中医,2005,37(5):88-89.
[4]袁肇凯.中医诊断实验方法学(第2版)[M].北京:科学技术出版社,2006:257-258.
[5] Hung SC,Chen NJ,Hsieh SL,et al.Isolation and characterization of size-sieved stem sells from hurman bone marrow [J].Stem Cells,2002,20(3):249-258.
[6] Chen MW, Liu TW, Pang YS.Recent progress on the effect of GATA-4 on the cardiovascular system [J].Zhonghua Xin Xue Guan Bing Za Zhi, 2008, 36: 85-87.
[7] Xin M,Davis CA,Molkentin JD,et a1.A threshold of GATA4 and GATA6 expression is required for cardiovascular development[J].Proc Natl Acad Sci USA ,2006,103:11 189-11 194.

