结核性胸膜炎合并组织细胞坏死性淋巴结炎一例
黄 玲,王开绿,郑晓凤,李文军,刘艳群,刘 蔺,蒙 琴
组织细胞坏死性淋巴结炎 (histocytic necrotizinglymphadenitis,HNL) 又 称Kikuchi病[1]或 Kikuchi-Fujimato病,是一种由多种病因所致的非肿瘤性淋巴结疾病,好发于青年人,伴高热、淋巴结肿大,以颈部淋巴结肿大多见,外周血白细胞计数正常或下降,红细胞沉降率 (血沉)加快、C反应蛋白升高。临床上常误诊为淋巴结结核、淋巴瘤等,误诊率约40%[2]。本例患者在结核性胸膜炎的治疗过程中出现发热、颈部淋巴结肿大,免疫学检查异常,经淋巴结活检病理诊断为HNL,给予抗结核及糖皮质激素治疗后痊愈,随访2年未复发。提示结核性胸膜炎、HNL及免疫学异常之间可能存在某种内在联系,结核菌感染可能是HNL及免疫学异常的诱因。
1 病例简介
患者,男,27岁,因“潮热、盗汗2个月,胸闷、气促1个月”入院。患者入院前2个月不明诱因出现潮热、盗汗,伴乏力、纳差,偶有咳嗽,咳少许白色泡沫痰,无胸痛、咯血等不适,未予特殊处理。入院前1个月出现胸闷、气促,无心悸、水肿等。患者患病以来精神较差,体质量下降约5 kg。入院时查体:体温37℃,无力体型,全身浅表淋巴结未扪及肿大,右胸第4肋以下叩诊浊音,呼吸音消失。血常规:白细胞计数 5.81×109/L,中性粒细胞分数 0.650,淋巴细胞分数0.170,血红蛋白121 g/L,血小板216×109/L;结核菌素试验 (PPD)(+);血结核抗体 (TBAb)弱阳性;痰涂片抗酸染色 (-);血沉61 mm/h;C反应蛋白61.3 mg/L;胸腔积液常规:李凡他 (Rivalta)试验 (++),白细胞计数6×106/L,胸腔积液生化:蛋白 (TP)53.2 g/L,腺苷脱氨酶 (ADA)33 U/L,乳酸脱氢酶 (LDH)274 U/L;胸腔积液涂片抗酸染色 (+);胸腔积液脱落细胞学检查 (-)。胸部CT:右侧胸腔积液。胸腔B超:右侧胸腔中量积液。给予异烟肼0.3 g,1次/d;利福平0.45 g,1次/d;吡嗪酰胺1.5 g,1次/d;乙胺丁醇0.75 g,1次/d,并行胸腔穿刺抽出胸腔积液730 ml。抗结核治疗10 d后,患者潮热、盗汗、气促减轻,但仍感乏力、纳差。治疗13 d后,患者出现发热,体温36.4~39.6℃,多在夜间出现,为弛张热型。加用泼尼松40 mg/d,临时使用柴胡、安痛定,体温下降后又升高。治疗18 d后,患者出现双侧颈部淋巴结肿大伴压痛。查人类免疫缺陷病毒 (HIV)(-);疟原虫 (-);肥达氏-外斐氏试验 (-);血培养 (-);复查血常规:白细胞计数3.35×109/L,中性粒细胞分数0.373,淋巴细胞分数0.445;免疫学检查:IgG 23.9 g/L,IgA 3 130 mg/L,IgE 776.08 U/ml,循环免疫复合物(CIC)0.16 OD,抗核抗体 (ANA)+1∶100斑点型,抗干燥综合征A抗体 (抗SSA)(++),抗干燥综合征B抗体 (抗SSB)(+)。取左侧颈部淋巴结活检,病理学检查示:HNL(见图1)。给予甲泼尼龙80 mg,2次/d,连用3 d,改为琥珀氢化可的松100 mg,2次/d,连用3 d,再改为琥珀氢化可的松150 mg,1次/d,连用3 d,后改为泼尼松40 mg/d,逐渐减量停药,糖皮质激素总疗程35 d。患者体温恢复正常,肿大淋巴结消失。抗结核治疗3个月后,患者潮热、盗汗、气促、乏力、纳差消失,体质量增加,复查胸部CT:右侧少量胸腔积液;胸部B超:右侧少量胸腔积液。继续抗结核治疗至9个月,复查胸部CT:右侧胸膜增厚,停抗结核治疗。随访颈部淋巴结、血常规、胸部CT两年无异常发现,患者拒绝免疫学复查。
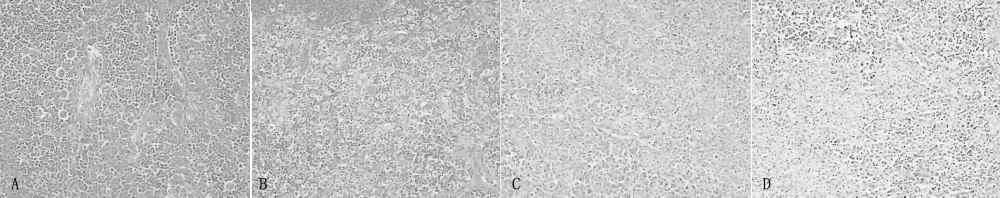
图1 左颈部淋巴结活检病理学检查低倍放大 (HE染色)Figure1 Pathological results of left cervical lymph node
2 讨论
本例患者以潮热、盗汗、胸闷、气促入院。入院时体温正常,消瘦,全身浅表淋巴未扪及肿大,右侧胸腔积液征。白细胞计数正常,PPD皮试 (+),血TBAb弱阳性,血沉加快、C反应蛋白升高。胸部影像学检查示:右侧胸腔积液。胸腔积液检查提示渗出液,胸腔积液涂片抗酸染色 (+),诊断结核性胸膜炎,予抗结核治疗,患者潮热、盗汗、气促减轻。之后患者出现发热,复查血常规白细胞计数下降,淋巴细胞百分数增高,进行一些相关检查无阳性发现,考虑类赫氏反应,加用口服泼尼松并于临时对症处理,体温下降后又升高。此后患者出现双侧颈部淋巴结肿大伴有压痛。行左侧颈部淋巴结活检术,病理学检查示:HNL。予甲泼尼龙、琥珀氢化可的松静脉使用,后改为泼尼松,逐渐减量停药,患者体温恢复正常,肿大淋巴结消失。继续服用抗结核药物至9个月,复查胸部CT病变消失,停抗结核治疗,随访2年无异常发现。从该患者临床经过来看,结核性胸膜炎合并HNL的诊断是成立的。
该病例有以下几个方面值得探讨:(1)该患者在抗结核治疗的过程中出现发热、淋巴结肿大,按照一元论的原则首先考虑类赫氏反应或淋巴结核,但淋巴结活检病理学检查未提示毛细血管扩张渗透性增加、中性粒细胞渗出、巨噬细胞、淋巴细胞聚集成结节等类赫氏反应的表现及干酪样坏死、类上皮样细胞、郎汉斯巨细胞或查见结核杆菌等淋巴结核的表现,不支持类赫氏反应或淋巴结核。故在结核性胸膜炎的病程中若出现发热、淋巴结肿大等,除考虑类赫氏反应、淋巴结核、淋巴瘤等,还应考虑合并HNL,尽早行淋巴结活检以明确。据报道,HNL是一种免疫相关疾病,其病因除了病毒感染以外,还可能与包括结核在内的分枝杆菌感染有关[3-4]。本病例可能是该学说的又一个例证。(2)本病例免疫学检查异常。杨佩珍等[5]报道结核感染可引起自身免疫性疾病。其机制可能为机体感染结核菌后,菌体释放可溶性结核蛋白,激活机体细胞和体液免疫,产生抗核抗体、循环免疫复合物等,出现免疫学异常。HNL病因尚不清楚,钟英强等[6]研究发现可能与感染病毒、弓形虫、结核杆菌等引起超敏反应或自身免疫性反应有关,多数预后良好,但亦可与各种自身免疫性疾病相关联,如系统性红斑狼疮 (SLE)、结节硬化症、多发性关节炎等。林莹等[7]报道1例SLE合并 HNL;巫斌[8]报道1例 HNL演变为SLE,亦有报道称若抗核抗体阳性,则可能发展为SLE。本例患者结核性胸膜炎、HNL诊断明确,免疫学检查IgG、IgA、IgE、循环免疫复合物增高,ANA、抗SSA抗体、抗 SSB抗体阳性,故推测结核性胸膜炎、HNL与免疫学异常/自身免疫性疾病在发病机制上可能有某种联系,就本例患者而言,推测结核菌感染为HNL与免疫学异常的病因。由于目前少见有报道,故对于诊断为结核性胸膜炎、HNL或两者合并存在的患者有必要行免疫学检查及加强随访,以观察患者的转归。(3)本例患者出现发热、淋巴结肿大等表现,使用口服泼尼松后症状缓解不明显,后静脉给予甲泼尼龙、琥珀琥珀氢化可的松,以上症状很快消失,再改为泼尼松口服,逐渐减量停药,症状未再复发。本例患者治疗经过表明,结核性胸膜炎并HNL,且又伴有 ANA阳性的患者,全身炎症反应较重,选用作用较强的糖皮质激素静脉使用,可较快缓解病情。当然,本例仅为个案,尚需较大的样本量来研究证实。
1 Kikuchim.Lymphadenitis showing focal reticulum cell hyperplasia with nuclear debris and phagocytosis[J].Nippon Ketsueki Gakkai Zasshi,1972,35(3):379-380.
2 Menasce LP,Banerjee SS,Edmondson D,et al.Histiocytic necrotizing lymphadenitis Kikuchi-Fujimoto disease:continuing diagnostic difficulties[J].Histopathology,1998,33(3):248-254.
3 廖新波,庄恒国,林华欢,等.组织细胞坏死性淋巴结炎[J].临床与实验病理学杂志,2001,17(2):117-119.
4 丁顺利,赵天如,张乃鑫,等.结核性淋巴结炎:组织细胞性坏死性淋巴结炎样变型[J].天津医药,1997,25(3):166.
5 杨佩珍,闵伟琪,郑锡铭,等.结核感染与自身免疫疾病[J].中华结核和呼吸杂志,1993,16(5):261.
6 钟英强,黄花荣,李海刚.组织细胞性坏死性淋巴结炎的临床和病理特征[J].美国中华健康卫生杂志,2000,3(10):15-18.
7 林莹,钟英强,李海刚.SLE合并组织细胞坏死性淋巴结炎1例报告[J].新医学,2002,33(7):425-427.
8 巫斌.组织细胞坏死性淋巴结炎演变为系统性红斑狼疮伴曲霉菌感染1例[J].福建医科大学学报,2005,39(2):120.

