儿童微小病变性肾病综合征临床分析
任献国,刘光陵,夏正坤,高远赋,樊忠民,何 旭,茅 松
儿童肾小球疾病是临床常见和多发性疾病,原发性肾病综合征 (primary nephritic syndrome,PNS)是儿童期最常见的肾小球疾病[1],是导致儿童慢性肾衰竭的主要原因,不同的病理类型决定了治疗的效果和预后。微小病变性肾病综合征(minimal change nephrotic syndrome,MCNS)是儿童和青少年最常见的肾病综合征 (NS)[2]。本研究对南京军区南京总医院儿科1982年6月—2010年4月经肾穿刺活检明确诊断的222例MCNS住院患儿进行回顾性研究,探讨儿童MCNS临床表现、实验室检查及糖皮质激素应用4周后的转归情况。
1 资料与方法
1.1 临床资料 选取我院儿科1982年6月—2010年4月经肾穿刺活检明确肾脏病理为MCNS住院患儿222例为研究对象,其中男187例,女35例,男女之比为 5.3∶1.0;年龄 1~16岁,平均(6.2±3.2) 岁。
1.2年龄分期 参照《儿科学》 (第七版)[3],出生到3岁为婴幼儿期,3~岁为学龄前期;6~岁为学龄期;10~20岁为青春期。
1.3 临床分型 参照2009年中华医学会儿科学分会肾脏病学组关于儿童常见肾脏疾病诊治循证指南[4],按临床表现并结合实验室检查分为两型: (1)单纯型NS;(2)肾炎型NS。
1.4 病理检查 1982年6月—1985年7月,在X线电视透视下进行抽吸式经皮肾穿刺活检;1985年8月—1992年5月,在B超超声探头引导下,使用18号薄型Menghini穿刺针,采用一秒钟抽吸法穿刺;1992年6月后改为一人操作 (单人法)。穿刺点通常在右肾或左肾下极,术后平卧24 h。肾活检组织经甲醛固定,切片厚度2 μm,分别行伊红染色法 (hematoxylin-eosin staining,HE)、过碘酸-雪夫反应 (periodic acid-schiff stain,PAS)、过碘酸六胺银染色 (periodic acid-silver metheramine,PASM) 和马松三色染色。肾组织病理在南京军区南京总医院解放军肾脏病研究所进行光学显微镜、免疫荧光病理、电子显微镜检查,由同一组病理医师参照世界卫生组织(WHO)1982年及改良的1995年肾小球疾病组织学分类标准[5-6],确定病理类型为轻微病变,电子显微镜检查明确诊断,排除继发性肾病。免疫荧光病理根据免疫复合物沉积类型分为五型:IgA型 (以IgA沉积为主,除外IgA、IgM、IgG、C3等全部沉积);IgM型 (以IgM沉积为主,除外 IgA、IgM、IgG、C3等全部沉积);IgA+M+G+C3型(IgA+M+G和C3等补体沉积);补体为主型 (除补体外无其他沉积);无免疫复合物型。
1.5 疗效观察 参照2009年中华医学会儿科学分会肾脏病学组关于儿童常见肾脏疾病诊治循证指南[4],均观察初次使用泼尼松的情况,初始剂量为2 mg·kg-1·d-1,最大量不超过60 mg/d,连续口服治疗4周后的转归情况分为: (1)完全缓解 (complete remission,CR)至少连续3 d,满足下列3项中任何1项:①试纸条法尿蛋白阴性;②尿蛋白定量<4 mg/(h·m2);③随机或晨尿尿蛋白/肌酐(mg/mg) <0.2;(2)部分缓解 (partial remission,PR)尿蛋白较基线值减少≥50%和 (或)尿蛋白/肌酐 <2.0和(或)水肿消失和 (或)血红蛋白 >25 g/L; (3)未缓解 (non-remission,NR)。
1.6 统计学方法 采用SPSS 17.0统计软件进行统计学处理,采用 CMH χ2检验,两组间比较用χ2检验的行×列表分割法 (必要时行 Yates校正),以 P<0.05为差异有统计学意义。
2 结果
2.1 发病诱因分析 本组患儿的发病诱因上呼吸道感染最多见62例 (占27.9%),胃肠道感染34例 (占15.3%),下呼吸道感染 27例 (占12.2%),疲劳11例 (占5.0%),88例(占39.6%)未见明显诱因。
2.2年龄分期 婴幼儿期24例 (占10.8%),学龄前期91例 (占41.0%),学龄期65例 (占29.3%),青春期42例(占18.9%)。
2.3 临床类型 单纯型NS 194例 (占87.4%),肾炎型NS 28例 (占12.6%)。
2.4 糖皮质激素应用4周后转归情况完全缓解167例 (占75.2%);部分缓解43例 (占19.4%);未缓解12例 (占5.4%)。
2.5 免疫荧光病理分型 IgA型23例(占10.4%);IgM型59例 (占26.6%);IgA+M+G+C3型19例 (占8.6%);补体为主型16例 (占7.2%);无免疫复合物型105例 (占47.2%)。
2.6 糖皮质激素应用4周后转归情况与年龄分期的关系 糖皮质激素应用4周后完全缓解率以学龄前期最高,其次为学龄期。经CMH χ2检验,似然比 (Likelihood Ratio) χ2=14.137,渐进Sig(双侧)P=0.028,差异有统计学意义 (见表1)。
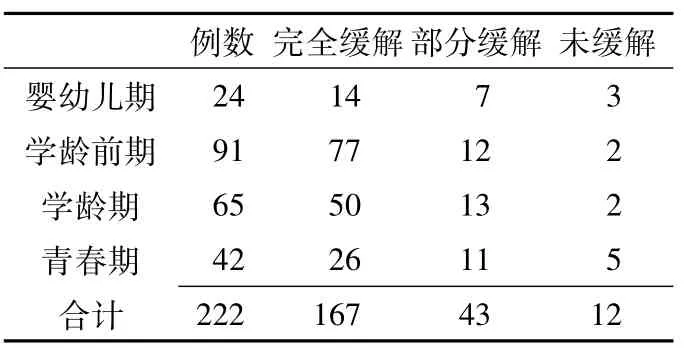
表1 糖皮质激素应用4周后转归情况与年龄分期的关系 (例)Table1 Relationship between the outcomes of four-week glucocorticosteroid therapy and age
2.7 糖皮质激素应用4周后转归情况与临床类型的关系 单纯型NS完全缓解率为80.4%,部分缓解率为16.0%,未缓解3.6%;肾炎型NS完全缓解率为39.3%,部分缓解率为42.9%,未缓解17.8%。经 CMH χ2检验,似然比 χ2=19.936,渐进 Sig(双侧)P=0.000,差异有统计学意义 (见表2)。
2.8 糖皮质激素应用4周后转归情况与肾组织免疫荧光病理的关系 IgA+M+G+C3型患儿激素反应最差,IgM型患儿激素反应比IgA型差,补体为主型和无免疫复合物型激素反应较好。经CMH χ2检验,似然比 χ2=26.169,渐进 Sig(双侧)P=0.001,差异有统计学意义 (见表3)。
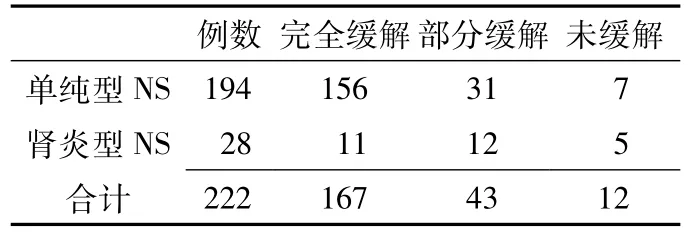
表2 糖皮质激素应用4周后转归情况与临床类型的关系 (例)Table2 Relationship between the outcomes of four-week glucocorticosteroid therapy and clinical classification
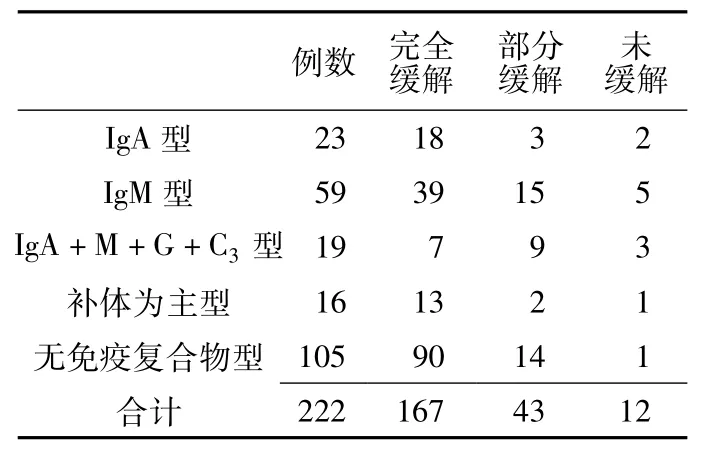
表3 糖皮质激素应用4周后转归情况与肾组织免疫荧光病理的关系 (例)Table3 Relationship between the outcomes of four-week glucocorticosteroid therapy and renal pathology by immunofluorescence
3 讨论
儿童NS按照临床表现、病程经过及实验室检查分为单纯型NS和肾炎型NS。临床上以单纯型多见,我国对1982年20省市105所医院泌尿内科6 947例住院患儿进行统计,其中1 460例NS,单纯型占68.4%,肾炎型占31.6%,先天性仅占0.1%[7]。本资料222例MCNS患儿单纯型 NS占87.4%,肾炎型 NS占12.6%。随着病情迁延,单纯型NS可能转化为肾炎型NS,而肾炎型NS在经过有效治疗后也可转归为单纯型NS。Kyrieleis等[8]报道,MCNS患儿迁延至青春期后很可能并发骨质疏松症、高血压、白内障、精子异常等病症。MCNS患儿经过规范的激素治疗后,部分患儿高血压症状可消失,并且与是否有原发性高血压家族史有关[9]。
根据2009年中华医学会儿科学分会肾脏病学组关于儿童常见肾脏疾病诊治循证指南[4],有关激素敏感性的界定,以足量激素治疗4周判断。我科从1982年起开展肾穿刺活检病理检查,迄今已穿刺2 600多例,肾穿刺活检术作为创伤性检查,在儿科应用谨慎,其适应证要求严格,本研究多数患儿在行肾活检术时,病程迁延,激素减药或停药后即复发,已达到激素依赖、频繁复发的诊断标准,但最初应用足量泼尼松4周后可能完全缓解,故完全缓解率为 75.2%,Schrier[10]报道,初发NS在激素治疗的1周内部分患儿可出现缓解,2周内有75%的患儿、4周内有90%的患儿可达到完全缓解。年龄分期不同的患儿糖皮质激素应用4周后转归情况有差异,完全缓解率以学龄前期最高,其次为学龄期;部分缓解率和未缓解率均以婴幼儿期最高,其次为青春期。单纯型NS和肾炎型NS激素疗效比较有显著差异,单纯型NS完全缓解率高于肾炎型NS。Begum等[11]报道了40例NS患儿,经过28 d激素治疗后仅43.2%的患儿完全缓解。无论是对激素治疗的反应,还是预后方面,儿童MCNS与成人患者都存在较大差异,儿童患者激素治疗缓解率高,预后好;但也有患儿反复复发,迁延不愈,重复肾活检表现为局灶节段性肾小球硬化 (focal segmental glomerulosclerosis,FSGS),激素疗效不佳。肾小球足细胞是MCNS和FSGS肾组织病变形成的主要受损靶细胞,但激素治疗FSGS的缓解率远小于MCNS。
1951年 Iversen等[12]首次报道经皮肾组织活检,通过肾活检可以观察肾组织学变化,尤其是利用特殊染色或免疫学技术,能客观准确的诊断疾病,肾小球疾病中免疫病理描述性的诊断包括IgA肾病、IgM肾病和 C1q肾病等。1968年 Berger[13]首先对 IgA 肾病 (IgA nephropathy,IgAN)加以描述,全称为“系膜增生性IgA肾病”(mesangial proliferative IgA nephropathy)。IgM肾病是一免疫病理诊断,首先由Cohen等[14]报告,指肾小球系膜区显著IgM沉积的系膜增殖性肾小球肾炎。C1q肾病由 Jennette等[15]于 1985年首次命名,免疫病理表现为C1q呈颗粒状弥漫分布于系膜区或毛细血管襻。本研究根据免疫复合物沉积类型将免疫荧光病理分为5型,其中IgA型、IgM型和补体为主型与上述IgA肾病、IgM肾病和C1q肾病在临床意义上不完全相同,本研究患儿免疫复合物沉积均为局灶性,局限于系膜区,本文仅从免疫荧光病理的角度探讨。MCNS免疫荧光通常为阴性,但部分病例可有少量IgG、IgM和补体局限于系膜区沉淀。这种免疫球蛋白局灶性沉积多为继发于蛋白尿的一种非特异性滞留[16]。本研究免疫荧光沉积阳性率较相关报道高,系由于本组患儿行肾组织活检时,大多数病程已迁延数月,多为激素依赖、频繁复发型,长期、反复蛋白尿导致患儿免疫荧光沉积阳性率较高。应用足量糖皮质激素4周后,免疫复合物沉积种类多的患儿激素反应最差,IgM型的激素反应比IgA型差,补体为主型和无免疫复合物型激素反应较好。
由于本研究系回顾性研究,时间跨度长,病例数量大,对单一病例而言,信息量较小,未能反映复杂的临床表现和治疗过程,并缺少长期的随访。但根据肾穿刺活检病理结合临床和实验室检查对患儿进行个体化治疗是儿童NS基本治疗方法。本研究初步探讨了MCNS患儿年龄分期、临床分型、肾组织免疫荧光病理和短期激素疗效的关系,对于无法开展肾活检的单位或肾穿刺禁忌证的患儿具有初步推断病理类型、指导治疗和判断预后的意义。
1 Haffner D,Ficher DC.Nephrotic syndrome and rituximab:facts and perspectives[J].Pediatr Nephrol,2009,24(8):1433-1438.
2 Clajus C,Spiegel J,Brocker V,et al.Minimal change nephrotic syndrome in an 82 year old patient following a tetanus-diphteria-poliomyelitis-vaccination[J].BMC Nephrol,2009,10:21.
3 沈晓明,王卫平.儿科学[M].7版.北京:人民卫生出版社,2007:3-4.
4 中华医学会儿科学分会肾脏病学组.儿童常见肾脏疾病诊治循证指南[J].中华儿科杂志,2009,47(3):167-170.
5 ChurgJ,Sobin LH.Renal disease:classification and atlas of glomerular disease[M].Tokyo:Igaku-shoin,1982:4-5.
6 Churg J,Bernstein J,Glassock RJ.Renal disease:classification and atlas of glomerular disease[M].2th ed.Tokyo:Igaku-shoin,1995:4-5.
7 胡亚美,江载芳.褚福棠实用儿科学[M].7版.北京:人民卫生出版社,2002:1641.
8 Kyrieleis HA,Lowik MM,Pronk I,et al.Long-term outcome of biopsy-proven,frequently relapsing minimal-change nephrotic syndrome in children[J].Clin J Am Soc Nephrol,2009,4(10):1593-1600.
9 Kontchou LM,Liccioli G,Pela I,et al.Blood pressure in children with minimal change nephrotic syndrome during oedema and after steroid therapy:the influence of familial essential hypertension[J].Kidney Blood Press Res,2009,32(4):258-262.
10 Schrier RW.Disease of the kidney and urinary tract[M].8th ed.Philadelphia:Lippincott Williams and Wilkins,2007:1585-1672.
11 Begum A,Rahman H,Hossain MM,et al.Histological variant of nephrotic syndrome with atypical presentation in children[J].Mymensingh Med J,2009,18(1):42-46.
12 Iversen P,Brun C.Aspiration biopsy of the kidney[J].Am J Med,1951,11:324.
13 Berger J.IgA glomerular deposits in renal disease[J].TransplantProc, 1969, 1:939-944.
14 Cohen AH,Border WA,Glassock RJ.Nephrotic syndrome with glomerular mesangial IgM deposites[J].Labinvest,1978,38:6102-6106.
15 Jennette JC,Hipp CG.C1q nephropathy:a distinct pathologic entity usually causing the nephritic syndrome[J].Am J Kidney Dis,1985,6:103-110.
16 黎磊石,刘志红.中国肾脏病学[M].北京:人民军医出版社,2008:370.

