GM1对新生儿缺氧缺血性脑病IL-1β、NSE、ICAM-1的影响
陈惠军
(新乡市中心医院,河南 新乡 453000)
新生儿缺氧缺血性脑病(HIE)是新生儿窒息后的严重并发症[1]。单唾液酸四已糖神经节苷脂(GM1)在哺乳类动物神经系统中含量丰富。研究报道,在动物实验中GM1对缺氧缺血区神经细胞有影响[2,3]。本研究通过测定 GM1治疗 HIE患儿前后血清IL-1β、神经元特异性烯醇化酶(NSE)、细胞间黏附因子1(ICAM-1)水平变化,以探讨其对HIE的治疗作用机制。
1 资料与方法
1.1 临床资料 本文60例患儿均为2008年1月~2009年12月我院新生儿科收治的中度HIE患儿,诊断依据和临床分度均符合全国新生儿会议修订的新标准[4]。将患儿随机分为两组,GM1组30例,男20例、女10例,年龄0~7 d;对照组30例,男18例、女12例,年龄0~7 d。另设30例同期住院的正常儿童为正常组,三组年龄、性别有可比性。
1.2 治疗方法 两组均采用常规治疗,纠正低氧血症、控制惊厥、控制颅压增高、应用中枢神经系统兴奋药等(可用细胞色素C、三磷酸腺苷、辅酶A等;也可使用胞二磷胆碱均可改善脑组织代谢)。GM1组加用GM120 mg静滴,1次/d,疗程均为7 d。
1.3 检测方法 两组患儿均在第1天和第8天予股静脉穿刺采血2 ml,置-70℃冷冻保存、待测。第一天股静脉采血2 ml,置-70℃冷冻保存、待测。采用ELISA方法检测IL-1β、NSE、ICAM-1。新生儿神经行为(NBNA)评分参照文献[5],疗效观察及评定参照文献[6]。
1.3 统计学方法 采用SPSS13.0统计软件,数据以表示,组间比较采用t检验;两组总有效率比较采用χ2检验;相关分析采用Pearson相关分析法。以P≤0.05为有统计学差异。
2 结果
2.1 两组临床疗效比较 GM1组显效13例、有效16例、无效1例,总有效率96.6%;对照组分别为10、12、8 例,总有效率 73.3%。GM1 组总有效率高于对照组(P <0.05)。
2.2 三组血清 IL-1β、NSE、ICAM-1及 NBNA 评分比较 见表1。
表1 三组血清IL-1β、NSE、ICAM-1及NBNA评分比较()
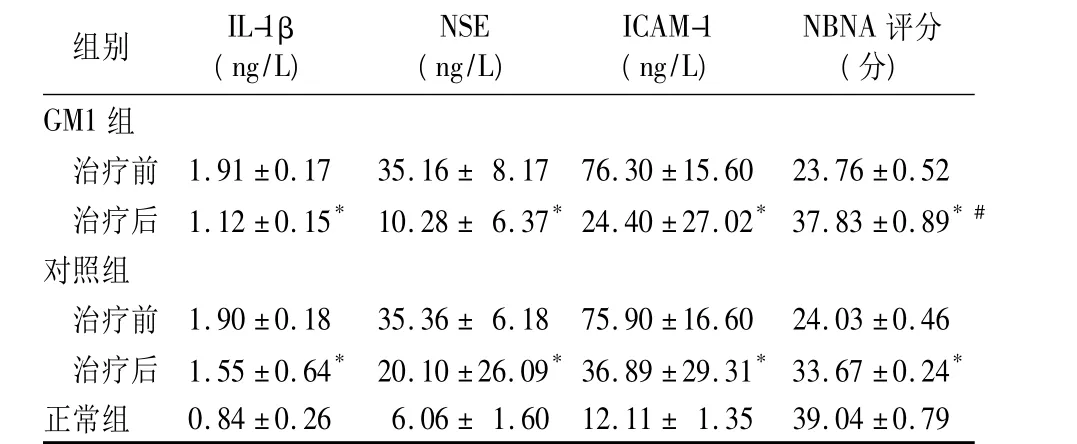
表1 三组血清IL-1β、NSE、ICAM-1及NBNA评分比较()
注:与正常组比较,*P <0.01;与对照组治疗后比较,#P <0.05
组别 IL-1β(ng/L)NSE(ng/L)ICAM-1(ng/L)NBNA评分(分)GM1组治疗前 1.91 ±0.17 35.16 ± 8.17 76.30 ±15.60 23.76 ±0.52治疗后 1.12 ±0.15* 10.28 ± 6.37*24.40 ±27.02*37.83 ±0.89*#对照组治疗前 1.90 ±0.18 35.36 ± 6.18 75.90 ±16.60 24.03 ±0.46治疗后 1.55 ±0.64* 20.10 ±26.09*36.89 ±29.31*33.67 ±0.24*正常组0.84 ±0.26 6.06 ± 1.60 12.11 ± 1.35 39.04 ±0.79
2.3 IL-1β、NSE、ICAM-1 与 NBNA 评分的相关性Pearson相关分析结果显示,IL-1β、NSE、ICAM-1与 NBNA 评分呈负相关性(r= -0.72,P <0.05)。
3 讨论
HIE是指各种围生期窒息引起的部分或完全缺氧、脑血流减少或暂停而导致的胎儿或新生儿脑损伤,病情重,病死率高[1]。迄今为止,对缺氧缺血损伤尚无根本性的防治措施。
炎症反应是HIE病理过程中损伤的关键。HIE中枢神经系统的病理变化过程以及它们之间错综复杂的内在联系,构成了脑组织局部过度的炎症反应和免疫损伤的主要环节。IL-1β是免疫、炎症反应的重要介质,是血脑屏障损伤的重要因子[7],它可通过激活NF-κB的活性而诱导ICAM-1、IL-8等免疫分子表达,共同参与炎症反应和免疫损伤。ICAM-1升高是内皮细胞、白细胞等损害、激活的标志[8]。炎症反应加重,微循环阻塞,损伤进一步加剧,引起神经元肿胀、凋亡和坏死。这些细胞因子或致炎因子共同参与缺氧缺血后的脑损伤过程,其机制复杂并且相互交错。NSE对维持神经系统的生理功能极为重要,作为脑组织损害后的标志物具有敏感性和特异性。有研究证实,NSE释放量与神经细胞死亡数量、脑损伤程度呈显著正相关,而与胶质细胞等无关,因而认为NSE是一种可靠的特异性神经细胞损伤的定量生化指标[9]。
Emst等在1935年发现了GM1,它是哺乳类神经节苷脂的主要种类,在脑灰质中含量最高。在细胞—细胞间相互作用、细胞生长、分化、信号转导、适应细胞质膜环境变化及神经发育方面起到重要作用。研究表明,新生大鼠脑缺氧缺血损伤后海马区内源性GM1明显减少[10]。外源性 GM1易于通过血—脑屏障,嵌入损伤的神经细胞膜,调节膜介导的细胞功能,刺激中枢神经系统损伤后潜在的代替机制,抵抗各种因素对神经元的损害,延缓损害的发展,保护未受损组织,并能促进体外培养的神经元的存活及生芽[11]。本研究采用GM1治疗HIE患儿,结果显示GM1组总有效率、NBNA评分高于对照组;治疗后血中的IL-1β、NSE、ICAM-1细胞因子水平较治疗前明显降低。提示GM1对HIE治疗有效,优于常规疗效,其机制可能是:①降低IL-1β、ICAM-1水平,改善炎症和免疫反应;②对脑神经细胞具有一定的保护作用,改善神经细胞代谢,促进神经细胞损伤修复,降低血NSE水平;③减轻脑损伤、促进脑的发育和改善预后。
[1]Shalak L,Periman JM.Hypoxic-Ischemic brain injury in the term infant-currentconcepts[J].Early Hum Dev,2004,80(2):125-141.
[2]曹艳华,王玲,惠延平,等.新生大鼠脑缺氧缺血后海马CA1区HSP70表达及 GM1作用[J].第四军医大学学报,2003,24(12):1097-1099.
[3]何斌,张劲松,邵斌霞,等.神经节苷脂GM-1对脑缺血再灌注大鼠诱导型-氧化氮合成酶的影响[J].南京医科大学学报(自然科学版),2008,28(2):206-209.
[4]中华医学会儿科学会新生儿学组.新生儿缺氧缺血性脑病诊断标准[J].中华儿科杂志,2005,43(8):584.
[5]鲍秀兰.塑造最佳的人生开端[M].2版.北京:中国商业出版社,2002:355-370.
[6]刘虹,徐丽云.神经节苷脂治疗新生儿缺氧缺血性脑病疗效观察[J].临沂医学专科学校学报,2003,25(3):195-196.
[7]Yang GY,Gong C,Qin Z,et al.Tulllor neerosis factor alpha expression produces inereased blood-brain barraier permeability following temporary foeal cerebral isehemia in mice[J].Brain Res Mol Brain Res,1999,69(l):135-143.
[8]Otto VL,Heinzel-Pleines UE,Gloor SM,et al.sICAM-1 and TNF-alpha induce MIP-2 with distinct kinetics in astroeytes and brain mierovaseular endothelial cells[J].J Neurosei Res,2000,60(6):733-742.
[9]Oertel M,Schumacher U,McArthur DL,et al.S-100B and NSE:markers of initial impact of subarachnoid haemorrhage and their relation to vasospasm and outcome[J].J Clin Neurosci,2006,13(8):834-840.
[10]Ramirez MR,Muraro F,Zylbersztejn DS,et al.Neonatal hypoxia ischemia reduces ganglioside,phospholipid and cholesterol contents in the rat hippocampus[J].Neuroscience Research,2003,46(3):339-347.
[11]胡志兵,陆雪芬,郑德枢,等.神经节昔脂GM1对新生大鼠缺氧缺血性脑损伤保护作用的实验研究[J].临床神经病学杂志,2001,14:162.

