低危骨髓增生异常综合征免疫表型分析
孙富英,金洁萍,毛淑丹
(辽宁医学院第一附属医院,辽宁 锦州 121001)
骨髓增生异常综合征(MDS)是造血干/祖细胞(CD34+)的恶性克隆性疾病,表现为骨髓原始细胞形态和数目异常、无效造血及不同程度的外周血细胞数目减少,并高风险地向急性白血病转化[1]。国内外研究证实,免疫表型分析有助于MDS的诊断及预后评估,但低危MDS患者免疫表型分析报道较少。本研究对低危MDS患者骨髓免疫表型分型诊断及鉴别诊断的临床意义进行了探讨。
1 资料与方法
1.1 临床资料 2008年3月~2010年12月我院MDS住院患者27例(MDS组),均依据2008年WHO标准分型确诊[2]。男17例、女10例,年龄32~86岁、中位年龄58岁;其中RA型4例,RAS型4例,RCMD型16例,RAEB-1型3例。27例均为低危(IPSS评分0~1.0分)MDS患者,其中骨髓增生低下6例。另选择再生障碍性贫血(AA)患者12例(AA组),男7例、女5例,年龄25~76岁、中位年龄41岁;对照组18例,男8例、女10例,年龄26~79岁、中位年龄47岁;其中,外周血单纯红细胞减少轻度贫血的缺铁性贫血11例,外伤截肢7例。三组性别、年龄差异无统计学意义。
1.2 方法 检测标本均经过对方知情同意后采集,然后行骨髓涂片、流式细胞术分析及常规染色体核型分析(染色体核型分析对照组除外)。流式细胞仪为美国Beckman Coulter公司FC500MPI型,发射荧光采用488 nm激光激发。采取研究对象的骨髓液2~3 ml EDTA抗凝,对经溶血素裂解红细胞骨髓中所有有核细胞进行分析。调整细胞数至(0.5~1.0)×106/ml,分别加入抗体 HLA-DR-FITC/CD33-PE/CD34-ECD/CD117-PC5/CD45-PC7、CD10-FITC/CD56-PE/CD34-ECD/CD19-PC5/CD45-PC7、CD5-FITC/CD7-PE/CD34-ECD/CD2-PC5/CD45-PC7、HLADR-FITC/CD11b-PE/CD34-ECD/CD15-PC5/CD45-PC7、CD11b-FITC/CD13-PE/CD16-ECD/CD15-PC5/CD45-PC7及阴性对照,取某一抗原表达≥20%为阳性。单克隆抗体为Beckman Coulter产品。
2 结果
2.1 MDS及各亚型、对照组、AA组之间CD34+测定结果 见表1。
表1 MDS组及各亚型、对照组、AA组CD34+测定结果(%,)
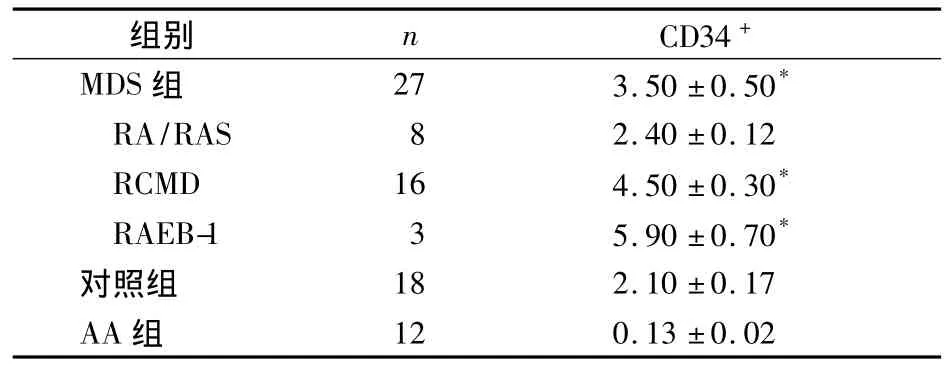
表1 MDS组及各亚型、对照组、AA组CD34+测定结果(%,)
注:与对照组、AA 组比较,*P <0.05
组别 n CD34+MDS 组 27 3.50 ±0.50*RA/RAS 8 2.40 ±0.12 RCMD 16 4.50 ±0.30*RAEB-1 3 5.90 ±0.70*对照组 18 2.10 ±0.17 AA组12 0.13 ±0.02
2.2 低危MDS免疫表型分析 27例MDS患者原始细胞、成熟粒细胞、单核细胞经检测可见各系细胞免疫表型异常表达,也有多重异常表达表现。①原始细胞免疫表型异常表现为:CD34+表达比例相对或绝对增加,表达 CD11b或 CD15、CD13、CD33,或HLA-DR表达缺失;异常表达淋巴系抗原 CD7、CD56。②成熟粒细胞免疫表型异常表现为:SSC减低(细胞内颗粒减少),粒系抗原之间表达关系异常以 CD13/CD16、CD11b/CD15 明显,CD10、CD11b、CD13、CD15、CD16抗原不同步表达,CD13或 CD33表达的缺失,出现异常CD56的表达,CD45表达减低。③单核细胞系表达异常表现为:单核细胞比例减少,CD11b、CD13、CD33、HLA-DR 表达关系异常,CD16、CD33表达缺失,异常表达CD56。27例MDS患者免疫表型特征见表2。
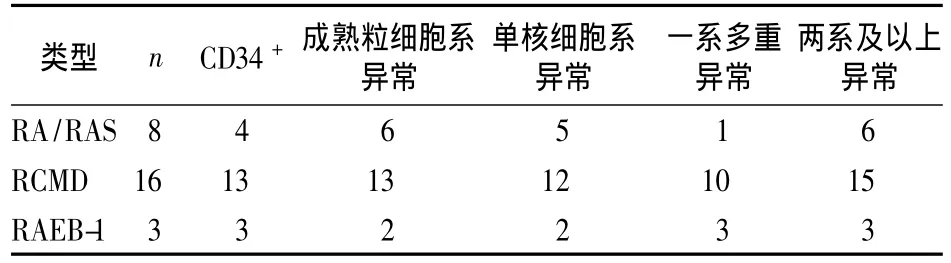
表227 例MDS患者免疫表型特征(例)
3 讨论
目前,细胞形态和细胞遗传学改变仍是MDS诊断的重要依据。但是MDS病态造血类型繁多,且缺乏特异性。染色体核型异常在MDS患者的检出率为40% ~70%[3],在幼稚细胞数不增高的 MDS患者中伴有异常核型尚不足32%[4],造成低危MDS患者诊断困难。为此,2006年维也纳国际工作会议将流式细胞术作为MDS的辅助诊断标准[5]。
本研究对27例低危MDS患者免疫表型分析结果显示,几乎所有MDS患者存在髓细胞分化抗原的异常表达;单一细胞群的多重表达在RCMD、RAEB-1较RA/RAS更明显;粒细胞系或单核细胞系表达异常患者占92.5%,结果与 van de Loosdrecht等[6]报道的92%病例存在粒细胞或单核细胞表达异常一致。MDS患者出现单一细胞免疫表型异常不具有特征性,因为单一细胞免疫表型异常也可见于营养不良性贫血等非MDS患者[7]。近年来,研究较多的流式积分对MDS预后的影响资料[6,8]显示,一系的多个异常表达或多系表达异常均确定为主要免疫表型异常,不同抗体组合对MDS诊断更具意义。27例低危MDS患者单一细胞群多重表达率为51.8%,而≥2个细胞亚群的表达率为88.9%。此显示流式细胞术比MDS遗传学检测阳性率33.3%(27例MDS患者9例染色体核型异常)更敏感。
随着MDS进展,CD34+细胞表达呈现增高趋势,流式细胞术检测MDS患者CD34+表达与骨髓细胞形态原始细胞数呈正相关[9]。低危组MDS患者CD34+表达在各亚型(RA/RAS、RCMD、RAEB-1)逐渐增高,此与文献[10]报道一致。尽管RA/RAS类型CD34+细胞与对照组差异无统计学意义,但低危MDS各类型与AA患者CD34+细胞表达不同仍具有鉴别诊断意义。本文24例RA/RAS、RCMD中,13例CD34+表达百分率高于正常对照组,但形态学原始细胞分类均在正常范围,提示低危组MDS早期已有MDS恶性克隆的存在。成熟粒细胞免疫表型表达的减少揭示了细胞分化障碍、凋亡增加导致外周血细胞一系或多系减少,反馈刺激骨髓异常造血干细胞增加,形成骨髓过度增生伴病态造血的低危组MDS发病机制。本结果还表明,MDS患者CD34+异常表达较形态改变更早。同时在低危MDS患者CD34+细胞有少部分表达CD7,其临床意义有待进一步探讨。
本研究发现,RA/RAS亚型见到粒细胞SSC的明显下降,但是根据 WHO分型标准 RA/RAS型MDS病态造血细胞小于粒细胞系细胞的10%,因此流式细胞术可检测到较形态学改变更早的微小变化。Lorand-Metze等[11]探讨MDS与外周血细胞减少的非克隆性疾病粒细胞SSC改变,结果发现MDS患者早幼粒细胞的SSC是减低的,并与外周血白细胞计数相关。通过CD34+细胞、早幼粒细胞和晚幼粒细胞的SSC分析能够鉴别87%的病例是否为克隆性。
总之,应用流式细胞术进行MDS的免疫表型检测,较染色体核型分析有高度的敏感性,亦较细胞形态学检测有独特的优势。
[1]肖冰,李建勇.骨髓增生异常综合症免疫表型特征及其临床意义[J].白血病·淋巴瘤,2006,15(2):154-155.
[2]Swerdlow SH,Campo E,Harris NL,et al.WHO classification of tumours of haematopoietic and lymphoid tissues[M].Lyon:IARC Press,2008:87-103.
[3]Steter-Strvenson M,Arthur DC,Jabbour N,et al.Diagnostic utility of flow cytometric immunopheno typing in myelodysplastic syndromes[J].Blood,2001,98(4):979-987.
[4]Mohamedali A,Gaken J,Twine NA,et al.Prevalence and prognostic significance of allelic imbalance by single-nucleotide polymorphism analysis in low-risk myelodysplastic syndromes[J].Blood,2007,110(9):3365-3373.
[5]Vanlet P,Horny HP,Bennet JM,et al.Definitions and standards in the diagnosis and treatment of myelodysplastic syndromes:Consensus statements and report from a working conference[J].Leuk Res,2007,31(6):727-736.
[6]van de Loosdrecht AA,Westers TM,Westra AH,et al.Identification of distinct prognostic subgroups in low and intermediate-l risk myelodysplastic syndromes by flow cytometry[J].Blood,2008,111(3):1067-1077.
[7]徐娟,郭轶先,赵弘,等.骨髓增生异常综合症患者细胞免疫表型异常[J].中国实验血液学杂志,2009,17(4)894-897.
[8]Craig FE,Foon KA.Flow cytometric immunophenotyping for hematologic neoplasms[J].Blood,2008,111(8):3941-3967.
[9]董天,朱焕玲,蒋能刚,等.骨髓增生异常综合症的免疫表型分析[J].临床血液学杂志,2009,22(9):454-456.
[10]Ogata K,Nakamura K,Yokose N,et al.Clinical significance of phenotypic features of blasts in patients with myelodysplastic syndrome[J].Blood,2002,100(12):3887-3896.
[11]Lorand-Metze I,Ribeiro E,Lima CS,et al.Detection of hematopoietic maturation abnomalities by flow cytometry in myelodysplastic syndromes and its utility for the differential diagnosis with non-clonal disorders[J].Leuk Res,2007,31(2):147-155.

