骨髓增生异常综合征的免疫表型和SURVIVIN、P15INK4B、TRF1基因表达
杨 力,姜胜华,胡彩华,徐瑞容,丁润生,尤学芬,秦 燕,刘 红
(南通大学附属医院,江苏 南通 226001)
骨髓增生异常综合征(MDS)是一组异质性造血干细胞克隆性疾病,其主要特征为无效造血所致的难治性血细胞减少、骨髓病态造血和具有发展成急性白血病的高危倾向。由于细胞增殖和分化异常,骨髓细胞表面标志常异常表达,免疫表型、基因表达多有异常。近年来,我们分析了50例MDS免疫表型,并检测其SURVIVIN、P15INK4B、TRF1基因mRNA表达情况。现报告如下。
1 资料与方法
1.1 临床资料 2006年12月~2011年2月我院住院及门诊患者50例,均根据WHO 1997标准诊断并分型,男28例、女22例,年龄21~83岁、中位年龄63岁。其中,难治性贫血(RA)23例,RA伴有环状铁幼粒细胞4例,RA伴多系发育异常11例,RA伴原始细胞增多12例。根据IPSS分期,50例患者中,低危25例,中危10例,高危15例。对照组30例,男17例、女13例,年龄26~76岁、中位年龄55岁;为正常体检者、再生障碍性贫血以及特发性血小板减少性紫癜患者。
1.2 方法
1.2.1 细胞表面标记检测 抽取MDS治疗前患者和对照组骨髓 1~2 ml,EDTA-K2抗凝。采用CD45/SSC双参数散点图设门识别幼稚细胞群、成熟粒细胞群和成熟单核细胞群。采用美国BD公司流式细胞仪测定不同细胞群的分化抗原表达情况。标准单克隆抗体包括藻红蛋白、异巯氰酸荧光素标记的 CD34、CD7、CD13、CD33 、CD11b、CD117 及同型对照等均购自美国BD公司。磷酸盐缓冲液(PBS,pH 7.2 ~7.4)稀释后调节细胞浓度至(2 ~5)×107/ml,室温下进行单克隆抗体标记。各试管内先加入不同单克隆抗体组合,再加入100 μl调整浓度后的单细胞悬液,充分混匀。然后加入2 ml红细胞裂解液,离心(1500 r/min)5 min,去上清,PBS洗涤1次,PBS固定上机检测。每次检测各种荧光素均设定相应抗体的同型阴性对照。
1.2.2 细胞RNA抽取及RT-PCR 收集骨髓单个核细胞提取RNA(Trizol法提取),在紫外分光光度计下测定RNA的OD值(OD值在1.6~2.0时可进行下一步实验),调节 RNA浓度为1 μg/μl备用。RT-PCR 步骤采用两步法,反应体系 RNA 5 μg、0.5 μg/μl Oligo(dT)1 μl、5 × reactiong buffer 4 μl、RNase inhibitor(20 U/μl)1 μl,dNTP mix(10 mmol/L)2 μl 和 RevertAidTMM-Mulv reverse transcriptase(200 U/μl)1 μl,总体积 20 μl。PCR 体系包括 cDNA 2 μl,上下游引物(10 pmol/μl)各 2 μl,dNTP mix(10 mmol/L)0.8 μl,10 × Taq buffer 5 μl,Taq酶(25 U/μl)0.5 μl和 MgCl2(25 mmol/L)。反应条件:β-actin mRNA(591 bp)上游引物 5'-AAGTACTCC GTGTGGATCG G-3',下 游 引 物 5'-ATCCTATC ACC TCCCCTGTG-3';94 ℃预变性 5 min,94℃变性30 s,58℃退火30 s,72℃延40 s,共计22次循环,最终72℃延伸5 min。SURVIVIN mRNA(309 bp)上游引物 5'-CTTTCTCAAGGACCACCGCATC-3',下游引物 5'-CAATCCATGGCAGCCAGCTGC-3';扩增条件为94℃变性2 min后,94℃ 45 s,61℃ 1 min,72 ℃ 1 min,循环 40次。P15INK4B mRNA(450 bp)上游引物 5'-TGGGGGCGGCAGCGATGAG-3',下游引物 5'-AGGTGGGTGGGGGTGGGAAAT-3';94℃ 预变性5 min,94℃变性30 s,56℃退火30 s,72℃延伸40 s,共计30次循环,最终72℃延伸5 min。TRF1 mRNA(499 bp)上游引物 5'-CCTCAGACAGCGAAGACTGA-3',下游引物 5'-GCCTGTAATCCGAGCTACTCA-3';首先94℃预变性5 min,然后94℃变性30 s,58 ℃退火30 s,72 ℃延伸60 s,共扩增35个循环,最后72℃再延伸7 min。PCR产物5 μl,与DNA marker在1.8%琼脂糖凝胶上电泳分离,电压100 V,电流60 mA。30 min后将凝胶置于四星图像分析仪中摄像,PCR条带的密度采用Scion image图像分析软件半定量分析。
1.3 统计学方法 用Stata 7.0软件,计量资料以表示,行单因素和两因素方差分析以及方差齐性检验。P≤0.05为差异有统计学意义。
2 结果
2.1 MDS患者骨髓细胞免疫表型 与对照组相比,MDS患者骨髓细胞原始群 CD45表达下降,CD34表达增多;粒细胞群CD34表达增多,CD13、CD33、CD11b表达下降,单核细胞表达 CD117和CD34。见表1。
2.2 SURVIVIN、P15INK4B、TRF1基因mRNA表达 与对照组相比,MDS患者骨髓单个核细胞SURVIVIN和 TRF1基因 mRNA表达增加,P15INK4B基因mRNA表达下降(P均<0.05)。从低危组到高危组,SURVIVIN基因和TRF1基因mRNA表达增加,P15INK4B基因表达下降(P均<0.05)。见图1 ~3。
表1 MDS患者和对照组骨髓细胞各抗原表达(%,)

表1 MDS患者和对照组骨髓细胞各抗原表达(%,)
注:与对照组相比,*P <0.05
组别 n 原始细胞群CD7 CD34粒细胞群CD13 CD33 CD11b CD34单核细胞群CD117 CD34对照组 30 0.9 ±0.5 1.0 ±1.2 24.2 ±2.1 15.3 ±2.6 80.2 ±3.4 1.2 ±0.7 4.3 ±1.5 4.1 ±2.1 MDS 50 3.2 ±1.6* 9.6 ±2.5* 17.0 ±2.9* 11.2 ±1.4* 56.2 ±2.4* 11.3 ±1.1* 1.2 ±2.1* 0.9 ±0.9*
3 讨论
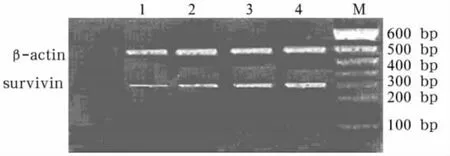
图1 SURVIVIN mRNA表达
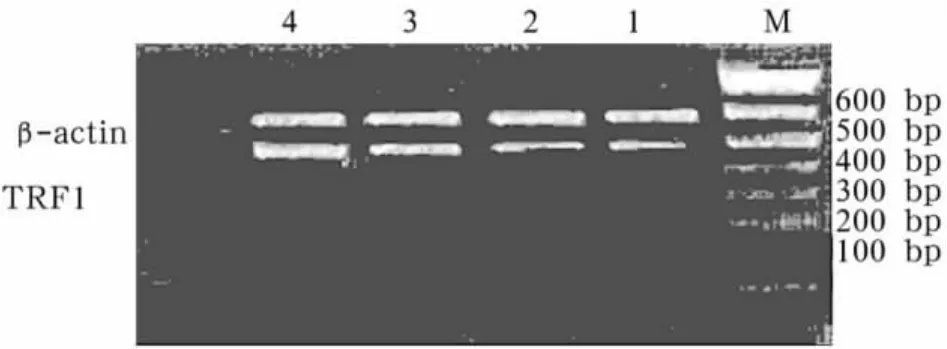
图2 TRF1 mRNA表达

图3 P15INK4B mRNA表达
大量研究表明,多参数流式细胞术有助于MDS诊断和预后评价[1]。我们研究发现MDS患者原始细胞群CD7和CD34高表达;粒细胞群CD34表达增多,CD13、CD33、CD11b表达下降;单核细胞表达CD117和 CD34。Ogata等[2]研究发现,CD7 在高危MDS中通常阳性,表达随MDS进展而增加,提示临床预后差,可以作为MDS不良预后相关的独立因素。原始细胞群高表达CD34,对MDS诊断有特征性[3],表达水平与疾病进展明显相关,表达增高者预后较差,易转化为白血病,生存期短。粒细胞群CD34表达增多,CD13、CD33、CD11b表达下降,提示细胞成熟障碍。Ogata等[4]发现MDS粒细胞群的趋化、游走、黏附及吞噬功能减弱,临床表现为病态造血严重,常常出现感染。CD117即干细胞生长因子受体,其表达随着向终末成熟血细胞分化而逐渐下降,单核细胞发育早期即失去表达CD117。MDS患者单核细胞CD117表达可增高,CD117表达率和疾病进展有关,与其他免疫表型异常相比,CD117表达增高对于诊断MDS的特异性较高。同样单核细胞发育早期也失去表达CD34,CD34表达也是MDS诊断的特异指标[5]。
SURVIVIN是近来发现的凋亡抑制蛋白(IAP)家族成员,它不仅具有抑制细胞凋亡的功能,而且参与了细胞增殖分化的调控,与一些肿瘤的预后相关,并且和MDS发病进展密切相关。其中SURVIVIN通过与CDK4相互作用形成SURVIVIN/CDK4复合体,使CDK2/cyclinE激活、Rb磷酸化,导致p21从其与CDK4的复合体中释放出来,并与线粒体的procaspase-3作用以抑制Fas介导的凋亡。蔡真等[6]发现,MDS患者SURVIVIN mRNA总阳性率高于正常对照组,高危组阳性率高于低危组,即随着MDS的进展,SURVIVIN mRNA的表达率随之增高。我们研究也同样证实,与对照组相比SURVIVIN基因在MDS患者中高表达,且与预后有关。
P15INK4B基因产物被认为是细胞周期蛋白DCDK4/6复合物的抑制物,细胞周期蛋白D-CDK4/6复合物可磷酸化视网膜母细胞瘤蛋白(RB蛋白)而导致转录因子的释放,启动细胞通过G1期限制点由G0期或G1期进入S期。P15INK4B表达增强,在MDS负向调节造血细胞增生和阻止其恶性转换、促进分化中起重要作用[7]。本研究也证实P15INK4B基因在MDS患者中低表达,且和MDS预后分级相关。TRF1是第1个被发现的哺乳动物的端粒相关蛋白,它与端粒双链DNA结合,改变端粒的结构,阻止端粒酶与端粒的结合,从而阻止端粒的延长。MDS患者端粒长度缩短与IPSS危险度分层有显著相关性,端粒长度缩短组的MDS患者有更低的血红蛋白浓度,更差的细胞遗传学改变和预后。TRF1作为端粒长度的负性调节因子,是揭示MDS预后不良的因素之一[8]。我们研究结果也同样证实了这一点。
MDS早期常很难诊断,不易和再生障碍性贫血、免疫相关性全血细胞减少等疾病鉴别。和国内外其他研究一样,我们研究发现MDS细胞免疫分型有其特征性,且有基因的异常表达,此可能成为MDS辅助诊断的指标之一。
[1]van de Losdrecht AA,Westers TM,Westra AH,et al.Identification of distinct prognostic subgroups in low and intermediate-1 risk myelodys plastic syndromes by flow cytometry[J].Blood,2008,111(3):1067-1077.
[2]Ogata K,Nakamura K,Yokose N,et al.Clinical significance of phenotypic features of blasts in patients with myelodysplastic syndrome[J].Blood,2002,100(12):3887-3896.
[3]徐娟.细胞免疫表型分析诊断骨髓增生异常综合征临床意义[J].中国实用内科杂志,2010,30(5):401-403.
[4]Ogata K,Kishikawa Y,Satoh C,et al.Diagnostic application of flow cy-tometrie characteristics of CD34+cells in low-grade myelodys plastie syndmmes[J].Blood,2006,108(3):1037-1044.
[5]徐娟,张维,万岁桂,等.骨髓细胞免疫表型分析在低幼细胞骨髓增生异常综合征诊断中的价值[J].中国实验血液学杂志,2009,15(6):1477-1481.
[6]蔡真,包悍英,Wolf-Dieter L,等.SURVIVIN、XIAP 在骨髓增生异常综合征患者及其细胞株MUTZ-l中的表达及意义[J].中华血液学杂志,2004,25(1):26-30.
[7]Tien HF,Tang JH,Tsay W,et al.Mythylation of the p15(INK4B)gene in myelodysplastic syndrome:it can be detected early at diagnosis or during disease progression and is highly associated with leukaemic transformation[J].Br J Haematol,2001,112(1):148-154.
[8]焦雪丽,陈子兴,岑建农,等.MDS患者端粒相关蛋白TRF1基因的表达[J].中国血液流变学杂志,2007,17(1):1-3.

