中心组合设计法优化雌二醇PEG-PLA微球制备工艺研究
赵 刚 苏 庆 李 静 刘拥军 朱庆增 姚丙建(山东省医学科学院药物研究所,济南 5006)
2(山东大学化学与化工学院,特种功能聚集体材料教育部重点实验室,济南 250100)
引言
原发性骨质疏松症是世界性流行病之一,该病的发生与体内雌二醇水平降低密切相关[1]。雌激素替代疗法可迅速纠正由于体内雌二醇匮乏导致的骨代谢调节失衡,增强再建骨转换,建立平衡的骨代谢;同时,还可改善血降代谢,及通过雌激素受体-α作用于T淋巴细胞,促进辅助淋巴细胞因子达到平衡,有效缓解更年期综合征等作用[2]。聚乳酸[poly(D,L-lactic acid),PLA]和聚乳酸羟基乙酸为疏水性聚合物,具有良好的生物降解和相容性[3],其主要不足是因疏水性较强,导致对难溶性药物不易释放及聚合物降解后产生大量乳酸,影响蛋白、多肽等药物的稳定性[4]。聚乙二醇单甲醚-聚D,L-乳酸嵌段共聚物[poly(ethylene glycol)methoxy-poly(D,L-lactic acid)block copolymers,PEG-PLA]为新型可生物解高分子载体材料[5],PEG-PLA为两亲性聚合物,与PLA相比该嵌段共聚物亲水性增强,玻璃化温度降低,降解速率加快,有利于难溶性药物的释放;而且可提高对蛋白及小分子多肽等药物的稳定性[6-7]。雌二醇不溶于水,溶于乙醇、丙酮等有机溶剂。本研究以PEG-PLA为载体材料,采用储库式可生物降解注射用微球给药系统,构建新型适用于雌二醇的注射用微球制剂[8]。选用O/W乳化-溶剂挥发法研制注射用载雌二醇生物降解缓释微球[9-10]。期望经皮下或肌肉注射给药能够维持1个月以上的药效,为雌激素替代疗法提供安全、有效的给药途径。
制剂的制备工艺优化是新制剂研究的核心内容之一。微球制备工艺条件优化通常采用正交设计和均匀设计,这两种方法具有试验次数较少,但精确度不足的特点,在模型拟合上多采用多元线性数学模型,拟合后目标函数的复相关系数较低,预测的准确性尚需进一步提高。中心组合设计(central composit design,CCD)[11-12],安排实验方法合理简便,试验次数较少,且在中心点进行重现性实验,可提高数学模型预测的准确性。在建立数学模型方面,采用多元二次多项式数学模型拟合,复相关系数较高,使预测值更接近于实测值,实验精确度显著提高[13]。制备工艺条件的优化,可根据因变量曲面法所描述的指标值对应自变量的变化规律,对多指标的工艺条件进行综合优化[14]。有时各指标间会相互影响,对于某一项指标有利的条件可能不利于另一指标。而因变量曲面法可综合考虑各项指标,优化出对各项指标均有利的自变量区间;并在优化的自变量区间内选择实验点,对优化的的结果进行验证。本项研究依据中心组合设计原理,用PEG-PLA为微球骨架材料,雌二醇为模型药物,优化长效注射用载雌二醇PEG-PLA生物降解缓释微球制备工艺,制备了符合设计要求的微球,取得较佳研究结果。
1 材料与方法
1.1 材料
聚乙二醇单甲醚-聚D,L-乳酸嵌段共聚物(PEG2000-PLA50000,山东大学化学与化工学院合成)、雌二醇(临湘环宇医药原料有限公司,批号20090301)、聚乙烯醇(PVA,acros organic公司提供,lot:A0256411)、二氯甲烷(DCM)、甲醇为分析纯,水为蒸馏水。
电动数控搅拌机(天津市威华实验仪器厂)、Waters alliance HPLC系统,备有996型二极管紫外监测器,光学显微镜及显微摄影系统(Olympus)、DPS数据处理系统。
1.2 方法
1.2.1 微球的制备
按处方量精密称取PEG-PLA和雌二醇,以二氯甲烷和甲醇混合溶剂为有机相,以一定浓度的PVA水溶液为水相,乳化温度为1℃~5℃,搅拌速度(1 000±10)r/min,将有机相用12号针头缓慢注入水相中,用水浴保持乳化温度,将乳状液倾入到400mL蒸馏水中,继续搅拌,直至溶剂挥发完全。过滤,收集微球,蒸馏水200mL洗涤后,真空干燥48h。
1.2.2 微球含量及包封率的测定
精密称取微球适量(含雌二醇约2.5mg)于10mL刻度试管,加入CH2CL2-MeOH(9∶1,V/V)2.5mL,漩涡震荡1min,至微球完全溶解,用甲醇-水(75∶25,v/v)溶液定容至10mL,摇匀。取上述溶液1mL置10mL容量瓶中,加入流动相:甲醇-水(75∶25,v/v)溶液稀释至刻度,摇匀,经0.45μm微孔滤膜过滤后,精密吸取10μL进样。HPLC条件:流动相为甲醇-水(75∶25,v/v),色谱柱C18(4.6mm×250mm,5μm),检测波长280nm,流速1mL/min,外标法定量。
包封率=(微球重量×微球药物含量/投药量)×100%
1.2.3 形态观察、粒径大小和分布
光学显微镜下观察微球的形态并拍照。采用显微计数法测定微球的粒径,根据测定的粒径数据,经统计学处理求得平均。粒径分散度用跨距(span of dispersity)表示,计算公式为跨距=(D90-D10)/D50,其中D10、D50、D90分别只有10%,50%,90%的微球其粒径均小于该值所示的粒径。
1.2.4 实验设计
在预试验的基础上,选择对微球制备影响较显著的3个因素作为考察对象。即水相乳化剂PVA浓度(%,W/W)(X1)、有机相PEG-PLA浓度(mg/mL)(X2)和理论载药量(X3)=投药量/(投药量+PEG-PLA投料量)(%,W/W)。根据CCD原理,每个因素设5个水平。各因素取值区间端点水平可根据预试验结果和制备所需微球的具体情况而定。表1为因素和水平及其对应的物理量。
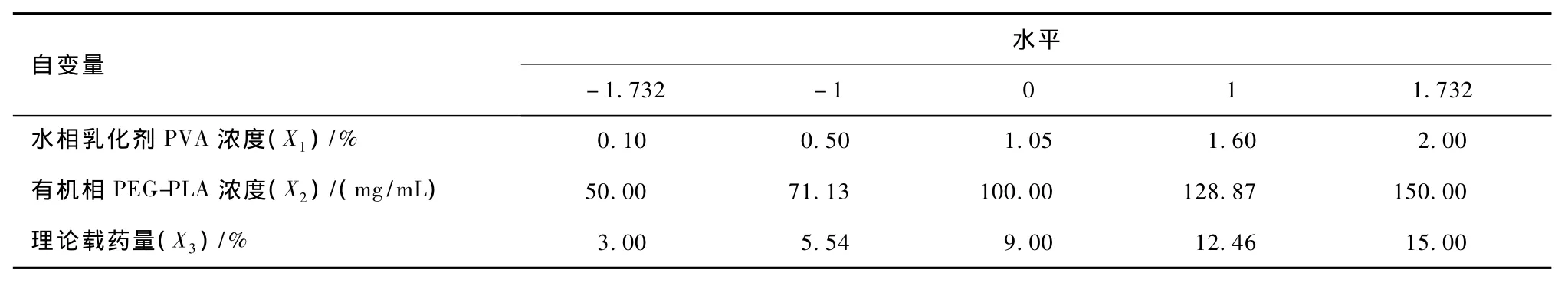
表1 因素和水平及其对应的物理量表Tab.1 Independent variable and their correspondent values in coded and physical form
模型拟合和预测:以产率、包封率、平均粒径和跨距为因变量;外水相中PVA浓度(X1)有机相PEG-PLA浓度(X2)和理论载药量(X3)为自变量,分别将各因素(自变量)各水平对指标(因变量)进行多元线性回归和二次多项式回归拟合。数学模型为
二次多项式回归:
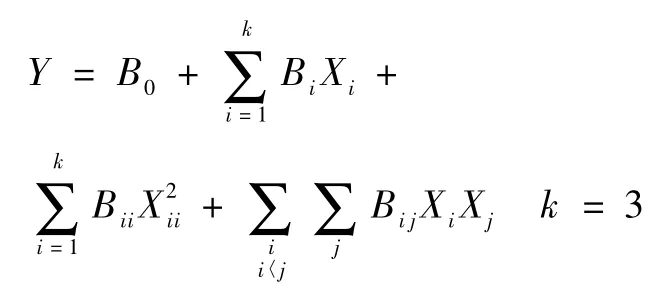
经逐步回归计算,求得复相关系数较高的目标函数,根据该目标函数,绘制三维因变量曲面(response surface)图,由因变量曲面图选取较佳的工艺条件,按优化的工艺条件制备微球,并进行预测分析。
2 结果与分析
2.1 模型拟合
各处方的产率、包封率、平均粒径和跨距见表2(5-8列),经多元线性逐步回归计算目标函数,其方程式如下:
产率
Y=74.843 2-3.687 7X1+0.088 5X2-0.235 3X3
(r=0.6474;P<0.05)
包封率
Y=98.203 1-3.426 6X1-0.032 9X2-0.2310X3
(r=0.450 7;P<0.50)
平均粒径
Y=18.557 8+1.528 8X1+0.075 9X2+0.355 7X3
(r=0.632 4;P<0.1)
跨距
Y=1.027 9-0.027 6X1-0.000 2X2+0.004 1X3
(r=0.097 3;P<1.0)
多元线性逐步回归拟合结果表明:复相关系数较低,自变量与因变量之间线性相关性较差,故不使用线性模型进行优化分析。
采用二次多项式回归模型进行拟合,经逐步回归计算目标函数,其拟合方程式为
产率
Y=40.524 4+15.615 2X1+0.395 3X2+1.459 5X3+0.131 1X32-0.068 8X1X2-1.380 3X1X3-0.026 1X2X3
(r=0.912 62;P<0.005)
产率与嵌段共聚物浓度(X2)显著相关(P<0.005),与PVA浓度(X1)有相关性(P<0.10)
包封率
Y=32.573 7+10.464 7X1+0.416 9X2+7.937 6X3+1.964 9X12-0.146 7X32-0.067 4X1X2-1.253 1X1X3-0.042 1X2X3
(r=0.964 15;P<0.001)
包封率与嵌段共聚物浓度(X2)、理论载药量(X3)呈显著相关性(P<0.001),与PVA浓度(X1)和理论载药量(X3)之间的交互作用(X1X3)呈显著相关性(P<0.005)。由于这种交互作用的存在,二次多项式比线性回归拟合表现出较好的相关性,复相关系数显著提高。
平均粒径
Y=9.713 1+32.108 5X1+0.134 3X2-1.591 2X3-5.267 1X12-0.000 5X22+0.021 0X32-0.143 2X1X2-0.577 7X1X3+0.021 8X2X3
(r=0.963 22;P<0.005)
平均粒径与PVA浓度(X1)呈显著相关性(P<0.001),与PVA浓度(X1)和嵌段共聚物浓度(X2)之间的交互作用(X1X2)呈显著相关性(P<0.005)。
跨距
Y=0.436 0+1.811 1X1-0.012 4X2+0.051 4X3+0.000 1X22-0.003 5X32-0.012 2X1X2-0.068 9X1X3+0.000 9X2X3
(r=0.962 79;P<0.005)
跨距与PVA浓度(X1)呈显著相关性(P<0.001),与PVA浓度(X1)和嵌段共聚物浓度(X2)之间的交互作用(X1X2)呈显著相关性(P<0.001),与PVA浓度(X1)和理论载药量(X3)之间的交互作用呈显著相关性(P<0.005)。
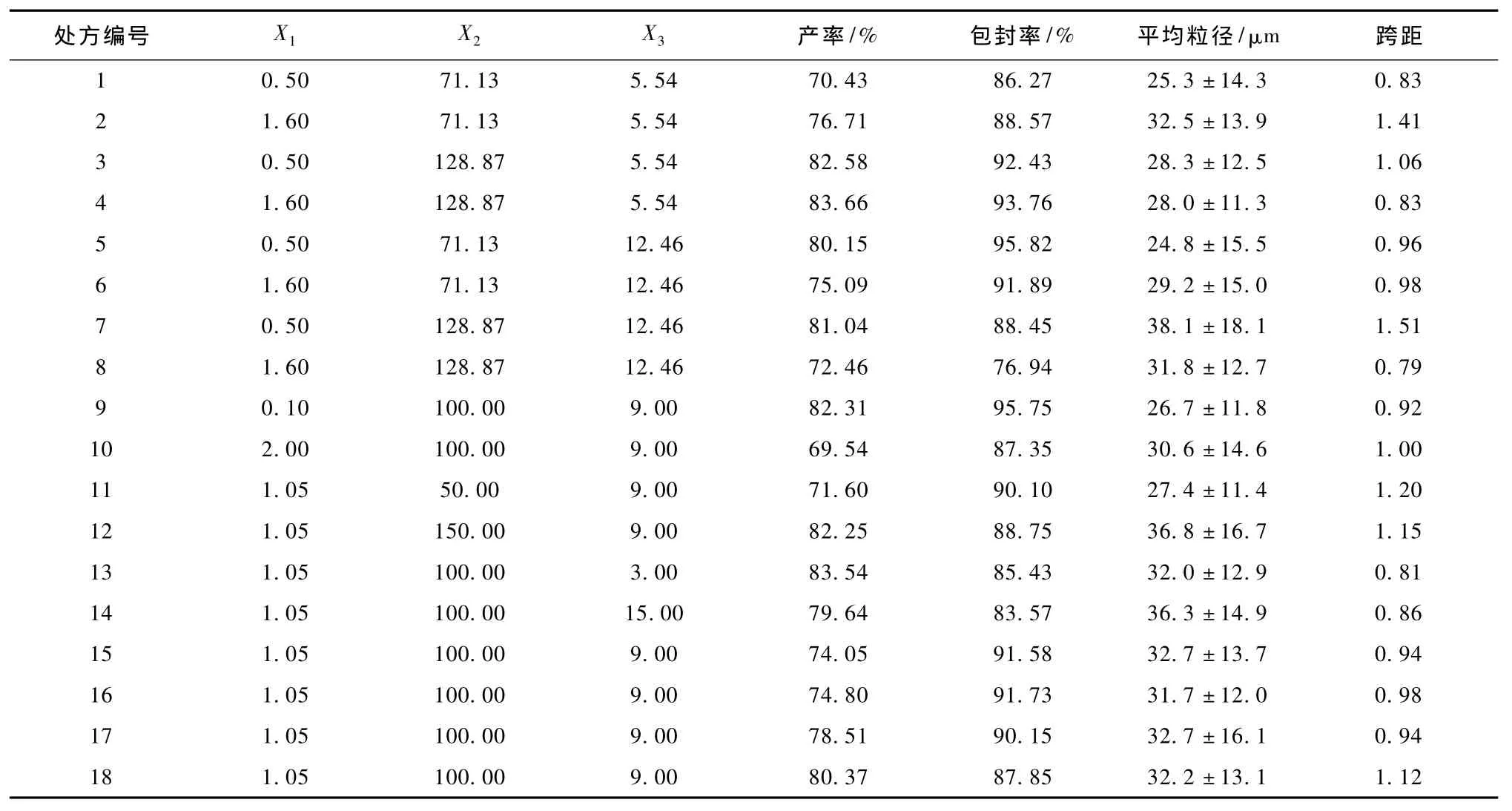
表2 微球制备影响参数及其对应的因变量测定值Tab.2 Influencing parameters for microsphere preparation(X1~X3)and corresponding measures of microspheres
2.2 优化与预测
2.2.1 产率
图1为依据二次多项式回归模型拟合的产率的目标函数计算得到的效应曲面图。该图表明:X2增加产率显著提高。
2.2.2 包封率
图2为依据二次多项式回归模型拟合的包封率的目标函数计算得到的效应曲面图。该图表明:X2和X3的增加有利于提高包封率。
2.2.3 平均粒径
图3为依据二次多项式回归模型拟合的平均粒径的目标函数计算得到的效应曲面图。该图表明:平均粒径随X2增加而显著增大。在X2较小(50mg/mL)时,X1增加平均粒径增大;在X2较大(150mg/mL)时,X1增加对平均粒径影响很小。
2.2.4 跨距
图4为依据二次多项式回归模型拟合的跨距的目标函数计算得到的效应曲面图。该图表明:随X1的增加跨距呈逐渐增大趋势。
2.2.5 微球制备的优化条件
表3为根据三维效应曲面得到的微球制备的优化实验条件。在此优化条件下制备的微球的性能指标如表4所示,预测值和实测值的偏差在可接受的范围之内。优化前后制备的微球外观对比如图5所示,从外观看有明显改善。
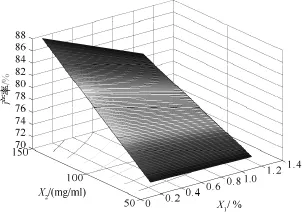
图1 产率的效应曲面图:产率为有机相PEG-PLA浓度(mg/mL)(X2)和水相乳化剂PVA浓度(%,W/W)(X1)的函数,理论载药量(X3)取中值9%(W/W)Fig.1 Predicted response surface of yield as a function of PEG-PLA concentration in organicphase(X2)and polyvinyl alcohol concentration in aqueous phase(X1),with theoretical drug content(X3)equal to 9.00%.
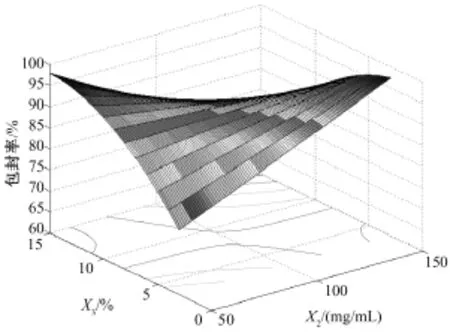
图2 包封率的效应曲面图:包封率为有机相PEG-PLA浓度(mg/mL)(X2)和理论载药量(%,W/W)(X3)的函数,水相乳化剂PVA浓度(X1)取中值1.05%(W/W)Fig.2 Predicted response surface of loading efficiency as a function of PEG-PLA concentration in organic phase(X2)and theoretical drug content(X3),with polyvinyl alcohol(X1)equal to 1.05%.

表3 根据三维效应曲面图优化的自变量区间Tab.3 Optimal range of independent variables obtained from three-dimensional response surface plots
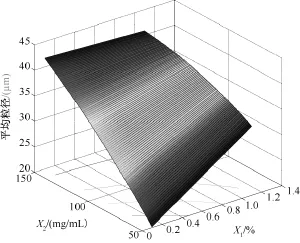
图3 平均粒径的效应曲面图:平均粒径为水相乳化剂PVA浓度(%,W/W)(X1)和有机相PEG-PLA浓度(mg/mL)(X2)的函数,理论载药量(X3)取中值9%(W/W)Fig.3 Predicted response surface of mean diameter as a function of polyvinyl alcohol concentration in aqueous phase(X1)and PEG-PLA concentration in organic phase(X2),with theoretical drug content(X3)equal to 9.00%
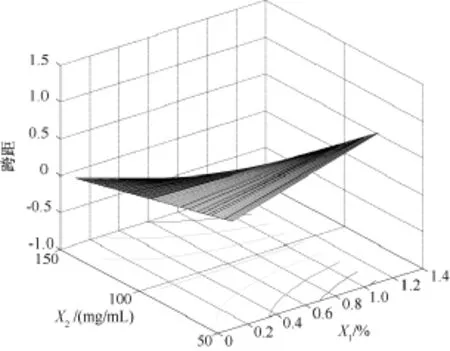
图4 跨距效应曲面图:跨距为水相乳化剂PVA浓度(%,W/W)(X1)和有机相PEG-PLA浓度(mg/mL)(X2)的函数,理论载药量(X3)取中值9%(W/W)Fig.4 Predicted response surface of span of dispersity as a function of polyvinyl alcohol concentration in apueous and PEG-PLA concentration in organic phase(X2),with theoretical drug content(X3)equal to 9.00%
3 讨论
3.1 PVA浓度对产率和跨距的影响
由三维因变量效应曲面图(见图1)可以看出,随PVA浓度的增加微球产率逐渐增加。连续相中PVA浓度增加使油/水界面张力显著降低,Laplace压力梯度ΔP=2γ/R(R为液滴半径,P为压力)降低,体系界面过剩自由能γΔA(γ为界面张力,A为界面面积)降低。使形成乳状液的耗能降低。因此在其他条件一定时,增加PVA浓度,使ΔA增加,导致微球产率增加。但PVA浓度对微球中雌二醇的包封率有一定影响,在制备的微球圆整,碎片较少的前提下,应选择低浓度PVA,有利于提高包封率。PVA浓度与PEG-PLA浓度之间的交互作用对跨距的影响较显著。PEG-PLA在较高浓度(100~150mg/mL)条件下,PVA浓度降低,跨距有所减小。

图5 显微镜观察载雌二醇PEG-PLA微球(放大倍数:10×10倍)。(a)处方3样品;(b)优化后处方样品Fig.5 Optical micrograph of estradiol-loaded PEG-PLA microspheres(10×10).(a)the sample of formulation 3;(b)the sample of optimal formulation
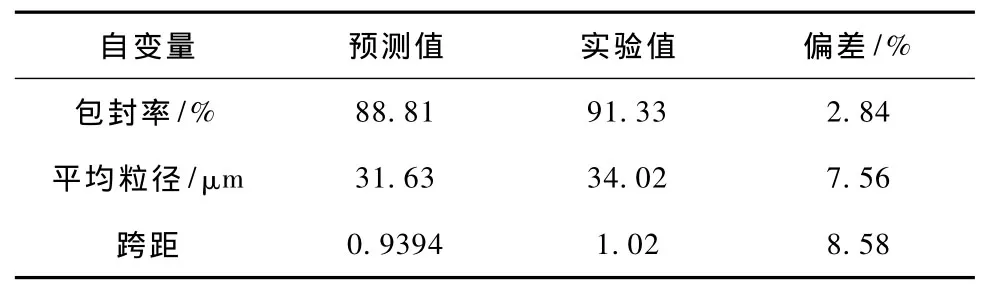
表4 根据优化的实验条件制备载雌二醇PEG-PLA微球,其包封率、平均粒径及跨距的预测值和实验测定值Tab.4 Predicted and experimental values of loading efficiency,mean diameter and Span of dispersity of estradiol-loaded PEG-PLA microspheres prepared according to the optimal experimental Conditions(X1=1.10% X2=100mg/mL X3=5.00%)
3.2 PEG-PLA浓度对包封率的影响
根据三维因变量效应曲面图(图2),PEG-PLA浓度变化对包封率影响显著。PEG-PLA浓度升高,有机相粘度增大,在乳状液中的乳滴固化形成微球的过程中,分散相中的溶剂被萃取,在空气/水界面挥发,随着溶剂的移除,乳滴逐渐固化形成微球,分散相中较高浓度的PEG-PLA可使乳滴表面的囊壁层快速形成并使乳滴固化时间缩短,减少药物从分散相向连续相的迁移,有助于提高包封率。且较高浓度的PEG-PLA也有利于微球的形成。
3.3 理论载药量对包封率的作用
由于雌二醇在水中不溶,采用O/W乳化溶剂挥发法制备微球可达到较高的包封率。理论载药量愈高,向水相扩散泄漏药物的百分比愈小,微球的包封率也相应增大。但理论载药过高时,药物在有机相中溶解度趋于饱和,在溶剂挥发移除过程中药物在O/W界面富集,随着溶剂萃取挥发过程的进行,在微球表面会析出药物结晶。
此外,在溶剂挥发乳滴逐渐固化形成微球的过程中,温度是影响微球成形的重要因素之一,此过程适合在较低温度、机械搅拌较平稳条件下进行,可减少碎片生成,有利于微球形态圆整及提高包封率。
4 结论
中心组合设计法优化处方和制备工艺,方法简便,可对多因素和多指标的实验进行综合优化筛选,对试验结果预测较准确,是进行多因素及多指标处方和制备工艺优化筛选的较佳方法。制备载雌二醇PEG-PLA微球符合要求,具有临床应用前景。
[1]Horowitz MC.Cytokines and estrogen in bone:anti-osteporotic effects[J].Science,1993,260(5108):626-627.
[2]Xia Xian,Zhang Shaofen,Yu Yinhua,et al.Effects of estrogen replacement therapy on estrogen receptor expression and immunoregulatory cytokine secretion in surgically induced menopausal women[J].Journal of Reproductive Immunology,2009,81(1):89-96.
[3]赵刚,平其能,田长青,等.注射用雌二醇聚乳酸羟基乙酸缓释微球生物相容性研究[J].中国生物医学工程学报,2005,24(6):793-795.
[4]Jiang Wenlei,Schwendeman SP.Stabilization of tetanus toxoid encapsulated in PLGA microspheres[J].Molecular Pharmaceutics,2008,5(5):808-817.
[5]梅兴国.微载体药物传输系统[M].武汉:华中科技大学出版社,2009:45-81.
[6]Sasatsu M,Onishi H,Machida Y.Preparation of a PLA-PEG block copolymer using a PLA derivative with a formyl terminal group and its application to nanoparticulate formulation[J].International Journal of Pharmaceutics,2005,294(1-2):233-245.
[7]Jiang Wenlei,Schwendeman SP.Stabilization and controlled release of bovine serum albumin encapsulated in poly(d,llactide)and poly(ethylene glycol)microsphere blends[J].Pharm Res,2001,18(6):878-885.
[8]Umeki N,Sato T,Harada M,et al.Preparation and evaluation of biodegradable microspheres containing a new potent osteogenic compound and new synthetic polymers for sustained release[J].International Journal of Pharmaceutics,2010,392(1-2):42-50.
[9]Wischke C,Schwendeman SP.Principles of encapsulating hydrophobic drugs in PLA/PLGA microparticles[J].International Joural of Pharmaceutics,2008,364(2):298-327.
[10]Dorati R,Genta I,Colonna C,etal.Investigation of the degradation behaviour of poly(ethylene glycol-co-D,L-lactide)copolymer[J].Polymer Degradation and Stability,2007,92(9):1660-1668.
[11]Montgomery DC.Design and Analysis of Experiments[M].New York:John Wiley& Sons,1984:445-474.
[12]Abu-Izza K,Garcia-ContrerasL,Lu DR.Preparation and evaluation of sustained release AZT-loaded microspheres.2.Optimization of multiple response variables[J].J Pharm Sci,1996,85(6):572-576.
[13]Ghasemi E,Raofie F,Najafi NM.Application of response surface methodology and central composite design for the optimisation of supercritical fluid extraction of essential oils from Myrtus communis L.leaves[J].Food Chemistry,2011,126(3):1449-1453.
[14]Martins SA,Prazeres DM,Fonseca LP,et al.Application of central composite design for DNA hybridization onto magnetic microparticles[J].Analytical Biochemistry,2009,391(1):17-23.
——与非适应性回归分析的比较

