大鼠肺泡Ⅱ型上皮细胞的分离、纯化和鉴定
张雪梅,陈海龙,王朝晖,张 利,纪 军
肺泡Ⅱ型上皮细胞(alveolar typeⅡ cells,ATⅡ)对维持肺泡的结构和功能具有重要意义,其功能包括增殖、合成和分泌肺表面活性物质、维持肺泡内外液体平衡及免疫调节作用。研究表明,急性肺损伤(acute lung injury,ALI)时肺组织的病理变化表现为肺泡上皮细胞的严重损伤。ATⅡ在肺损伤后肺泡上皮的修复与更新、表面活性物质的分泌、肺水转运过程中均有重要意义[1-2]。但由于ATⅡ具有特殊的生物学特性,尚未形成细胞株供研究用,且其分离、纯化、鉴定及原代培养的操作较为繁琐,细胞形态功能易发生变化,给研究工作带来不便。本实验是在总结和借鉴国内外学者经验的基础上,改良大鼠ATⅡ的分离、培养及鉴定方法。
1 材料
1.1 实验动物 SPF级雄性SD大鼠20只(大连医科大学动物实验中心,许可证号SCXK(辽)2002-0002),体质量180~220 g。
1.2 主要实验仪器 细胞培养箱(Heraeus德国);研究级荧光倒置生物显微镜(Leica美国);低温离心机(Sigma美国)。
1.3 主要实验试剂 达尔伯克必需基本培养基(DMEM,GIBCO公司);胎牛血清(FBS GIBCO公司);大鼠IgG(Sigma公司);脱氧核糖核酸酶(DN-ase,Sigma公司);胰蛋白酶(Difico公司);SP-A多克隆抗体(Santa Cruz公司);SABC试剂盒(武汉博士德生物工程有限公司)。
1.4 主要溶液 10%水合氯醛溶液。溶液Ⅰ:140 mmol/L NaCl,5 mmol/L KCl,10 mmol/L HEPES,6 mmol/L葡萄糖,0.2 mmol/L EDTA,2.5 mmol/L磷酸氢钠缓冲液。溶液Ⅱ:溶液Ⅰ,2.0 mmol/L CaCl2,1.3 mmol/L MgS04[3]。用1 M NaOH调pH至7.4。溶液Ⅲ:溶液Ⅱ,0.25%胰蛋白酶,0.1%胶原酶。D-Hank液;0.25%胰蛋白酶,0.25%DNaseⅠ溶液。
2 方法
2.1 肺组织的消化及细胞混悬液的制备 大鼠腹腔注射10%水合氯醛3 mL/kg,肝素400 U/kg。消毒,气管插管,腹主动脉放血活杀,剪开胸腔,去除胸腺。注射器吸取溶液Ⅱ(预温至37℃),于右心耳的位置轻轻进入朝肺动脉的方向注入,灌洗至全肺呈苍白色以去除血细胞,灌注量20 mL;经气管插管用溶液Ⅰ灌洗8次,再用溶液Ⅱ灌洗2次,至灌洗液清亮,去除巨噬细胞;溶液Ⅲ灌洗1次。快速取出肺移入超净操作台,溶液Ⅱ冲洗肺表面,经气管注入预温至37℃、0.25%胰酶消化液20 mL。37℃水浴消化25 min。去除肺门、大气道,在4 mL D-Hanks液中(含DNase 250 μg/mL),将肺剪碎至1 mm3大小。5 mL小牛血清灭活胰酶,移入无菌三角瓶,溶液Ⅱ补足至20 mL/肺,37 ℃水浴摇床130 r/min,5 min。细胞滤网过滤2次(150目,200目)。滤液移入50 mL无菌离心管以800 r/min、4℃离心8 min。细胞沉淀用10 mL DMEM重悬,计数[3-5]。
2.2 大鼠ATⅡ的纯化 IgG溶液倒入无菌培养皿内完全覆盖底部,22℃静置3 h,倒出IgG,PBS洗5次,DMEM洗2次,吸尽后另加入少量DMEM,4℃下静置24 h备用。将上述细胞悬液调整至浓度为106/mL,转移至用大鼠IgG包被的培养皿中,37℃、5%CO2培养箱孵育90 min,移出未黏附的细胞,4℃、800 r/min离心l0 min弃上清,无血清DMEM漂洗1次[6-7]。
2.3 ATⅡ的培养 DMEM重悬细胞沉淀,调整细胞浓度为2×106/mL,转入六孔培养板,每孔加细胞悬液1 mL,37℃,5%CO2培养。24 h后移去未贴壁细胞,加入DMEM培养基继续培养,观察细胞生长状况。
2.4 ATⅡ活力的测定 细胞悬液和0.5%台盼蓝染液按l∶1体积比混合后滴加盖玻片,1 min后计数100个细胞,用活细胞占计数细胞的百分比表示细胞活力。
2.5 ATⅡ的鉴定 用免疫组化染色和透射电镜观察来鉴定ATⅡ。无菌载玻片置于培养皿底部,培养24 h后完成细胞爬片。丙酮固定5 min,按SABC免疫组化试剂盒操作说明完成免疫组化染色。SP-A抗体工作浓度为1∶200,阴性对照用PBS代替一抗。用苏木素复染,中性树脂封片后观察结果[8]。透射电镜鉴定ATⅡ:细胞悬液2 000 r/min离心10 min,弃上清,2.5%戊二醛固定过夜,PBS漂洗、锇酸后固定、梯度乙醇脱水、丙酮包埋,切成50~70 nm厚的切片,醋酸铀染色,柠檬酸铅复染,透射电镜下观察。
3 结果
3.1 ATⅡ光镜形态 分离纯化的ATⅡ细胞单层贴壁生长,在光镜下呈圆或椭圆形,直径10~20 μm,胞浆内含较多包含体,胞浆中央可见圆形细胞核,内见核仁(见图1)。

图1 倒置显微镜下的ATⅡ(200×)
3.2 SP-A免疫组化鉴定 免疫组化阳性信号为细胞浆内分布均匀的浅褐色颗粒(见图2)。
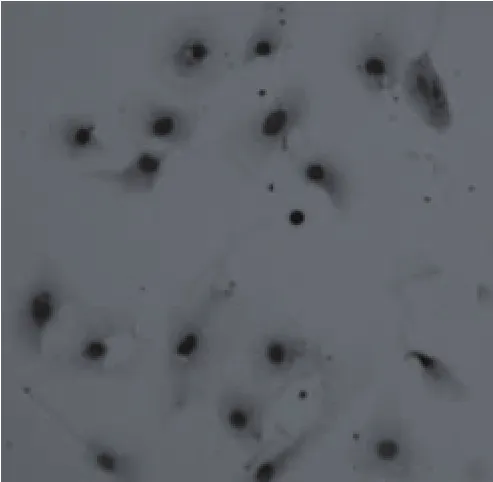
图2 ATⅡSP-A免疫组化鉴定(200×)
3.3 电镜下形态 电镜下可见ATⅡ细胞形状较规则,细胞表面有很多长短不一、粗细不等的微绒毛,胞核明显,胞浆内含有大小不一同心圆或平行排列的板层小体,少数细胞可以见到板层小体被分泌到细胞外(见图3)。
3.4 ATⅡ细胞活力和纯度 通过IgG免疫黏附纯化后的ATⅡ台盼蓝染色显示细胞活力为95%以上。
通过SP-A免疫组化染色纯化染色判定,纯化后ATⅡ的纯度可达92%。经上述初步鉴定,我们认为本实验培养的细胞为ATⅡ,且纯度、活力足够,可以用来进行下一步的实验研究。
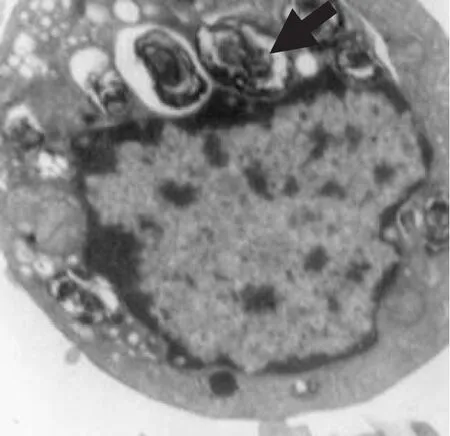
图3 ATⅡ电子显微镜鉴定(8 000×)
4 讨论
肺泡上皮组织主要由Ⅰ型和Ⅱ型上皮细胞构成,ATⅡ约占60%,其覆盖面积只占肺泡总面积的4%,细胞为立方形,其特征性结构是胞质中含有大量的板层小体。ATⅡ是肺泡上皮细胞的祖细胞,有增殖能力和定向分化能力。体外培养后变成类似于肺泡Ⅰ型上皮细胞的扁平状,但这一过程是可逆的。该细胞基本不传代,并且分离、培养难度较大,不易获得数量较多同时还具有较高纯度的细胞悬液[9]。曾庆富等[10]报道,大鼠ATⅡ原代培养18~24 h,ATⅡ大量贴壁;36~48 h,细胞平展呈多边形,形成细胞单层,胞浆内有大量反差明显的细小颗粒,细胞核明显;第4 d细胞内颗粒有所减少;第6~7 d颗粒明显减少,细胞特征无法辨认。体外培养ATⅡ的生化特性变化也快,培养超过24~48 h ATⅡ的卵磷脂和磷酸甘油酯的含量和合成下降。培养24 h内,SP-A和SP-B mRNA减少。因此,ATⅡ在原代培养第24~72 h内处于最佳生长状态,此时适合用于体外实验研究。由于ATⅡ具有特殊的生物学特性,尚不能形成细胞株供研究用,且其分离、纯化、鉴定及原代培养的操作较为繁琐,细胞形态功能易发生变化,给研究工作带来诸多不便。
体内外实验证明,ATⅡ增生受角质化细胞生长因子的调控[11-12],能分化为肺泡Ⅰ型细胞,在一定条件下也可逆转为ATⅡ。因此体外培养的ATⅡ细胞生物学特性仍是稳定的。
本实验发现,含20%FBS的DMEM培养液适宜ATⅡ细胞的生长。胰蛋白酶消化时间不宜过长。采用Dobbs等[3]年提出的IgG吸附纯化法可以得到纯度超过90%的ATⅡ细胞,并可将不需要的Ⅰ型上皮细胞及大多数成纤维细胞去除。
ATⅡ在光镜下胞浆内含较多包含体,细胞核明显。电子显微镜下可见到特异性的板层小体,这是鉴定ATⅡ细胞的最直接方法。ATⅡ细胞中SP-A含量最多,用SP-A免疫组化鉴定ATⅡ具有高度的特异性,同时也是一种简便的敏感方法。因此,电子显微镜与SP-A免疫组化结合鉴定ATⅡ可能是一种敏感、特异的鉴定方法。
[1]Mason RJ.Biology of alveolar type II cells[J].Respirology,2006,11 Suppl:S12.
[2]Andreeva AV,Kutuzov MA,Voyno-Yasenetskaya TA.Regulation of surfactant secretion in alveolar type II cells[J].Am J Physiol Lung Cell Mol Physiol,2007,293(2):L259.
[3]Dobbs LG,Gonzalez G,Williams MC.An improred method for isolating typeⅡcells in high yield and purity[J].Am Rev Respir Dis,1986,134(1):141.
[4]Corti M,Brody AR,Harrison JH.Isolation and primary culture of murine alveolar TypeⅡcells[J].Am J respir cell Mol Biol,1996,14(4):309.
[5]史雪梅,张惠兰,熊盛道,等.肺泡Ⅱ型上皮细胞的原代培养及生物学特性比较研究[J].中国病理生理杂志,2008,24(11):2282.
[6]Dobbs LG,Williams MC,Brandt AE.Changes in biochemical char⁃acteristics and pattern of lectin binding of alveolar typeⅡcells with time in culture[J].Biochem Biophys Acta,1985,846(1):155.
[7]Chen J,Chen Z,Narasaraju T,et a1.Isolation of highly pure alveolar epitheIial type I and typeⅡcells from rat lungs[J].Lab Invest,2004,84(6):727.
[8]郝嘉,李永旺,肖颖彬.大鼠肺泡Ⅱ型上皮细胞体外培养和鉴定[J].第三军医大学学报,2000,22(5):500.
[9]Gonzalez R,Yang Y H,Griffin C,et a1.Freshly isolated rat alveolar type I cells,typeⅡcells,and cultured typeⅡ cells have distinct molecular phenotypes[J].Am J Physio Lung Cell Mol Physiol,2005,288(1):L179.
[10]曾庆富,蒋海鹰,钱仲裴,等.肺泡Ⅱ型上皮细胞的分离纯化及原代培养[J].中华病理学杂志,1998,27(5):384.
[11]Qiao R,Yan W,Clavijo C,et al.Effects of KGF on alveolar epi⁃thelial cell transdifferentiation are mediated by JNK signaling[J].Am J Respir Cell Mol Biol,2008,38(2):239.
[12]Isakson BE,Lubman RL,Seedorf GJ,et al.Modulation of pulmo⁃nary alveolar type II cell phenotype and communication by extra⁃cellular matrix and KGF[J].Am J Physiol Cell Physiol,2001,281(4):C1291.

