rhIFN-γ对小儿瘢痕中离体成纤维细胞的影响
杨 澎,陈国强,陈雪观
瘢痕挛缩是小儿烧伤后常见的并发症。成纤维细胞的活跃代谢在瘢痕增生和挛缩过程中起着重要作用,其代谢受体内多种细胞因子的调控。干扰素γ(interferonγ,IFN-γ)作为一类具有多种生物活性的细胞因子,在瘢痕的治疗中的作用不断为人们所重视。国内外研究表明:IFN-γ可抑制瘢痕成纤维细胞的增殖分化,促进其凋亡,减少胶原合成及重构[1-3]。本文旨在研究IFN-γ对小儿瘢痕组织成纤维细胞生物学性状的影响,探讨其在防治瘢痕挛缩中的意义。
1 材料和方法
1.1 材料
1.1.1 标本来源 2009年8月—2010年10月嘉兴市第二院烧伤整形科收治的15例瘢痕挛缩患儿,其中手指8例,肘关节3例,足背部1例,颈部1例,足趾2例。年龄0~12岁,平均8岁。均无结缔组织疾病;无全身应用皮质类固醇激素史;1年内无瘢痕局部用药及放疗史;瘢痕表面潮红或紫色,充血明显,扪之坚硬,局部无溃疡,均导致局部畸变。病程3~12个月,平均6个月。正常皮肤15例,取自邻近正常皮肤。
1.1.2 主要试剂 新生小牛血清(杭州四季青生物工程材料有限公司)、rhIFN-γ(上海克隆生物技术有限公司)、四甲基偶氮唑(MTT()Sigma美国)、二甲基亚砜(DMSO)(上海振兴化工一厂)。
1.1.3 成纤维细胞的传代培养[4]取SD大鼠尾部制备胶原,并采用组织块法进行成纤维细胞原代培养。取第4~6代生长状态良好的对数期细胞,制成1×105/mL的细胞悬液,接种于96孔培养板(200 μL/孔),移入37 ℃、5%CO2孵箱中培养48 h(24 h后加入无血清DMEM培养液)。然后更换培养液:实验组分别加入浓度为100、1 000、5 000、10 000、20 000 U/mL的rhIFN-γDMEM培养液;对照组加入DMEM培养液。再继续培养72 h。
1.2 方法
1.2.1 细胞生长增殖测定 取上述96孔板,先加MTT溶液(20 μL/孔)继续培养4 h,弃上清液后加入150 μL DMSO,振荡10 min,使结晶物充分溶解;用酶联免疫检测仪测定各孔的吸光(OD)值(波长570 nm)。
1.2.2 细胞周期的分析 取上述96孔板,分别制成单细胞悬液,离心(1 000 r/min,5 min)收集沉淀的细胞,用70%冰乙醇固定4℃保存18 h后,加入碘化丙锭(PI)综合染液1 mL,室温下避光染色30 min,300目尼龙网膜过滤,流式细胞仪测细胞周期。
1.2.3 胶原的测定 取上述96孔板,取培养液上清50 μL加入6 mol/L的盐酸1.5 mL,130 ℃水解2 h,在100℃烤干后加入4 mol/L NaOH 1mL,氯胺T溶液1 mL,室温放置30 min,加入高氯酸溶液1 mL放置5 min,加入10%对二甲氨基苯甲醛1 mL,65℃水浴振荡显色15 min,冷却后分光光度计于560 nm测吸光度A。
1.2.4 FPCL收缩指数测定 取上述96孔板,用胰酶消化后制成含成纤维细胞的胶原网架(即fibroblast-populated collagen lattlice,FPCL)。加入15%的新鲜小牛血清DMEM 0.5mL/孔,每3 d换液1次。用透明座标纸测定培养后第6 d每一凝胶块直径的算术平均值,按下列公式计算出FPCL的收缩指数CI=[1-(D/D0)2]×100%。(D:凝胶块最大直径与最小直径平均数,D0:初始直径,33 mm)。
1.3 统计学处理 采用SPSS 13.0进行统计学分析,数据用均数±标准差(±s)表示,组间两两比较采用t检验,P<0.05认为差异具有统计学意义。
2 结果
2.1 rhIFN-γ对成纤维细胞生长增殖的影响 实验组加入rhIFN-γ 培养48 h后,100 U/mL、1 000 U/mL浓度组两类成纤维细胞的OD值与对照组比较差异无显著性(P>0.05);5 000 U/mL、10 000 U/mL、20 000 U/mL浓度组两类成纤维细胞的OD值与对照组比较差异有显著性(P<0.01),详见表1。
表1 rhIFN-γ对成纤维细胞OD值的影响(n=15,±s)
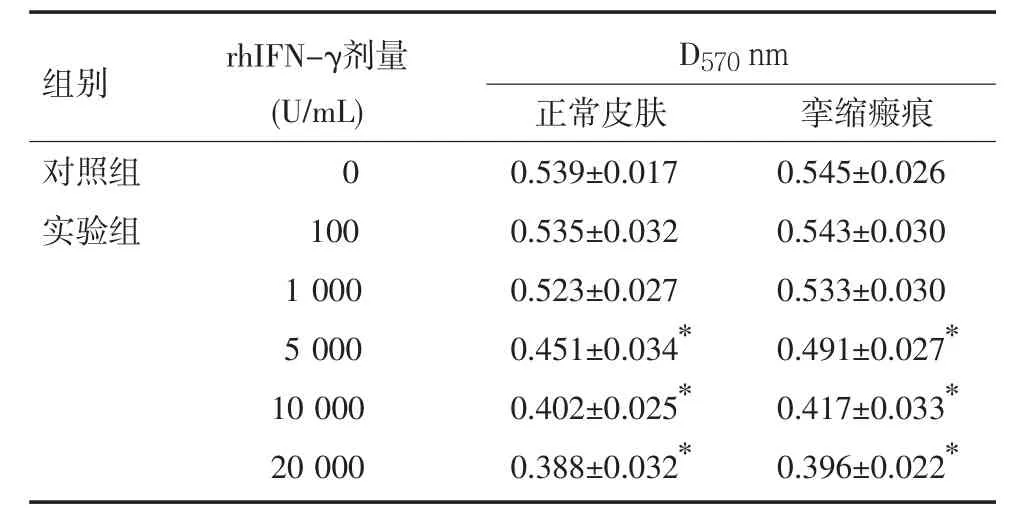
表1 rhIFN-γ对成纤维细胞OD值的影响(n=15,±s)
注:与对照组比较,*P<0.01
组别rhIFN-γ剂量(U/mL)D570nm正常皮肤 挛缩瘢痕对照组实验组0 100 1 000 5 000 10 000 20 000 0.539±0.017 0.535±0.032 0.523±0.027 0.451±0.034*0.402±0.025*0.388±0.032*0.545±0.026 0.543±0.030 0.533±0.030 0.491±0.027*0.417±0.033*0.396±0.022*
2.2 rhIFN-γ对成纤维细胞周期及胶原合成的影响 实验组加入rhIFN-γ培养48 h后,100 U/mL、1 000 U/mL组处于G1期的成纤维细胞百分比与对照组比较差异无统计学意义(P>0.05);而5 000 U/mL、10 000 U/mL、20 000 U/mL浓度组处于G1期的成纤维细胞的百分比均明显低于对照组,差异具有统计学意义(P<0.01),见表2。
2.3 rhIFN-γ对FPCL收缩指数的影响 用含有不同浓度rhIFN-γ的培养液分别作用于FPCL后,各实验组的收缩指数明显下降,与对照组比较差异具有统计学意义(P<0.01),见表3。
表2 rhIFN-γ对各组G1期细胞百分数及胶原合成的影响(n=15,±s)
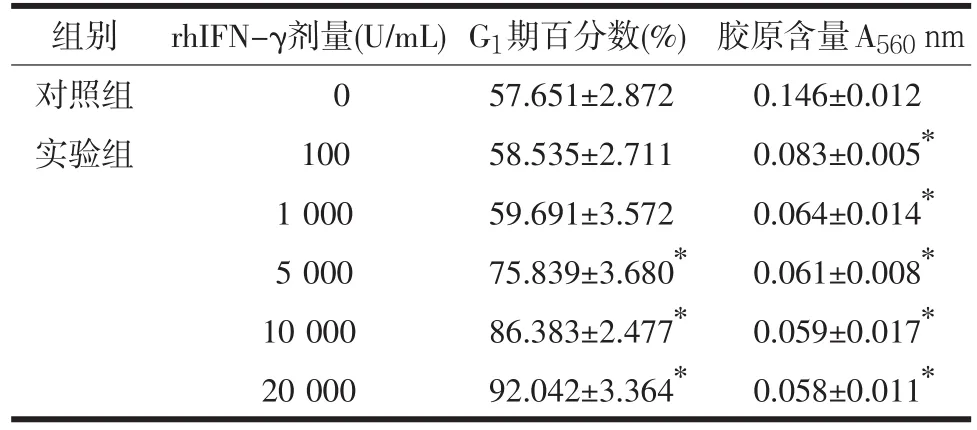
表2 rhIFN-γ对各组G1期细胞百分数及胶原合成的影响(n=15,±s)
注:与对照组比较,*P<0.01
组别对照组实验组rhIFN-γ剂量(U/mL)0 100 1 000 5 000 10 000 20 000 G1期百分数(%)57.651±2.872 58.535±2.711 59.691±3.572 75.839±3.680*86.383±2.477*92.042±3.364*胶原含量A560nm 0.146±0.012 0.083±0.005*0.064±0.014*0.061±0.008*0.059±0.017*0.058±0.011*
表3 不同浓度rhIFN-γ对EPCL直径D的影响(mm,n=15,±s)

表3 不同浓度rhIFN-γ对EPCL直径D的影响(mm,n=15,±s)
注:与对照组比较,*P<0.01
组别对照组实验组rhIFN-γ剂量(U/mL)0 100 1 000 5 000 10 000 20 000直径(mm)11.520±1.440 18.240±1.792*24.247±2.075*25.493±2.223*26.633±1.913*27.293±1.476*CI(%)87.636±3.178 69.174±6.032*45.645±9.279*39.897±10.430*34.550±9.160*31.408±7.559*
3 讨论
瘢痕挛缩是创伤愈合过程中瘢痕过渡收缩的表现,关于挛缩的动力源至今有着两种不同观点,一些研究认为,肌成纤维细胞是伤口收缩的动力源。据文献报道[5-6],伤口收缩时,成纤维细胞由迁徙型转变为含有丰富I、III型胶原和前纤维型,大约在伤后第9 d,发展成为终极型即肌成纤维细胞。Shin等[7]对肌成纤维细胞、成纤维细胞两组细胞群收缩模型的测试也表明肌成纤维细胞是瘢痕收缩的强力源。另一些研究则认为,成纤维细胞是引起创面收缩的动力。Tredget[8]指出,代表肌成纤维细胞特征的α-SMA出现在伤后的第12~15 d,此时最活跃的伤口收缩活动已基本结束。刘建波等[9]在动物实验研究中也发现,α-SMA阳性的肌成纤维细胞出现在创面收缩的高峰期之后。总之,不论哪种观点,成纤维细胞的代谢在瘢痕的挛缩中均扮演重要的角色。
小儿的皮肤薄嫩,受伤后更易留下瘢痕。同时由于惧怕疼痛、自控力差等原因,患儿对瘢痕挛缩的对抗性功能锻炼难以配合,常会残留明显的挛缩畸形。另外,小儿正处于生长发育的旺盛阶段,瘢痕的弹性和延展性很差,若受伤后瘢痕增生及挛缩防治不及时,会限制患儿的生长发育甚至致残,给患儿的成长及生活造成深远的影响。
干扰素γ具有抑制细胞增殖,诱导细胞分化,增强自然杀伤和巨噬细胞活性等作用,但不影响正常细胞的功能[10-11]。目前认为,它在瘢痕组织中含量低下,是瘢痕增生的负性调节因子。文献报道[12-13],干扰素γ能在下调Smad 3表达的同时,上调Smad 7的表达,并能在拮抗转化生长因子β1对成纤维细胞结缔组织生长因子mRNA的上调作用,减少结缔组织生长因子的表达水平,抑制TGF-β引起纤维化。
本实验用含不同浓度IFN-γ的培养液对离体的成纤维细胞进行培养,当浓度较高(>5 000U/mL)时,各实验组成纤维细胞的OD值与对照组比较差异有显著性。表明成纤维细胞的总数明显减少,此时各组处于G1期的成纤维细胞的百分比明显低于对照组,表明rhIFN-γ能阻断或延缓成纤维细胞从G0期进入G1期再过渡到S期的过程,使的成纤维细胞处于DNA合成前期,细胞分裂增殖受到抑制。本实验还进一步测定了各浓度组胶原含量及FPCL的收缩情况,并计算相应的CI。结果显示,各实验组胶原的合成和收缩指数均明显减少。表明rhIFN-γ对成纤维细胞的胶原合成以及FPCL的收缩具有的抑制作用。抑制程度与rhIFN-γ浓度之间具有一定量效关系。
Cornelissen等[14-16]报道,IFN-γ通过下调I、Ⅲ 型胶原mRNA的表达,促进胶原酶的表达等途径减少瘢痕中胶原的含量,还可以抑制肌成纤维细胞表达α-SMA的mRNA从而阻止向肌成纤维细胞分化。Tanaka等[17]的研究表明,IFN-γ治疗瘢痕挛缩主要是在瘢痕形成的早期通过抑制肌成纤维细胞的形成而发挥作用的。笔者认为,IFN-γ通过抑制成纤维细胞的增殖分化,降低其代谢活性,进而减少胶原的合成及向肌成纤维细胞的转化,达到抑制小儿瘢痕的增生及减轻瘢痕挛缩的作用。本实验仅取材于小儿挛缩瘢痕的组织,对于不同年龄阶段瘢痕作用的区别有待于进一步研究。
[1]Ishida Y,Kondo T,Takayasu T,et al.The essential involvement of cross-talk between IFN-gammaand TGF-betain theskin wound-Healing process[J].J Immunol.,2004,172(3):1848.
[2]张选奋,李荟元,鲁开化,等.TGF-β1或IFN-γ影响增生性瘢痕成纤维细胞增殖和胶原合成中PTK的作用[J].中华整形外科杂志,2005,21(1):36.
[3]丁丁,胡超,刘安东,等.重组人干扰素-γ对腭裂术后裸露骨面瘢痕成纤维细胞的影响[J].安徽医科大学报,2009,44(1):72.
[4]李荟元,鲁开化,郭树忠.新编瘢痕学[M].第四军医大学出版社,2003:293-305.
[5]Niessen FB,Spauwen PHM,Schalkwijk,et a1.On the nature of hy⁃pertrophic scars and keloids:A review[J].Plast Reconst Surg,1999,104(5):1435.
[6]Schmitt G,Desmouliere A,Gabbiani G.Heterogeneity of myofibro⁃blast phenotypic features:An example of fibroblast cell plasticity[J].Virchows Arch,1994,425(1):3.
[7]Shin D,Minn KW.The effect of myofibroblast on contracture of hy⁃pertrophic scar[J].Plast Reconstr Surg,2004,113(2):633.
[8]Tretget EE,Nedelec B,Scott PG,et a1.Hypertrophic scars,keloid,and contractures the cellular and molecular basis for therapy[J].Surg Clin North AM,1997,77(3):713.
[9]刘建波,李荟元.肌成纤维细胞在创面收缩中的作用[J].中国美容医学,2001,10(3):183.
[10]Meager A.Biological assays for interferons[J].J Immunol Meth⁃ods,2002,261(1-2):21.
[11]Blankenstein T,Qin Z.The role of IFN·gamma in tumor tranplan⁃mtion immunity and inhibition of chemical carcinogenesis[J].Curt OpinImmunol,2003,15(2):148.
[12]刘佳琦,胡大海,张战凤,等.γ干扰素对成纤维细胞结缔组织生长因子mRNA水平的影响 [J].第四军医大学学报,2008,29(23):2131.
[13]Liu JQ,Hu DH,Zhang ZF,et a1.Effects of interferon-gamma on the transforming growth factor beta/Smad pathway in keloid-de⁃rived fibroblasts[J].Zhong hua Shao Shang Za Zhi,2009,25(6):454.
[14]Sobral LM,Montan PF,Martelli-Junior H,et a1.Opposite effects of TGF-β1 and IFN-γ on transdifferentiation of myofibroblast in human gingival cell cultures[J].J Clin Periodontol,2007,34(5):397.
[15]Zhang X F,Li H Y,Lu K H,et a1.Signal roles of protein tyrosine kinase in transforming growth factor-hetal,or interferon-gamma regulated proliferation and collagen synthesis by fibroblasts from hypertrophic scar and normal dermis[J].Zhonghua Zheng Xing Wai Ke Za Zhi,2005,21(1):36.
[16]Desmouliere A,Brandt LR,Abdiu A,et al.α-smooth muscle ac⁃tion is expressed in a subpopulation of cultured and cloned fibro⁃blasts and is modulated by γ-interferon[J].Exp Cell Res,1992,201(1):64.
[17]Tanaka K,Sano K,Yuba K,et al.Inhibition of induction of myofi⁃broblasts by interferon gamma in a human fibroblast cellline[J].Int Immunopharmacol,2003,3(9):1273.

