青藤碱对肺癌A549细胞增殖的抑制作用
杨国才,雨 山,徐广全
青藤碱(sinomenine,SIN)是从中药青风藤中提取的生物碱单体,具有抗炎、免疫抑制、镇痛降压、抗心律失常等药理作用,已用于临床治疗类风湿性关节炎等[1]。近年研究显示,环氧合酶2(cyclooxygenase-2,Cox-2)与胃癌、肝癌、肺癌等多种肿瘤的发生发展密切相关,在非小细胞肺癌(non small cell lung carcinoma,NSCLC)组织中检测到Cox-2明显上调[2]。是否能通过抑制Cox-2的活性来治疗肿瘤,将有望成为新靶点[3-4]。有研究报道,SIN可能对Cox-2的活性有较强的抑制作用[5]。因此,研究SIN对A549细胞增殖及Cox-2活性的抑制作用,将可能为肺癌的治疗提供实验依据。
1 材料与方法
1.1 主要试剂及细胞株 青藤碱盐酸盐制剂(C19H23NO4)购自陕西省宝鸡市永嘉天然植物开发有限公司(产品批号YJ08011)。MTT检测试剂盒购自Amresco公司;羊抗兔Cox-2单克隆抗体(工作液1∶200)购自Santa Cruz公司;Annexin V-FITC/PI凋亡检测试剂盒购自北京赛宝公司。人肺癌A549细胞株由哈尔滨医科大学附属第二医学院科研实验中心提供。
1.2 实验方法
1.2.1 细胞培养及处理 A549细胞用含10%小牛血清的RPMI-1640培养,细胞置于37℃、含5%CO2饱和湿度的培养箱中。SIN用含血清的RPMI-1640培养液配制成梯度浓度母液,即1.0、2.5、5.0、10.0、20.0、25.0、50.0、100.0 mmol/L共8个浓度,现配现用。用时稀释成终浓度为 0.1、0.25、0.5、1.0、2.0、2.5、5.0、10.0 mmol/L8个梯度浓度。
1.2.2 MTT比色法 取对数生长期A549细胞,按2×104个细胞/孔密度接种于96孔板培养,每孔200 μL,24 h后换液。青藤碱组加入已配置好的含青藤碱终浓度分别为 0.1、0.25、0.5、1.0、2.0、2.5、5.0、10.0 mmol/L的RPMI-1640培养液200 μL。对照组为含A549细胞RPMI-1640培养液200 μL。另设空白对照组为无细胞的RPMI-1640培养液200 μL。每组设5个复孔,重复3次。继续培养24、48、72 h后,每孔加入MTT溶液(5 mg/mL)20 μL,避光继续培养4 h,吸出每孔内上清液,加入二甲基亚砜(DMSO)200 μL,振荡至结晶充分溶解,用酶标仪在 490 nm处测定各孔的吸光度A值(A490),按下列公式计算细胞生长抑制率:细胞生长抑制率(R)=(1-A490实验组)/A490对照组×100%
1.2.3 显微镜观察细胞形态及数目改变 将各处理组及各时间点状态下的细胞,在显微镜下观察细胞形态及细胞数目的改变。
1.2.4 流式细胞术检测早期凋亡 取对数生长期A549细胞,按2×106个细胞/孔密度接种于6孔板培养,以青藤碱干预细胞后,于24 h、48 h分别收取细胞。胰酶消化后调整细胞浓度为5×105~1×106个/mL,取1 mL细胞,1 000 r/min,4 ℃离心10 min,PBS反复冲洗细胞加入200 μL Binding Buffer,加入10 μ L Annexin V-FITC和5 μL PI,4 ℃避光反应30 min后,加入300 μL Binding Buffer,立即上机进行细胞凋亡检测分析凋亡指数。
1.2.5 细胞免疫组织化学SP法对Cox-2蛋白表达检测 将对数生长期细胞,以4×105个/孔,种于6孔板上。采用细胞免疫组织化学SP法。Cox-2抗体的效价为1∶100。以4%多聚甲醛固定40 min,PBS洗3次,3%过氧化氢室温孵育15 min,PBS洗3次,山羊血清室温孵育15 min,加入一抗,4℃过夜,PBS洗3次,加入通用型生物素标记的二抗室温孵育20 min,PBS洗3次,加入辣根酶标记链酶卵白素工作液室温孵育20 min,DAB显色。结果采用HPLAS-100彩色图像分析系统进行分析,表达强度用平均光度值表示。基本原理是衡量切片的图像中阳性细胞百分数的方法,统计阳性染色面积占被测量面积的百分比,最后取均值作为切片平均阳性染色面积的百分比值。
1.3 统计学处理 统计学方法处理用SPPS 12.0软件分析,计数资料用χ2检验,计量资料用t检验、多组样本间比较采用单因素方差分析(one-wayANOVA),相关性检验采用Pearson相关分析。
2 结果
2.1 MTT比色法检测SIN对肺癌A549细胞增殖的影晌 不同浓度SIN作用于肺癌A549细胞后,随着时间的延长和浓度的增加,SIN对其增殖的抑制作用也随之增强,见图1。计算出SIN对肺癌A549细胞的半数抑制浓度(IC50)如表1示。

图1 MTT比色法检测SIN对肺癌A549细胞增殖的影晌

表1 SIN对A549细胞的半数抑制浓度(IC50)
2.2 SIN对A549细胞形态学的影响 不同浓度SIN作用A549细胞后,随浓度和时间递增细胞数目明显减少,同时细胞形态发生变化,细胞出现凋亡,见图2。

图2 SIN对A549细胞形态学的影响
2.3 SIN对A549早期凋亡率的影响 以SIN浓度为0.5 mmol/L、1.0 mmol/L、2.5 mmol/L、5.0 mmol/L干预细胞,随SIN浓度增加及作用时间延长,A549细胞凋亡率呈递增趋势,见表2及图3。实验中各组机械性处理损伤的比率较低,均在5%左右。由图3可见,SIN处理组肺癌A549细胞凋亡率显著高于对照组(P<0.01),并呈时间和剂量依赖性特点。
表2 SIN对A549细胞早期凋亡的影响(±s)
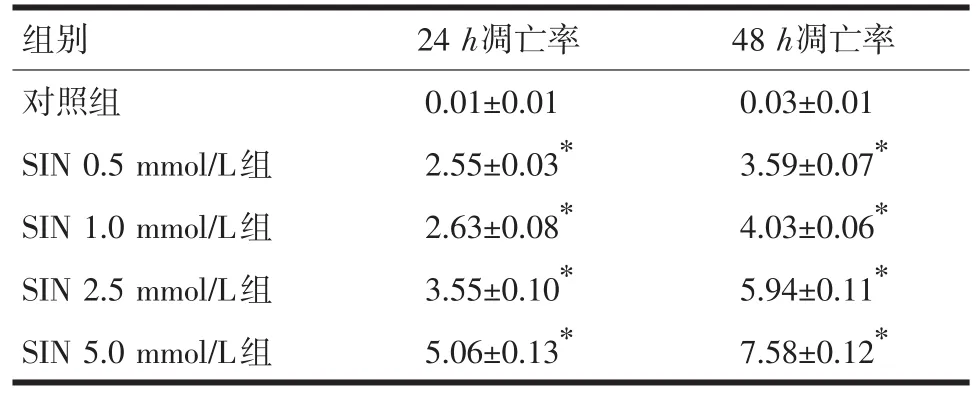
表2 SIN对A549细胞早期凋亡的影响(±s)
注:SIN各浓度组分别与相应对照组比较,*P<0.05
组别对照组SIN 0.5 mmol/L组SIN 1.0 mmol/L组SIN 2.5 mmol/L组SIN 5.0 mmol/L组24h凋亡率0.01±0.01 2.55±0.03*2.63±0.08*3.55±0.10*5.06±0.13*48h凋亡率0.03±0.01 3.59±0.07*4.03±0.06*5.94±0.11*7.58±0.12*

图3 流式细胞仪检测细胞凋亡结果
2.4 SIN对Cox-2蛋白表达影响 Cox-2主要在细胞膜和胞浆中表达,A549细胞胞浆中可见较多颗粒较大的棕黄色颗粒,细胞膜少量棕黄色DAB显色,Cox-2的平均光度为(0.371±0.051)。经SIN干预24 h后,A549细胞胞浆中仅见少许颜色较浅的棕色颗粒,细胞膜着色明显减少,Cox-2的平均光度为(0.183±0.044)。经t检验,两组间的差异有显著意义(P<0.01),见图4。
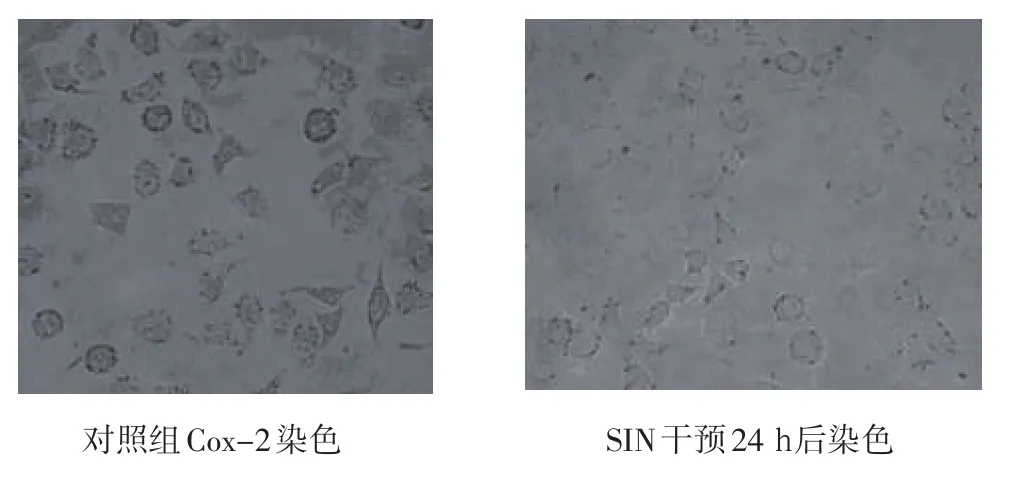
图4 SIN对Cox-2蛋白表达影响
3 讨论
SIN具有显著的抗炎镇痛作用,对体液免疫、细胞免疫均有不同程度的抑制作用。通过抑制心肌细胞膜离子的跨膜转运,可发挥抗心律失常作用。可通过降低中枢内cAMP水平,拮抗阿片类成瘾的戒断反应,且本身无成瘾性[6]。临床应用证明,安全范围大,不良反应少。近年来有研究表明,Cox-2与肿瘤发生发展及预后有着非常重要的关系。Kim、Ferrandina G等[7-8]均报,Cox-2表达阳性是导致治疗效果不佳和预后不良的因素之一。国外有研究报道,Cox-2在正常肺组织中不表达或极低表达,而在肺癌组织中呈强阳性表达[9-10]。越来越多的文献报道其对Cox-2活性的抑制作用,可干扰肿瘤细胞的增殖。
肿瘤的发生一方面由于细胞周期紊乱,细胞分裂失控,引起细胞无限制的增殖。另一方面是细胞凋亡的不足促进了肿瘤的发生与发展。本实验应用不同浓度SIN作用于肺癌A549细胞后,发现细胞的增殖明显受到抑制,并呈时间依赖性与剂量依赖性。同时细胞形态发生变化,细胞多呈凋亡细胞改变。说明SIN在体外可使肺癌A549细胞凋亡增加,对体外肺癌A549细胞增殖具有明显的抑制作用。
通过对细胞免疫组织化学方法对A549表达的Cox-2蛋白水平的测定,发现SIN具有较好的Cox-2蛋白抑制作用。说明SIN是一种比较好的Cox-2中药类抑制剂。另外本实验还通过流式细胞仪检测,从细胞凋亡的角度,分析了SIN对肺癌A549细胞增殖的抑制作用,发现SIN可能通过促进细胞早期凋亡来实现对A549细胞增殖的抑制作用。SIN对Cox-2蛋白表达的抑制这一结果为SIN应用于肺癌临床治疗提供了基础实验理论依据,可望成为治疗肿瘤的新靶点。
[1]Xu M,Liu L,Qi C,et al.Sinomenine versus NSAIDs for the treat⁃ment of rheumatoid arthritis:a systematic review and meta-analysis[J].Planta Med,2008,74(12):1423.
[2]田锋,王天佑,龚民,等.非小细胞肺癌环氧化酶-2的增强表达及其临床意义[J].中华外科杂志,2003,41(6):407.
[3]Ulivi P,Mercatali L,Zoli W,et al.,Silvestrini R.Serum free DNA and COX-2 mRNA expression in peripheral blood for lung cancer detection[J].Thorax,2008,63(9):843.
[4]Lee JM,Mao JT,Krysan K,et al.Significance of cyclooxygenase-2 in prognosis,targeted therapy and chemoprevention of NSCLC[J].Future Oncol,2007,3(2):149.
[5]孔庆峰,李军.青藤碱研究新进展 [J].中国中药杂志,2005,30(20):1573.
[6]Wang WH,Wang ZM,Studies of commonly used traditional medi⁃cine-ginger[J].China Journal of Chinese Materia Medica,2005,(30):1573.
[7]Kim YB,Kim GE,Pyo HR.Differential cyclooxygenase-2 ex⁃pression in squamous cell carcinoma and adenocarcinoma of the uterine cervix[J].Int J Radiat Oncol Biol Phys,2004,60(3):822.
[8]Ferrandina G,Ranelletti F O,Legge F.Prognostic role of the ratio between cyclooxygenase-2 in tumor and stroma compartments in cervical cancer[J].Clin Cancer Res,2004,10(9):3117.
[9]Harris RE,Beebe-Donk J,Alshafie GA.Cancer chemoprevention by cyclooxygenase 2(COX-2)blockade:results of case control studies[J].Subcell Biochem,2007,42:193.
[10]Krysan K,Reckamp KL,Sharma S,et al.The potential and ratio⁃nale for COX-2 inhibitors in lung cancer[J].Anticancer Agents Med Chem,2006,6(3):209.

