热敏脂质体介导的仿生矿化胶原凝胶的基础研究*
王燕坤 王 茜 武军驻 蔡洁明
基质小泡是细胞源性膜性成份,平均直径30mm-100nm,经常出现在肥大软骨,骨和牙齿等矿化组织内。含有天然或人工合成的磷脂的小泡即为脂质体。由于与生物膜很相似,近几年成为研究热点。例如非病毒基因载体[1]和载药系统[2]。另外,脂质体能像“微型反应器”一样提供一个相对保护性封闭的环境。脂质体的这个性质为其模拟基质小泡提供了可能性。因此以脂质体为工具来研究基质小泡介导的生物矿化有无可比拟的优点。
Pederson等应用合成的脂质体作为工具塑造热敏脂质体和温控自组装胶原形成可注射性前驱液[3]。但是其IF法合成脂质体体积远远大于基质小泡体积;存在胶原凝胶机械力不足;胶原降解速度快等缺点。
在前期研究[4]的基础上,本研究拟采用薄膜-超声法制备出小直径的载Ca2+和Pi脂质体模拟基质小泡,观察其特征并研究在早期龋模型上的应用。然而,在骨组织中矿化晶体是沉积在胶原纤维上,因此,我们将酸可溶性胶原引入,重建为矿化胶原溶液。
1.材料与方法
1.1 实验仪器和材料 RE-52A旋转蒸发仪(上海振捷实验设备有限公司,中国)、DM4000B正置显微镜(莱卡,德国)、S-4800型场发射扫描电镜(日立公司,日本)、DPPC(二棕榈酰磷脂酰胆碱 >99%,Avanti Polar Lipids公司,美国)、DMPC(二肉豆蔻酰磷脂胆碱>99%,Avanti Polar Lipids公司,美国)、CaCl2(分析纯,中国)、Na2HPO4(分析纯,中国)、自制大白鼠尾胶原等。
1.2 载Ca2+和Pi-脂质体的制备 采用逆向蒸发——超声法合成脂质体。将DPPC与DMPC按摩尔比9∶1混入烧瓶中,共20mg,向其中加入3ml氯仿。真空旋转蒸发形成一层薄膜。缓慢地加入1ml CaCl2溶液(0.2M),45℃水浴下摇晃水合10min。50℃下超声4min,直至液体变清亮。冷却至室温6500rpm离心12min。室温下向瓶中加入等体积的 NaCl溶液(0.285M)。涡旋混匀,14000rpm离心30min,保留沉淀。至少重复上述步骤六次,用比色法测直到无游离的离子,即得纯的载Ca2+脂质体悬液。同理制备载Pi的脂质体,测定各自的包封率。
1.3 胶原溶液的制备 取干燥I型自制鼠胶原,配制1.05mg/ml胶原溶液,使胶原浓度在最后的前驱液中为0.7mg/ml。
1.4 热触发自组装型HA/胶原复合体的制备先将载Ca2+和载Pi脂质体以2∶1(V∶V)混合,然后迅速将两种液体以1∶2(脂质体V∶胶原V)混合制成前驱液(即热触发自组装型HA/胶原复合体)。
1.5 脂质体基本特征的测定
1.5.1 脂质体直径的测定 按上述方法制备载Ca2+或Pi的脂质体悬液。提取微量液体,用NaCl溶液(0.285M)稀释,置入粒度分析仪,每个样本重复3-5次。
1.5.2 载Pi脂质体相变温度的测定 用微热量仪C-80(SETARAM公司,法国)测量相变温度。
1.5.3 脂质体热稳定性的评估 室温下,将1ml载Ca2+脂质体放于14 ml NaCl(0.285 M)内储存。选定特定的时间,采用上述的AIII(偶氮砷III)比色测试法测定脂质体膜外的游离的Ca2+。
1.6 脂质体混悬液在早期龋模型上的应用 制厚度为1mm无龋的第三磨牙的磨片,用10%H3PO4酸蚀清洗20 s,用蒸馏水清洗。将直径2cm高度3cm的金属圆柱体,置于恒温器中水浴,水位止于2.8cm暴露其余部分,将磨片置于其上,控制使其保持在37℃,将载Ca2+和载Pi脂质体以2∶1(V:V)混合,倒入磨片的表面,保持静止20min,接着移走磨片。室温下蒸馏水清洗去除残留的悬浮液。标本风干1h,另外真空中风干24h。扫描电镜观察磨片表面的矿化情况。
1.7 冻干胶原凝胶的SEM和元素分析 将上述前驱液在37℃恒温孵育箱中放置24h,待形成凝胶固体状的HA/胶原复合体后,将其放入冷冻干燥机中真空冷冻干燥8个小时。取部分样品喷铂,扫描电镜观察。然后用Horbia EX-250型能谱仪对其进行元素分析。
2.结果
2.1 脂质体的基本特征 大部分载钙和磷酸盐脂质体平均直径分别是1.5μm和1.3μm;包封率分别是56%-67%和42%-66%。脂质体其相变温度在39℃有一个吸热峰值(图1所示)。
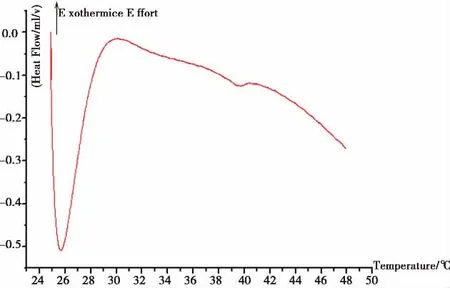
图1 C-80微热量仪扫描由DMPC和DPPC构成的载Pi脂质体悬浮液相变温度。
本实验合成脂质体在室温条件下储存一段时间后,发现载Ca2+脂质体泄漏率低于5%(图2所示)。载Ca2+脂质体温控敏感性是采用偶氮胂III(AIII)分光光度法原理。当仅仅有AIII时有一个450-610nm波段其吸收峰值是543nm(图3a实心箭头所示),当在Ca2+出现时形成Ca2+-AIII的复合物,故显示为很小的特征肩峰在630nm(图3b箭头所示)。室温下用稀释纯载钙脂质体与AIII混合,显示一个与单纯AIII很接近的吸收光谱曲线(图3a,实线所示)。但是把载钙脂质体在体温条件下加热30min,使从Ca2+离子从脂质体释放出来可以发现明显的吸收光谱图的改变;在543nm的AIII峰值出现的同时出现一个新的572-611nm的峰值(图3a,红线所示),相当于是Ca2+-AIII的复合物。

图2 纯载Ca2+脂质体在室温条件下储存几周后,与时间相关泄漏率。(原始数据吸光值转变为百分数)
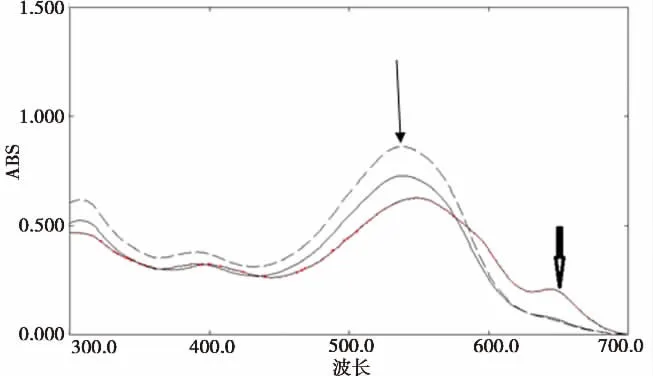
图3a 在室温和体温条件下用AIII测定Ca2+释放紫外光谱情况红线:37℃下Ca2+脂质体+AIII虚线:只有AIII实线:在室温条件下AIII+Ca2+脂质体
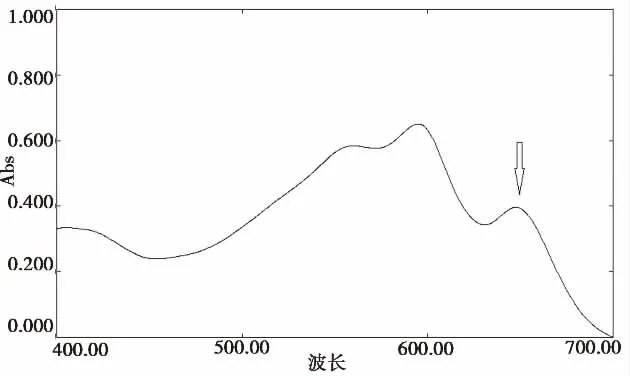
图3 bAIII和CaCl2(0.2 M)溶液紫外光谱图,箭头所示Ca2+-AIII的复合物出现的峰值
2.2 早期龋模型观察结果 早期龋表面的釉晶是不连续性的破坏。于是用酸蚀后牙齿磨片模拟早期龋坏,将其浸泡在脂质体生物矿化溶液中。在室温条件,在釉质表面无明显物质存在(图4b,4e所示);然而在体温条件下,在牙釉质表面可见到片状晶体存在(图4c所示);并且在牙本质小管间可以看到一些分离的簇集状物质(图4f所示)。
2.3 冻干矿化胶原凝胶的性质 在电镜扫描下,可发现矿物质分布于胶原之间随意分布(图5a所示);以及在矿化凝胶中出现的六边形物质是羟基磷灰石(图5b箭头所示),因为它遵循羟基磷灰石六边形,片状,晶体c轴延长晶体学特点。能谱仪分析显示很强磷酸盐(2.0 keV)和钙峰值(3.7 keV)(图 6 所示)。
3.讨论
临床上有多种原因造成的牙槽骨量的丧失;特别是老年因肿瘤手术造成的上下颌骨缺损,为义齿修复带来很多的困难;牙槽嵴高度与宽度不足致下颌磨牙区狭窄,使种植体不能稳定负载等。采用适当的方法恢复牙槽骨量可直接影响义齿修复的效果,经过多年的研究出现了诸多修复牙槽骨缺损的填充材料[5],但未达到理想效果。本研究采用脂质体模拟基质小泡介导的生物矿化过程,合成复合材料的成分和合成过程与天然骨相似。另外,脂质体可以持续释放包封离子,具有缓释效果;前驱液有良好的流动性从而可在临床注射性应用达到微创效果。
为模拟基质小泡介导的矿化过程,本实验采用薄膜超声法合成的小型单层脂质体是理想的结果;因为小直径的脂质体更接近基质小泡的直径。然而本实验中脂质体的包封率比Pederson等的研究[6]的要低些(载Ca2+和Pi脂质体包封率分别是(60%-75%和75%-85%)。原因是其IF法合成的脂质体体积比较大,可以包封较多的溶液;另外,超声使得溶液极性分子与磷脂膜之间及磷脂分子之间相互作用发生改变,从而使得内容物释放,包封率也有所下降。

图4a 酸蚀后未作处理的牙釉质磨片的表面;图4b在室温条件下在载Ca2+和Pi的脂质体混合液孵育20min后牙釉质的表面,未见明显覆盖物;图4c在37℃混合脂质体孵育20min后,在釉质表面可见不定型物质覆盖;图4d酸蚀后未作处理的牙本质的表面;图4e在室温条件下在载Ca2+和Pi的脂质体混合液孵育20min后牙本质的表面,未见明显覆盖物;图4f在37℃混合脂质体孵育20min后,在牙本质表面可见不连续覆盖物

图5a 低倍电镜下冻干胶原凝胶的扫描图;图5b高倍镜下冻干胶原凝胶的扫描图,箭头显示六边形状微粒可能为无定形羟基磷灰石;图5c高倍镜下的冻干矿物质/胶原复合物,可见无序排列的结构
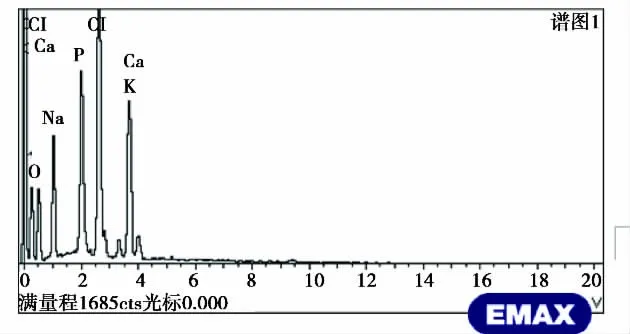
图6 冻干矿物质/胶原复合物凝胶EDS能谱图
载Pi脂质体在39℃有一个吸热峰值(图1所示),表明脂质体膜由“凝胶态”转变为“液态”。相变开始的偏差是由于热量平衡波动过程所致。然而载Pi脂质体在低于Tm的体温条件下释放内含离子是合理的。首先,磷脂-水溶液系统的独特特点,即双相系统的相行为特点,不仅包含脂质体的相特点还包括溶液的相特点;研究表明[7]加入磷酸盐的DPPC导致它的相变温度有所增加。另外,脂质体双分子层在低于Tm时渗透性会增加。Pederson等研究同样组分的载Ca2+脂质体的相变温度(Tm)也高于体温,是由Ca2+和磷脂双分子层的相互作用所致[8]。
本实验合成的载Ca2+脂质体在室温条件下储存近6周,泄漏率低于5%,表明脂质体稳定性良好。在脂质体的制备过程中,超声可能对脂质体的稳定性产生影响;另外,可能是由于脂质体内外的浓度差([Ca]in=0.2M;[Ca]out≈0M)导致扩散作用;包封的溶液可从脂质双分子层的小空隙或沟中渗透出来。
在本实验中合成的无定形磷酸钙盐(如图5c所示)与缺乏釉基质蛋白形成的羟基磷灰石相一致[9]。与低饱和度的矿化液相比,在高饱和度的矿化液中,形成比较少的有序结构[10]。在我们的研究中,高浓度的溶液恰好验证这个事实。
基质小泡分布于成骨细胞或骨细胞附近含有大量胶原的类骨质中,小泡破裂后可使钙盐结晶成为钙化中心,最终形成骨。在本实验中引入的I型胶原可作为细胞外基质,它能加速愈合和血管化;确定晶体生长的空间,这个限制的生长空间对确定晶体的体积和形态是非常重要的;胶原容易降解并易于细胞粘附和繁殖。羟基磷灰石是人体自然骨的主要成分,具有良好的生物相容性和骨诱导性。因此我们结合胶原以及脂质体破裂后形成的磷酸钙盐二者优点,最终合成的骨替代材料具有其独特的优越性。
目前热敏矿化胶原凝胶材料还处于实验阶段,还有许多问题亟待解决。如合成的矿化胶原凝胶的机械性性能,生物学相容性及进一步去模拟体内条件下的矿化将是未来研究重点。
4.结论
本实验利用脂质体包封盐溶液,模拟基质小泡;在体温条件下与酸性胶原溶液反应形成胶原凝胶。脂质体具有良好的稳定性和热敏感性,在体温诱导下可快速形成类似于骨组织矿化物。显示它在医学和牙科种植材料方面有应用潜力。
[1]He ZY,Zhe ng X,WuXH,etal.Developmentof glycyrrhetinic acid-modified stealth cationic liposomes for gene delivery[J].Pharm,2010,397(15)147-154
[2]Albasarah YY,Somavarapu S,Stapleton P,et al.Chitosan coated antifungal formulations for nebulisation[J].Pharma col,2010,62(7):821-828
[3]Aaron W.Pederson,Jeffrey W.Ruberti,Phillip B.Messersmith Thermal assembly of a biomimetic mineral/collagen composite Biomaterials[J].Biomaterials,2003(24):4881-4890
[4]蔡洁明,李 玲,王 茜.热触发自组装型羟基磷灰石/原复合材料的基础研究[J].口腔医学研究2010,26(1):38-41
[5]刘 冰,陈 鹏,活性纳米羟基磷灰石复合胶原聚乳酸材料异位成骨性能研究[J].口腔颌面修复学杂志,2009,(4):193-196
[6]Murphy WL,Messersmith PB.Compartmental control of mineral formation:adaptation of a biomineralization strat egy for biomedicaluse[J].Polyhedron,2000,19(3):357-363
[7]Ohtake OS,chebor S,de Pablo J.Effect of sugarphosphate mixtures on the stability of DPPC membranes in dehydrated systems[J].Cryobiology,2004;48(1):81-89
[8]Sturtevant JM.The effect of sodium chloride and calcium chloride on the main phase transition of dimyristoylph osphati-dylcholine Chem [J]. Phys Lipids,1998,9(5):163-168
[9]Wang LJ,Guan XY,Yin HY,et al.Mimicking the self-organized microstructure oftooth enamel[J].Phys Chem,2008,112(15):5892-5899
[10]Liu XY and Lim SW.Templating and super saturation drivenanti templating:principles of biomineral architecture[J].Am Chem Soc,2003,125(5):888-895

