自体来源富血小板血浆对大鼠牙髓细胞增殖作用的研究*
陈素雅 蔡华雄
牙髓细胞的增殖分化以及牙本质的修复与再生是多种生长因子、细胞外基质分子网络调控的结果。其中生长因子在许多重要环节起关键性作用。富血小板血浆(Platelet-rich plasma,PRP)是自体血浆中的高浓度的血小板,是一种富含血小板的血液制品,含有高浓度的生长因子、血小板和纤维素[1],能促进细胞增殖、基质合成和血管生成。有研究证实,PRP促进骨细胞和成纤维细胞有增殖作用[2-3]。但PRP作为多种复合生长因子,其作用机制尚不十分明确,目前研究较多的是转移生长因子(transforming growth factor,TGF)和血小板来源生长因子(platelet-derived growth factor,PDGF)。本实验通过相关抗体的拮抗作用,分别屏蔽PRP中两种主要生长因子转移生长因子和血小板来源生长因子的功能,观察PRP中不同生长因子在大鼠牙髓细胞的增殖作用中发挥的效应。
1.材料与方法
1.1 材料
1.1.1 试剂 大鼠TGF-β1 ELISA试剂盒武汉博士德生物工程有限公司
大鼠PDGF-AB ELISA试剂盒 武汉博士德生物工程有限公司
大鼠TGF-β1抗体 武汉博士德生物工程有限公司
大鼠PDGF-AB抗体 武汉博士德生物工程有限公司
MTT细胞增殖及细胞毒性检测试剂盒 武汉博士德生物工程有限公司
CCK-8试剂盒 广州威佳科技有限公司
1.1.2 主要仪器和设备 Shellab 2323-2 CO2培养箱 SHELLAB
HERAguard HPH12超净工作台 THERMO
1.1.3 实验动物 清洁级SD大鼠,4周龄,性别不限,由中山大学实验动物中心提供。
1.2 试验方法
1.2.1 大鼠牙髓细胞的培养 取3-4周龄SD大鼠,性别不限,处死后解剖上下颌骨,超净工作台内解剖上下颌切牙,取出牙髓,酶消组织块法培养牙髓细胞,按1∶2比例进行传代,检测细胞来源并绘制细胞生长曲线,取第五代细胞进行实验。
1.2.2 PRP的制备 采用Landesberg两步离心法[4],从大鼠心脏抽取全血2 ml入含有0.2ml10%枸橼酸钠抗凝管,第1次200 g/min离心10 min,全血可见分为3层,吸取全部上清液至交界面下约3 mm,200 g/min二次离心10 min,弃掉大部分上清液,剩余液体约0.2 ml,按体积10:1加入含1000 μ/ml牛凝血酶的10%氯化钙溶液,可见数秒内凝结成胶冻样,4℃过夜后,5000 r/min离心10 min,取上清液,过滤除菌。将10 μl PRP加入90 μl DMEM中制备成10%PRP培养基,将5 μl PRP加入95 μl DMEM中制备成5%PRP培养基。
1.2.3 PRP中血小板及生长因子测定 在全自动血常规分析仪上分别检测全血及PRP中血小板数目;采用ELISA方法分别测定PRP中TGF-β1、PDGF-AB的水平。
1.2.4 细胞增殖检测 采用CCK-8法。选择生长良好的第5代大鼠牙髓细胞以浓度3×104个/ml接种于96孔培养板。每孔100 μl,加入不同刺激物 100 μl,继续培养 48 h,每孔加入CCK-8溶液10 μl,37℃继续孵育2 h后分光光度计测各孔吸光度值。各浓度组取平均值,进行统计学分析。每组6孔,实验重复2次。
1.2.5 实验分组
实验1:①对照组,仅加入DMEM;②10%FBS组(DMEM+10%FBS);③5%PRP组(5%PRP+DMEM);④10%PRP 组(10%PRP+DMEM);
实验2:①5%PRP组(5%PRP+DMEM);②TGF-β1抗体组(5%PRP+TGF-β1抗体 20 μg/ml+DMEM);③PDGF-AB抗体组(5%PRP+PDGF-AB 抗体 20μg/ml+DMEM);④PDGFAB抗体联合TGF-β1抗体组(5%PRP+PDGFAB 抗体 20μg/ml+TGF-β1 抗体 20 μg/ml+DMEM)。
2.结果
2.1 细胞生长状况 原代培养细胞约在第4-6天从组织块边缘爬出,呈星形或多角形,少量呈梭形或三角形,约10-14天后细胞汇合。细胞波形丝蛋白(Vimentin)及角蛋白(CK)免疫组化染色显示抗Vimentin阳性,CK阴性,说明细胞来源于中胚层,非上皮源性(图1、2)。细胞生长曲线显示第5天达生长高峰。
2.2 PRP中血小板及生长因子测定 经过Landesberg两步法离心后制备的PRP中血小板含量为1790.58±388.08×109个/L,是全血中的3.17倍。激活后PRP中TGF-β1的含量为3.080 ng/ml,PDGF-AB的含量为10.706ng/ml。

图1 Vimentin染色阳性(SABC×200)
图2 CK染色阴性(SABC×200)
2.3 细胞增殖检测
CCK-8细胞增殖检测结果由OD值表现(表1、2)。

表1 不同浓度PRP对细胞增殖作用
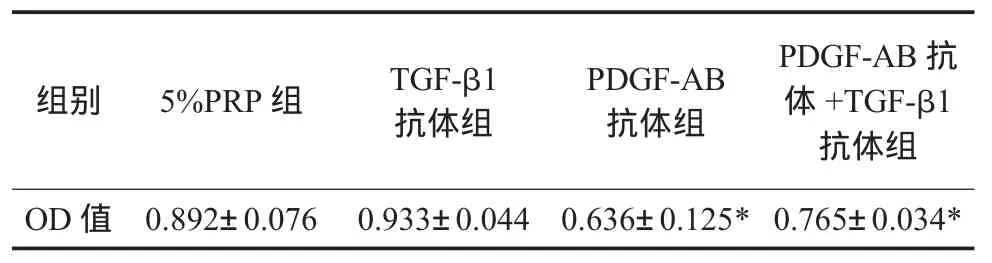
表2 加入抗体后5%PRP对细胞增殖作用
48h时10%和5%PRP组与DMEM组比较,OD值均有显著差异,P<0.05;而且10%和5%PRP组与FBS组比较,OD值均有显著差异,P<0.05;10%与5%PRP组之间OD值差异无统计意义。
5%PRP组与PDGF-AB组和PDGF-AB抗体联合TGF-β1抗体组比较,均有显著性差异(P<0.05),PDGF-AB组和PDGF-AB抗体联合TGF-β1抗体组 OD值均低于 5%PRP组;PDGF-AB抗体联合TGF-β1抗体组与TGF-β1抗体组和PDGF-AB抗体组之间,均有明显差异(P<0.05),PDGF-AB组OD值低于PDGF-AB组与 PDGF-AB抗体联合 TGF-β1抗体组,TGF-β1抗体组 OD值高于 PDGF-AB组与PDGF-AB抗体联合TGF-β1抗体组。
3.讨论
PRP是通过密度梯度离心法从全血中分离提取出来的,不同的离心次数、离心时间和离心力所得的PRP中的血小板的浓度和活性各不相同[5]。由于血小板在体外较脆弱和易于激活,因此过大的离心力和过长的离心时间都有可能引起血小板膜破裂,血小板破坏[6],同时可能使部分血小板沉降至红细胞层,导致制备的PRP中血小板活性降低或浓度减少,从而影响PRP的生物学性能。Marx等的研究认为,PRP的最低工作浓度血小板浓度应大于1000×109个/L[7]。Landesberg[4]建议二次离心时均采取0.20 N的力离心10 min。本实验采取Landesberg两步离心法,所得的PRP中血小板浓度与文献基本一致。
PRP中含有高浓度的血小板,其浓度可以达到全血中浓度的2.105-3.138倍[4,7],通过α颗粒脱颗粒释放激活的生长因子启动损伤修复,α颗粒释放的蛋白包括[8,9]:血小板来源生长因子(PDGF)、 转移生长因子 (TGF)、 骨形成蛋白(BMPs)、类胰岛素生长因子(IGF)、表皮生长因子(EGF)、成纤维细胞生长因子(FGF)及血管内皮生长因子(VEGF)和其他刺激增殖、趋向和分化的分子。这些生长因子通过吸引新形成基质中的未分化细胞和激发细胞分裂促进损伤修复。本实验通过不同浓度PRP与DMEM和10%FBS培养基对大鼠牙髓细胞增殖作用的比较,显示PRP对大鼠牙髓细胞的增殖有明显的促进作用,且不需依赖FBS的存在,是由于PRP中含有比FBS更丰富的生长因子;10%PRP对大鼠牙髓细胞的增殖与5%PRP无明显差异,表明PRP的刺激增殖作用并非随着浓度的增高而增强。
TGF和PDGF是目前研究较多的生长因子,具有促进成骨细胞增殖和成骨的作用[10]。Yoichiro等[10]的实验报道在PRP中用TGF、PDGF和IGF抗体拮抗对应生长因子的作用发现,拮抗生长因子后PRP对细胞增殖的作用降低。Shirakama报道TGF-β1在0.1μg/L和5μg/L时均可增加人P1系的牙髓细胞DNA合成[11]。本实验观察到PRP中加入TGF-β1抗体后,牙髓细胞增殖反而略有升高,尽管差异没有统计学意义,说明可能是由于PRP是多种生长因子的复合体,各种生长因子间存在相互补充或相互抑制或拮抗的作用,在屏蔽某种生长因子后,PRP中的其它生长因子能替代其起促进细胞增殖的作用,调控细胞生长。
PDGF有趋化成纤维细胞,促进胶原和蛋白合成的作用[12]。研究发现,正常情况下,在牙髓成纤维细胞和血管内皮细胞薄膜上均有PDGF受体β亚基表达[13],PDGF可以诱导牙髓细胞、内皮细胞的DNA合成和细胞增殖,在正常牙髓组织中牙髓细胞、微血管内皮细胞表达PDGF-β受体,提示PDGF在牙髓组织的生长、发育等正常生理过程和创伤修复过程中起着重要的作用[14]。在本实验中,加入PDGF-AB抗体后可以使细胞增殖明显降低,说明PDGF-AB被拮抗后PRP的促进细胞增殖作用明显减弱,从而证明PDGF-AB能显著刺激大鼠牙髓细胞增殖,在PRP中起重要作用,这与Yoichiro等[10]的实验结果基本一致。在同时加入TGF-β和PDGF-AB抗体后,虽然降低了PRP对大鼠牙髓细胞的增殖作用,但变化幅度比仅加入PDGF-AB抗体明显缩小,推测原因可能是由于PRP是多种生长因子和蛋白的复合物,在对细胞发挥作用时存在复杂的相互作用,不同的生长因子间存在相互抑制或调节的作用。
虽然PRP已经广泛应用并在临床应用显示积极的效果[15],但由于各种研究报告方法各异,结果也不相同[16]。本实验结果说明,PRP能显著刺激牙髓细胞的增殖,其中PDGF-AB在PRP中促进牙髓细胞增殖中发挥重要的作用,PRP中的各种生长因子之间可能存在着相互调控、拮抗的作用。关于PRP对大鼠牙髓细胞分化的影响,本实验将做进一步观察。牙髓细胞的增殖和分化是牙髓组织修复和再生的基础,因此,探索及研究以阐明PRP及其主要生长因子对牙髓组织修复再生的机制将为PRP应用于活髓保存治疗提供理论基础。
[1]Mehta S,Watson JT.Platelet rich concentrate:basic science and current clinical applications[J].J Orthop Trauma,2008,22(6):432-438
[2]Choi BH,Zhu SJ,Kim BY,et a1.Effect of platelet-rich plasma(PRP)concentration on the viability and proliferation of alveolar bone cells:an in vitro study[J].J Oral Maxillofac Surg,2005,34(4):420-424
[3]Graziani F, Ceis, Ducci F, et a1.In vitro effects of deferent concentration of PRP on primary bo ne an d gingival cell lines preliminary results[J].Minerva Stomatol,2005,54(1-2):15-22
[4]Landesberg R,Roy M,Glickman RS.Quantification of growth factor levels using a simplified method of platelet-rich plasma gel preparation[J].J Oral Maxillofac Surg,2000,58(3):297-300
[5]Qiu J,Zhang C,Yuan T,et al.Application and effect of platelet-rich plasma and its relevant factors for tissue repair and regeneration[J].Journal of Clinical Rehabilitative Tissue Engineering Research,2009,13(41):8131-8134
[6]Gonshor A.Technique for producing platelet-rich plasma and platelet concentrate:background and process[J].Int J Periodontics Restorative Dent,2002,22(6):547-557
[7]Marx RE.Platelet-rich plasma(PRP):What is PRP and what is not PRP?J Implant Dent,2001,10(4):225-228
[8]Everts PA,BrownMahoney C,Hoffmann JJ,et al.Plat elet-rich plasma preparation using three devices:implic ations for platelet activation and platelet growth factor release[J].J Growth Factors,2006,24(3):165-171
[9]Eppley BL,Woodell JE,Higgins J.Platelet quantification and growth factoranalysis from platelet-rich plasma:implications for wound healing[J].Plast Reconstr Surg,2004,114(6):1502-1508
[10]Yoichiro Ogino,Yasunori Ayukawa,Toshio Kukita,et al.The contribution of platelet-derived growth factor,transforming growth factor-b1,and insulin-like growth factor-I in platelet-rich plasma to the proliferation of osteoblast-like cells[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod,2006,101(6):724-729
[11]Shirakawa M,Shiba H,Nakanishi K,et al.Transforming growth factor-β1 reduces ALK aline phosphatase mRNA and activity and stimulates cell proliferation in cultures of human pulp cell[J].Dent Res,1994,73(9):1509-1514
[12]Matsuda N,Lin WL,Kumar NM,et al.Mitogenic,chemotactic,and synthetic responses of rat periodontal ligament fibroblastic cells to polypeptide growth factors in vitro[J].J Periodontol,1992,63(6):515-525
[13]Chen Q,Shi J,Jin Y,et al.An immunohistochemical study on the expression of receptor of platelet-derived growth factor in human pulp[J].Chinese Journal of Conservative Dentistry,2004,14(2):72-74
[14]Hoppenreijs VP,Pels E,Vrensen GF,et al.Platelet derived growth factor:receptor expression in corneas and effects on corneal cells[J].Invest Ophthalmol Vis Sci,1993,34(3):637-649
[15]Oyama T,Nishimoto S,Tsugawa T,et al.Efficacy of platelet-rich plasma in alveolar bone grafting[J].J Oral Maxillofac Surg,2004,62(5):555-558
[16]Jakse N,Tangl S,Gilli R,et al.Influence of PRP on autogenous sinus grafts.An experimental study on sheep[J].Clin Oral Implants Res,2003,14(5):578-583

