姜黄素对大鼠心室肌细胞快钠流和L型钙流的影响
施通,吴辉,高元兴,岳军,刘付丽,徐旭仲
(温州医学院附属第一医院 麻醉科,浙江 温州 325000)
姜黄素(curcumin)是从姜科姜黄属植物姜黄(curcuma longa L)根茎中提取的一种酚类天然色素。在传统的印第安医学中它被用以治疗各种各样的疾病,包括风湿病、躯体疾病、皮肤病、消化功能紊乱、间歇性发热、白斑病和闭经等[1-2]。最近几年,大量研究数据阐明了姜黄素非在体条件下的潜在药理学作用,包括抗微生物、抗病毒、抗真菌、抗感染和抗肿瘤等作用。但其对心脏的作用研究报道较少,目前鲜见其对心肌细胞离子通道产生影响的研究。本研究采用全细胞膜片钳记录技术,观察姜黄素对急性分离的大鼠心室肌细胞钠通道和钙通道电流的影响,阐明姜黄素对心肌细胞离子通道的作用机制,为姜黄素的药理开发和安全使用提供实验依据。
1 材料和方法
1.1 实验动物和试剂 成年清洁级SD大鼠250~300 g,由温州医学院动物中心提供。I型胶原酶(collagenaseI),XIV型蛋白酶(protease XIV),牛血清白蛋白(bovine serum albumin,BSA),姜黄素(curcumin),二甲基亚砜(DMSO),N-2-羟乙基哌嗪-N’-2-乙磺酸(HEPES)、乙二醇-双四乙酸(EGTA)、氯化铯(CsCl)、谷氨酸(L-Glutamic acid)、牛磺酸(taurine)、CaCl2、Na2ATP、MgATP、CsOH为Sigma公司产品。氯化四乙胺(TEA-Cl)为Lancaster公司产品。其余化学试剂为国产分析纯试剂。
1.2 溶液配制 分离心室肌细胞和记录离子通道电流所使用的溶液配制如下(单位为mmol/L):①台氏液:NaCl 137、KCl 5.4、CaCl21.8、MgCl21.0、NaH2PO40.33、HEPES 10、Glucose 10,用NaOH调pH至7.35。台氏液中去除CaCl2即为无钙台氏液。②KB液:KCl 40、KH2PO420、MgSO43.0、KOH 80、谷氨酸50、牛磺酸20、HEPES 10、Glucose 10、EGTA 0.5,用KOH调pH至7.35。③ICa-L细胞外液:Choline-Cl 140、MgCl21.0、CaCl22.0、HEPES 5、Glucose 10、CsCl 4.6、TEA-Cl 10,CsOH调pH至7.4。④ICa-L电极内液:CsCl 120、MgCl21.0、MgATP 5.0、EGTA 10、HEPES 10,CsOH调pH至7.3。⑤INa细胞外液:Choline-Cl 140、NaCl 20、MgCl21.0、HEPES 5、Glucose 10、CsCl 4.6,CsOH调pH至7.4。⑥INa电极内液:CsCl 120、NaCl 10、MgCl21.0、Na2ATP 5.0、EGTA 10、HEPES 10,CsOH调pH至7.3。⑧50μmol/L姜黄素灌流液:用DMSO配制10 mmol/L姜黄素溶液,然后分别用不同通道外液将其稀释至50μmol/L备用。所有液体均用双蒸水(RIOS5+,MILLIPORE 美国)配制。
1.3 SD大鼠心室肌细胞分离 SD大鼠腹腔注射5%水合氯醛7 mL/kg,约5 min后,用血管钳夹大鼠肢端,无反射后可开胸取心脏。在4 ℃台氏液中去除脂肪和心包膜,分离主动脉并插管,行Langendoff心脏灌流。先用无钙台氏液灌流4 min(灌注压约为6 kPa),以去除冠脉内血液并使心脏停跳。再用含1 mg/mLI型胶原酶、0.05 mg/mL XIV型蛋白酶和50μmol/L CaCl2的无钙台氏液30 mL循环灌流约6~10 min。整个灌流系统温度保持在35~37 ℃,使流出心脏的液体温度在34 ℃左右,流速10~12 mL/min[3]。所有灌流液和KB液均通以100% O2饱和15 min以上。然后将心脏从Langendorff装置上取下,剪下心室部分,放入含10 mg/mL BSA的KB液中,用小剪刀将其剪碎至约1 mm3,再用玻璃滴管充分吹打2~3 min,用100目微孔尼龙膜过滤后,留取滤液室温下稳定1 h后备用。
1.4 全细胞膜片钳记录 实验前吸取少许富含细胞的KB悬液于0.5 mL的灌流槽中,静置5~10 min,待细胞沉底附壁后,用100% O2饱和的细胞外液进行表面灌流5~10 min,流速2~3 mL/min。在倒置显微镜(TE2000-U,Nikon,日本)下选择边缘清楚,表面光滑,横纹清晰,无收缩的细胞。采用Hamill等[4]首创的全细胞膜片钳记录方法,在电压钳制模式下记录各种通道电流。膜片钳放大器(EPC10,HEKA,德国)通过A/D和D/A数据转换器同计算机相连接。刺激信号及电压、电流输入信号的采集均由软件pulse 8.0控制。玻璃毛胚经微电极拉制仪(P-97,SUTTER,美国)拉制而成,尖端直径1~1.5μm。充灌电极内液后入水电阻为1.0~2.5 MΩ,调节三维操纵器(MP-285,SUTTER,美国)使电极尖端移向细胞表面,形成高阻封接(Giga seal),封接电阻1 GΩ以上,补偿快电容并吸破细胞膜,补偿慢电容形成全细胞记录模式。
1.5 通道电流的刺激参数设置 记录INa时细胞外液和电极内液中以CsCl代替KCl以消除钾电流对INa的影响。为了降低INa的电流强度以减少钳位误差,采取室温下记录,并降低细胞外液的NaCl浓度至20 mmol/L,其余的NaCl成分用Choline-Cl代替以维持渗透压平衡。记录INa的I-V曲线刺激方案为Vh-90 mV,Vs从-90 mV开始,以10 mV阶跃刺激至+50 mV,波宽50 ms,刺激频率0.2 Hz。
记录ICa-L时细胞外液和电极内液中以CsCl代替KCl,并加入TEA-Cl以阻断钾电流,细胞外液以Choline-Cl代替NaCl,并设保持电位为-40 mV以去除INa和T-型钙电流(ICa-T)。记录ICa-L电流-电压(I-V)曲线的刺激方案为保持电位(Vh)-40 mV,步阶钳制电压(Vs)从-40 mV开始,以10 mV阶跃刺激至50 mV,时程250 ms,刺激频率0.2 Hz。
1.6 姜黄素灌流和数据采集 每个通道电流记录时细胞灌流药物前采集对照I-V曲线,然后用微灌流系统(DADVC-8PP,ALA SCIENTIFIC,美国),灌流50μmol/L姜黄素5 min,记录灌药后的I-V曲线。原始电流数据采用pulsefit进行分析和测量,使用Origin6.1对测量后的数据进行绘图。
2 结果
2.1 姜黄素对大鼠心室肌细胞INa和ICa-L的影响
2.1.1 INa:以测试电压-30 mV,5个大鼠心室肌细胞的INa峰值电流密度作为观察指标,得出50μmol/L姜黄素对INa的抑制率为71.9%±6.3%(见表1)。50 μmol/L姜黄素对INa影响的原始电流图见图1。
表1 姜黄素(50μmol/L)对大鼠心室肌细胞INa和ICa-L的影响(±s)
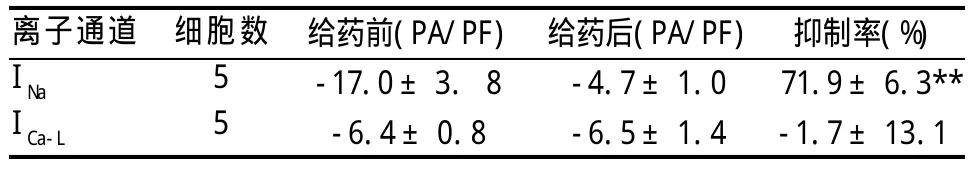
表1 姜黄素(50μmol/L)对大鼠心室肌细胞INa和ICa-L的影响(±s)
离子通道 细胞数INa ICa-L 55给药前(PA/PF)-17.0±3. 8-6.4±0.8给药后(PA/PF)-4.7±1.0-6.5±1.4抑制率(%)71.9±6.3**-1.7±13.1
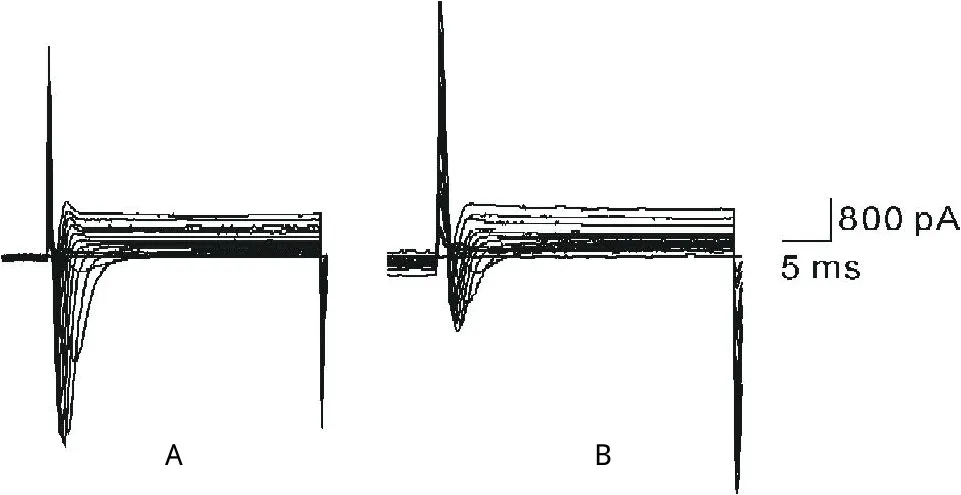
图1 A为大鼠心室肌细胞INa电流曲线,B为灌流50μmol/L姜黄素5 min后INa的电流曲线
2.1.2 ICa-L:以测试电压10 mV,5个大鼠心室肌细胞的ICa-L峰值电流密度作观察指标,得出50μmol/L姜黄素对ICa-L的抑制率为-1.7%±13.1%。图2为50 μmol/L姜黄素对ICa-L影响的原始电流图。
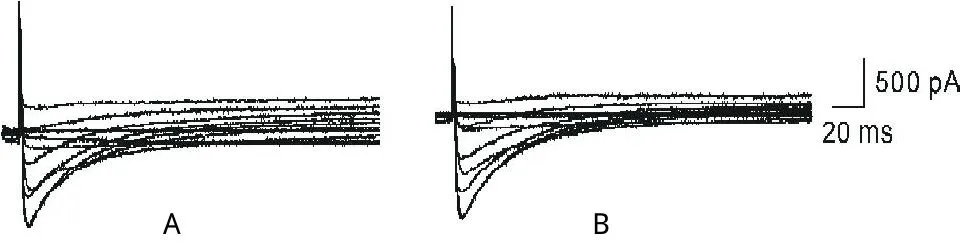
图2 A为大鼠心室肌细胞ICa-L电流曲线,B为灌流50μmol/L姜黄素5 min后ICa-L的电流曲线
2.2 姜黄素对大鼠心室肌细胞钠、钙通道电流密度-电压曲线的影响
2.2.1 50μmol/L姜黄素对INa电流密度-电压曲线的影响:如图3所示,INa的激活电压在-60 mV,峰电位在-30 mV,反转电位在+20 mV。50μmol/L的姜黄素对所有指令电压条件下均引起INa的降低,使电流密度-电压曲线上移,不改变激活电位和反转电位,峰值电位稍右移。
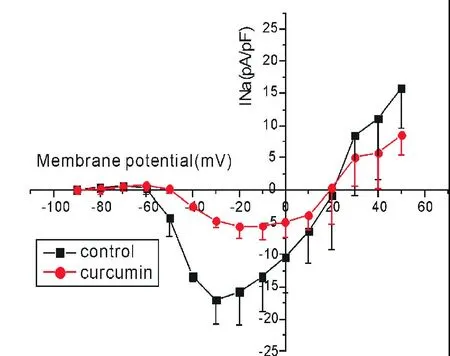
图3 姜黄素(50μmol/L)对大鼠心室肌细胞INa的电流密度-电压曲线的影响(±s,n=5)
2.2.2 50μmol/L姜黄素对ICa-L电流密度-电压曲线的影响:如图4所示,ICa-L从-30 mV开始激活,峰值电位在10 mV,反转电位+35 mV。50μmol/L的姜黄素对ICa-L的电流密度-电压曲线没有明显影响。

图4 姜黄素(50μmol/L)对大鼠心室肌细胞ICa-L的电流密度-电压曲线的影响(±s,n=5)
3 讨论
多种跨膜离子流的复杂变化产生心室肌细胞的动作电位和静息电位,即动作电位和静息电位是多种离子通道综合作用的结果,细胞膜离子通道电流的异常改变是形成各种心律失常的最重要因素。膜片钳技术可直接测定膜离子通道电流的大小,是研究药物对离子通道活性影响的最为直接的手段。
本研究以离子通道的角度初步观察了姜黄素对大鼠心室肌细胞的影响。姜黄素直接调节各种离子通道活性的能力已毋庸置疑,有报道指出其对三磷酸肌醇受体钙通道电流有抑制作用,而后又有研究表明姜黄素不可逆的抑制T型钙通道电流[5-6]。然而对心室肌细胞而言,ICa-L的作用是至关重要的,ICa-L对动作电位平台期的形成、细胞内钙增高以及心肌收缩起重要作用。本研究表明,50μmol/L的姜黄素的对大鼠心室肌细胞ICa-L没有明显影响,由于姜黄素在水中的溶解度非常低(小于0.01%)[7],实验过程中发现姜黄素在细胞外液中的最大溶解剂量是50~100μmol/L,更高浓度的姜黄素会与细胞外液产生明显沉淀,所以没有继续研究更高浓度的姜黄素能否抑制ICa-L。
INa主要参与快反应细胞动作电位0期去极化,是影响心肌兴奋性、不应性和传导性的重要离子流[8]。根据本项目组对大鼠心脏离体灌流的实验观察发现,高浓度姜黄素(10~50μmol/L)能产生剂量依赖性的心脏功能抑制和致心律失常作用(另文报道)。本研究结果表明50μmol/L姜黄素对INa有明显抑制作用,可以解释姜黄素引起的离体灌流心脏心电图的PR和QT间期延长、QRS电压下降和时程延长等现象,同时也可以解释由于0期去极化减慢,幅度降低导致的心肌功能抑制现象。本研究目前还只观察了高浓度姜黄素对大鼠心室肌细胞的离子通道电流的影响,但低浓度姜黄素的作用目前还未知,有待进一步研究。
[1] Singh S. From exotic spice to modern drug?[J]. Cell,2007,130(5):765-768.
[2] Aggarwal BB, Sundaram C, Malani N, et al. Curcumin:the Indian solid gold[J]. Adv Exp Med Biol,2007,595(10):1-75.
[3] Sodi R, Dubuis E, Shenkin A, et al. B-type natriuretic peptide (BNP) attenuates the L-type calcium current and regulates ventricular myocyte function [J]. Regulatory Peptides,2008,151(1-3):95-105.
[4] Hamill OP, Marty A, Neher E, et al. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches [J]. Pflugers Arch, 1981,391(2):85-100.
[5] Dyer JL, Khan SZ, Bilmen JG, et al. Curcumin: a new cellpermeant inhibitor of the inositol 1,4,5-trisphosphate receptor[J]. Cell Calcium,2002,31(1):45-52.
[6] Enyeart JA, Liu H, Enyeart JJ.Curcumin Inhibits ACTH-and Angiotensin II-Stimulated Cortisol Secretion and Cav3.2 Current [J]. J Nat Prod, 2009,72(8):1533-1537.
[7] Rahman SM, Telny TC,Ravi TK, et al. Role of Surfactant and pH in dissolution of curcumin[J]. Indian J Pharm Sci,2009,71(2):139-142.
[8] 贾宏钧, 王钟林, 杨期东. 离子通道与心脑血管疾病-基础与临床[M]. 北京:人民卫生出版社, 2001: 24-71.

