宫颈癌组织中sFRP1和β-catenin的表达及其意义
张孝艳 乔玉环 王琳 郭瑞霞
郑州大学第一附属医院妇产科,河南 郑州 450052
宫颈癌是威胁女性健康的第二大妇科恶性肿瘤,并具有年轻化趋势。现已证实人乳头瘤病毒(human papillomavirus,HPV)感染是宫颈癌及癌前病变的重要致病因素,大部分感染者可自然消退,仅有少数感染的妇女最终发展为宫颈癌[1],这表明HPV感染并不是导致宫颈癌发生的唯一因素。近年来,Wnt信号通路在肿瘤形成过程中的作用成为研究的热点。分泌型卷曲相关蛋白1(secreted frizzled related protein 1,sFRP1)是Wnt信号通路的负调控因子,对Wnt信号通路的传导具有重要的抑制作用。β-连环蛋白(β-catenin)作为Wnt信号传导途径的核心元件参与调节该通路。本研究通过检测sFRP1和β-catenin在宫颈癌组织、宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)及正常宫颈组织中的表达情况,探讨其在宫颈癌发生、发展中的作用及与宫颈癌预后的关系。
1 资料和方法
1.1 研究对象
收集郑州大学第一附属医院2001年—2005年病理科存档的宫颈石蜡标本128例,其中正常宫颈20例,CIN 30例,宫颈癌78例(均有确切随访资料)。宫颈癌组织学类型:鳞癌60例,腺癌18例;临床分期(FIGO,2000):Ⅰ期34例,Ⅱ期31例,Ⅲ~Ⅳ期13例;病理学分级:G1~G254例,G324例;伴有淋巴结转移者21例。患者中位年龄41岁(25~65岁),术前均未接受放化疗。所有标本均经病理学证实。
1.2 试剂和方法
兔抗人sFRP1抗体和兔抗人β-catenin抗体均购自北京雷根生物技术有限公司,免疫组化(SP法)试剂盒、二氨基联苯胺(DAB)显色剂及抗原修复液均由北京中杉金桥生物技术有限公司提供。操作步骤严格按试剂盒说明书进行。用已知的sFRP1和β-catenin阳性切片作为阳性对照,PBS代替一抗作为阴性对照。
1.3 结果判定
1.3.1 sFRP1的判定[2]
sFRP1阳性反应定位于细胞膜和细胞质,呈棕黄色颗粒。光学显微镜下选取5个视野(×400),每个视野计数100个细胞。阳性细胞≤2%记为0分,>2%~<20%为1分,20%~<50%为2分,≥50%为3分。按着色深浅记分,无着色为0分,浅着色为1分,深着色为2分。上述两项分值相加为着色强度积分值:<2分为阴性(-),2~<3分为弱阳性(+),3~<4分为阳性(++),≥4分为强阳性(+++)。
1.3.2 β-catenin的判定[3]
β-catenin正常染色定位于细胞膜。光学显微镜下选取5个视野(×400),每个视野计数100个细胞。阳性细胞<25%记为0分,25%~<50% 为1分,50%~<75% 为2分,≥75%为 3分。按染色强度:无染色0分,淡黄染色1分,深黄色2分,棕褐色3分。取两者之和:0分为阴性(-),1~2分为弱阳性(+),3~4分为阳性(++),5分及5分以上为强阳性(+++)。其中>10%细胞质和(或)细胞核出现β-catenin表达为异位表达,阴性(-)、弱阳性(+)和异位表达皆为异常表达,阳性(++)、强阳性(+++)为正常表达。
1.4 统计学处理
所有数据用SPSS 16.0软件包进行处理。率的比较采用χ2检验,相关性检验采用Spearman等级相关分析,生存率采用Kaplan-Meier和logrank分析。P<0.05为差异有统计学意义。
2 结 果
2.1 sFRP1的表达及其与宫颈癌临床病理特征的关系
20例正常宫颈 上皮组织sFRP1染色均呈阳性,阳性率为100.0%(图1A)。30例CIN组织中sFRP1阳性率为70.0%(21/30),呈弱表达(图1B)。78例宫颈癌组织中sFRP1阳性率为33.3%(26/78),呈微弱表达(图1C、D)。3组比较差异有统计学意义(χ2=33.26,P<0.05)。
宫颈癌组织中临床Ⅰ、Ⅱ及Ⅲ~Ⅳ期sFRP1表达阳性率分别为50%、25.8%和7.7%,差异有统计学意义(χ2=8.89,P<0.05),其中Ⅰ期的表达率明显高于Ⅱ期和Ⅲ~Ⅳ期(P<0.05);有淋巴结转移组显著高于无淋巴结转移组(66.7%vs 28.1%,P<0.05);sFRP1的表达与宫颈癌的病理学分级和组织学类型均无关(P>0.05,表1)。
2.2 β-catenin的表达及其与宫颈癌临床病理特征的关系
正常宫颈上皮β-catenin主要表达于细胞膜上,呈棕褐色细小颗粒状,仅1例同时出现细胞质阳性着色,细胞核无着色。在CIN及宫颈癌组织中,β-catenin呈明显的异常表达,表现为细胞膜表达减弱或消失,细胞质和(或)细胞核出现明显的着色(图2)。β-catenin在正常宫颈、CIN及宫颈癌组织中的异常表达率分别为5%(1/20)、43.3%(13/30)、70.5%(55/78),差异有统计学意义(χ2=29.56,P<0.05)。
宫颈癌组织中临床Ⅰ、Ⅱ及Ⅲ~Ⅳ期β-catenin异常表达率分别为52.9%、80.6%和92.3%,差异有统计学意义(χ2=9.55,P<0.05),其中Ⅰ期的异常表达率显著低于Ⅱ期和Ⅲ~Ⅳ期(P<0.05);β-catenin异常表达强度在病理学分级G1~G2与G3之间的差异有统计学意义(P<0.05);β-catenin异常表达强度在有淋巴结转移和无淋巴结转移的患者中,差异有统计学意义(P<0.05);β-catenin异常表达与宫颈癌的组织学类型无关(P>0.05)。
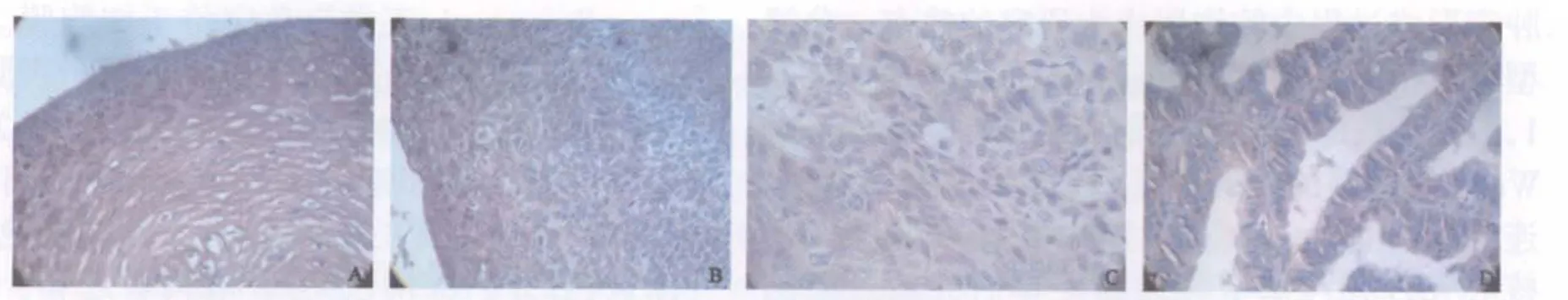
图1 sFRP1在各组织中的表达Fig.1 The expression of sFRP1 in different tissues(SP, ×400)

图2 β-catenin在各组中的表达Fig.2 The expression of β-catenin in different tissues(SP, ×400)
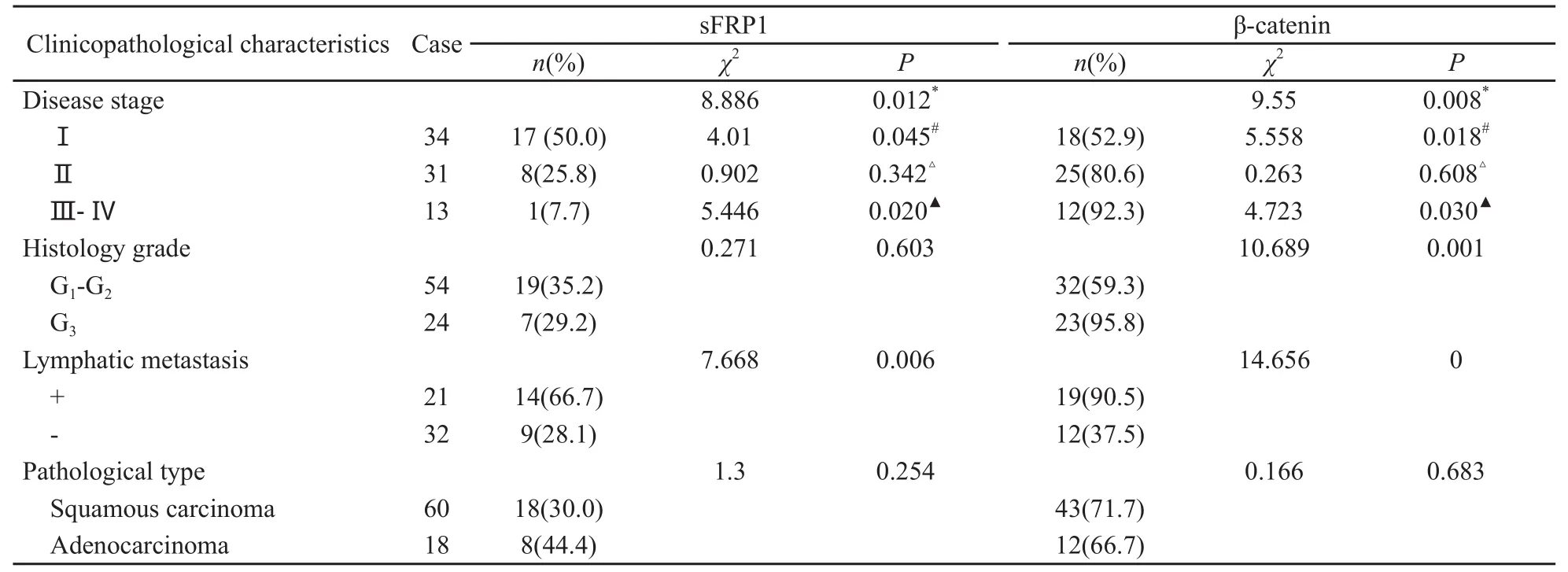
表1 sFRP1与β-catenin的表达与宫颈癌临床病理特征的关系Tab.1 The relationship between expressions of sFRP1 and β-catenin and clinicopathological characteristics in cervical cancer
2.3 宫颈癌组织中sFRP1表达与β-catenin表达的相关性
34.6%的sFRP1阳性表达宫颈癌患者中β-catenin呈现异常表达,而sFRP1阴性表达的宫颈癌患者中β-catenin的异常表达率达88.5%,差异有显著的统计学意义(P<0.001)。宫颈癌组织中sFRP1阳性表达与β-catenin的异常表达呈负相关(r=-0.557,P<0.001)。
2.4 sFRP1、β-catenin表达与宫颈癌预后的关系
在78例宫颈癌患者中,sFRP1阳性表达26例,阴性表达52例,sFRP1阳性表达者5年生存率高于阴性表达者(79.8% vs 60.5%,P<0.05)。β-catenin正常表达23例,异常表达55例,正常表达者5年生存率显著高于异常表达者(83.7%vs 59.2%,P<0.05)。
3 讨 论
sFRP1在胚胎发育阶段参与眼、脑及血管系统的形成和细胞分化,在成体中主要表达于脑脉络膜、视网膜、晶状体、睫状体及血管内皮等组织,参与这些组织的代谢[4]。sFRP1作为W nt信号上游抑制因子,含有一个CRD(半胱氨酸富含域)结构域,其部分氨基端序列与Wnt蛋白受体即卷曲蛋白(frizzled,Frz)结构类似,通过与Frz竞争结合Wnt蛋白或与Frz结合成无功能的复合体发挥抑制Wnt信号通路的作用,在抗肿瘤及促细胞凋亡等生物过程中起到了一定的作用[5]。Chunga等[6]研究证实了sFRP1在宫颈癌细胞中是一种抑癌基因,sFRP1的表观遗传学沉默激活了Wnt经典通路的原癌基因,并且通过转染技术使sFRP1重新表达后,能够有效抑制宫颈癌CaSki细胞的增殖、转移及侵袭。有研究表明,sFRP1在多种人类实体肿瘤中存在表达缺失,如结直肠癌、乳腺癌及肾细胞癌等[7-9]。
本研究结果发现,随着病变程度的加深,sFRP1的表达呈下降趋势,在正常宫颈上皮组织、CIN和宫颈癌组织中的阳性率分别为100.0%、70.0%和33.3%,差异具有统计学意义(P<0.05),表明从癌前病变发展到浸润癌的过程中sFRP1可能起了重要作用。宫颈癌临床Ⅰ、Ⅱ及Ⅲ~Ⅳ期sFRP1阳性表达率也呈现逐渐下降趋势,分别为50.0%、25.8%和7.7%,其中Ⅰ期的阳性表达率明显高于Ⅱ期和Ⅲ~Ⅳ期(P均<0.05),且有淋巴结转移者显著高于无淋巴结转移者(P<0.05),提示sFRP1的表达可能与宫颈癌细胞的侵袭及转移有关。
β-catenin是连环蛋白家族中一员,具有介导细胞黏附及信号转导的双重功能。β-catenin在细胞质内以两种形式存在:一种为结合型,与E-cadherin结合参与调节同种细胞间的黏附;一种为游离型,参与Wnt信号传导途径。游离的β-catenin可通过核膜进入到细胞核内,与转录因子Tcf/Lef结合,激活Wnt途径靶基因,如c-myc、cyclin D1,调节细胞的增殖,参与肿瘤形成[10]。
Nakopoulou等[11]通过检测141例乳腺癌标本中β-catenin的表达,结果发现细胞核内β-catenin高表达与乳腺癌的侵袭性及不良预后有关。Wanitsuwan等[12]对163例结直肠癌研究发现,β-catenin的细胞核异常表达率高达81.4%,并与肿瘤的临床分期及淋巴结转移有关。Sangkhathat等[13]通过在肝癌细胞内转染siRNAs引起细胞内β-catenin表达下降,从而达到抑制肝癌细胞增生的作用。Chunga等[6]在宫颈癌CaSki细胞质及细胞核中发现有β-catenin的异常聚集。
本研究结果表明,从正常宫颈组织发展为CIN再演变为宫颈癌,β-catenin的异常表达逐渐增强,且宫颈癌组明显高于其他两组,提示β-catenin的异常积聚可能在宫颈上皮癌变过程中起重要作用。随着Wnt信号通路拮抗剂sFRP1在宫颈癌组织中表达的逐渐减弱,β-catenin的异常表达程度呈逐渐增高趋势。表明sFRP1的低表达可能是导致β-catenin正常表达下降、异常表达升高的因素之一,并且sFRP1与β-catenin的作用不是独立的,而是共同作用促进宫颈癌的发生、发展、侵袭及转移。
本研究结果还证实,sFRP1、β-catenin的表达与宫颈癌的预后有关,可作为预测宫颈癌预后的指标之一。
综上所述,在宫颈癌组织中Wnt信号传导通路抑制蛋白sFRP1呈明显的表达减弱或缺失,β-catenin的细胞膜表达减弱,细胞质及细胞核的异常积聚增加,表明Wnt传导通路在宫颈癌中处于激活状态,提示该传导通路与宫颈癌的发生、发展密切相关。信号抑制蛋白sFRP1的表达减弱可能是导致β-catenin在细胞质和细胞核内积聚以及Wnt信号活化的原因之一,并且sFRP1和β-catenin有望成为预测宫颈癌预后的指标及生物靶向治疗的靶点。
[1] FENDRI A, MASMOUDI A, KHABIR A, et al. Inactivation of RASSF1A, RAR beta 2 and DAP-kinase by promoter methylation correlates with lymph node metastasis in nasopharyngeal cancer[J]. Cancer Bio Ther, 2009, 8(5):444-451.
[2] 苏姗, 阚艳艳, 田永杰. sFRP-1、Wnt-1在宫颈癌及癌前病变中的表达及意义[J]. 山东大学学报(医学版), 2010,48(1):97-101.
[3] 柳华, 彭芝兰. Wnt信号通路关键蛋白与上皮性卵巢癌间的关系[J]. 现代肿瘤医学, 2010, 18(2): 377-379.
[4] RATTNER A, HSIEH J C, SMALLWOOD P M, et al. A family of secreted proteins contains homology to the cysteine-rich ligand-binding domain of frizzled receptors[J]. Proc Natl Acad Sci USA, 1997, 94(7): 2859-2863.
[5] KAWANOY Y, KYPYA R. Secreted antagonists of the Wnt signalling pathway[J]. J Cell Sci, 2003, 116(13):2627-2634.
[6] CHUNGA M T, LAIC H C, SYTWUA H K, et al. SFRP1 and SFRP2 suppress the transformation and invasion abilities of cervical cancer cells through Wnt signal pathway[J].Gynecol Oncol, 2009, 112(3): 646-653.
[7] VEECK J, NIEDERACHER D, AN H, et al. Aberrant methylation of the Wnt antagonist SFRP1 in breast cancer is associated with unfavourable prognosis[J]. Oncogene,2006, 25(24): 3479-3488.
[8] QI J, ZHU Y Q, LUO J, et al. Hypermethylation and expression regulation of secreted frizzled-related protein genes in colorectal tumor[J]. World J Gastroenterology,2006, 12(44): 7113-7117.
[9] DAHL E, WIESMANN F, WOENCKHAUS M, et al. Frequent loss of SFRP1 expression in multiple human solid tumours:association with aberrant promoter methylation in renal cell cancer[J]. Oncogene, 2007, 26(38): 5680-5691.
[10] LOPEZ-KNOWLES E, ZARDAWI S J, et al. Cytoplasmic localization of beta-catenin is a marker of poor outcome in breast cancer patients[J]. Cancer Epi Bio Pre, 2010, 19(1):301-309.
[11] NAKOPOU LOU L, MYLONA E, PAPADAKI I, et al. Study of phospho-beta-catenin subcellular distribution in invasive breast cancers in relation to their phenotype and the clinical outcome[J]. Mod Pathol, 2006, 19(4): 556-563.
[12] WANITSUWAN W, KANNGURN S, BOONPIPATT ANAPONG T, et al. Overall expression of beta-catenin outperforms its nuclear accumulation in predicting outcomes of colorectal cancers[J]. World J Gastroenterol, 2008, 14(39):6052-6059.
[13] SANGKHATHAT S, KUSAFUKA T, MIAO J Y, et al. In vitro RNA interference against beta-catenin inhibits the proliferation of pediatric hepatic tumors[J]. Int J Oncol,2006, 28(3):715-722.

